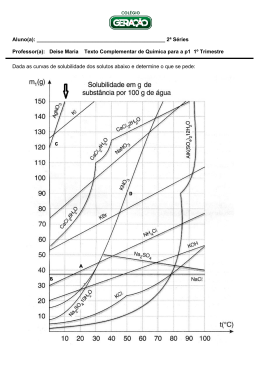
Curvas de Solubilidade SOLUÇÕES SATURADAS, INSATURADAS e SUPERSATURADAS Soluções: são misturas de duas ou mais substâncias que apresentam aspecto uniforme. Solução saturada: é a solução que contém o máximo de soluto dissolvido em uma quantidade de solvente, a dada temperatura. Exemplo: 36 g de NaCl dissolvidos em 100 g de água, a 25°C. Qualquer massa adicional de soluto a essa solução irá se depositar no fundo do recipiente e constituirá o corpo de chão ou corpo de fundo ou precipitado. Portanto o coeficiente de solubilidade do NaCl será : 36 g / 100 g de água a 25°C Em uma mesma temperatura,cada soluto, possuirá um valor característico de solubilidade, como se observa nos exemplos da tabela a seguir. Solução insaturada: é a solução que contém menor quantidade de soluto em relação à solução saturada. Solução supersaturada: é a solução que contém maior quantidade de soluto dissolvido em relação à solução saturada. A solução supersaturada é instável e pode passar facilmente para o estado saturado, com eliminação do excesso dissolvido. Exemplo: uma solução supersaturada de KNO3 será instável na presença desse sal sólido. A adição de grãos de sólido(gérmen de cristalização) a uma solução supersaturada fará com que ocorra a precipitação (cristalização) do soluto que estiver em excesso em relação à solução saturada. Curvas de solubilidade A solubilidade das substâncias depende da temperatura. No caso de solutos sólidos, na maioria dos casos a solubilidade aumenta com o aquecimento do sistema. Exemplo:
Baixar