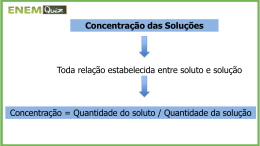
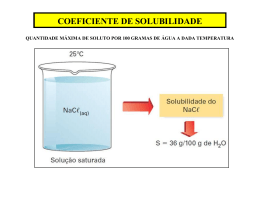
Aluno(a): ____________________________________________ 2ª Séries Professor(a): Deise Maria Texto Complementar de Química para a p1 1º Trimestre Dada as curvas de solubilidade dos solutos abaixo e determine o que se pede: 1) Qual a massa de cloreto de amônio (soluto) que precipitará (não será mais solúvel) após uma solução saturada, preparada em 20°C, ser resfriada até a temperatura de 0°C? Obs: a massa de água (solvente) utilizada foi de 100g. R: O ponto A representa a solubilidade (ou o máximo que se consegue dissolver em 100g de água) do cloreto de amônio NH4Cl na temperatura de 20°C, como a solução preparada nesta temperatura é saturada, sabe-se que se dissolveu o máximo, que é 40g. Ou seja, quando a solução foi preparada originalmente ela possuía 40g de NH4Cl totalmente dissolvidos. Após o resfriamento a temperatura é de 0°C, neste ponto (ponto B) a solubilidade (ou o máximo) é menor, sendo possível dissolver somente 30g do mesmo sal. A diferença entre o máximo nas duas temperaturas, 10g, irá precipitar ou decantar para o fundo do recipiente, após o resfriamento, se tornando o corpo de chão desta nova solução saturada. 2) Qual a massa de nitrato de potássio (KNO3) necessária para se preparar uma solução saturada do sal na temperatura de 50°C utilizando 250g de água? R: O ponto D refere-se ao ponto que corresponde a massa do soluto necessária para se preparar uma solução saturada usando-se 100g de água (observar a frase”solubilidade em g de substância por 100g de água) ou seja dissolve-se ou se solubiliza no máximo 90g de em 100g de água na temperatura de 50°C, por relação direta se em 100g são dissolvidos 90g de soluto em 250g de água serão dissolvidos 225g de soluto, nitrato de potássio. 3) Qual dos sais possui o maior aumento de solubilidade entre 0°C e 10°C? R: A faixa escolhida vai de 0°C até 10°C. O fim da faixa está indicado pela flecha no eixo. Observando-se neste intervalo de temperatura consegue-se dissolver 30g a mais de nitrato de prata do que originalmente em 0°C. No ponto C observa-se que se em 0°C dissolve-se 120 g deste soluto, subindo pela curva observa-se que em 10°C já são dissolvidos 150g, um aumento de 30g, e comparando-se este valor ao aumento observado nas demais curvas, percebe-se que é o de maior valor. Aumento de solubilidade = aumento observado na quantidade máxima de soluto. 4) De acordo com o gráfico, qual o sal mais e menos solúvel a 10°C? R: O sal mais solúvel é o nitrato de prata (AgNO3) e o menos é sulfato de alumínio e potássio dodecahidratado (AlK(SO4)2. 12H2O ), pois nesta temperatura dissolve-se muito mais massa de nitrato de prata (150g) e menos de potássio dodecahidratado (~3g) 5) Qual a massa de soluto necessária para se preparar 340g de solução saturada de KBr (brometo de potássio) na temperatura de 30°C? R: Observando-se o gráfico percebe-se que na temperatura de 30°C prepare-se 170g de solução saturada de brometo de potássio. (70g de soluto brometo de potássio +100g de solvente água). Por relação direta se em 170g de solução existem 70g, em 340g de solução saturada existem 140g de soluto. 6) Qual a massa de soluto que é necessária acrescentar em uma solução insaturada de KCl (cloreto de potássio) preparada inicialmente com 5g de KCl/100g de H2O (dados: temperatura do experimento: 30°C)? R: Para saturar essa solução insaturada serão necessários aproximadamente mais 6g de soluto, já que pelo gráfico percebe-se que são necessários aproximadamente 11g de soluto para preparar a solução saturada nesta temperatura. Deve-se acrescentar o que falta para o máximo. 7) Dado o gráfico abaixo: Foram adicionados separadamente 50g de cada um dos sais abaixo na temperatura de 50 °C, Em qual dos sistemas deverá existir uma solução saturada com corpo de fundo e em qual deverá existir uma solução insaturada? R: A estrela marca o ponto no qual o experimento foi realizado (50g de soluto na temperatura de 50°C) percebe-se que este ponto encontra-se acima das curvas de solubilidade dos sais NaCl e Ce2(SO4)3 nesta região se não for tomado nenhum cuidado especial, não será possível dissolver está massa (50g) destes sais pois esta massa já ultrapassa o máximo (curva) para os mesmo. Sendo assim não se dissolverá tudo e se formará uma solução saturada com corpo de fundo. Acima da estrela encontram-se as curvas de solubilidade para os sais K2CrO4 e KNO3 como neste ponto ainda não se dissolveu a massa máxima ao final do experimento nestes sistemas haverá uma solução insaturada.
Baixar