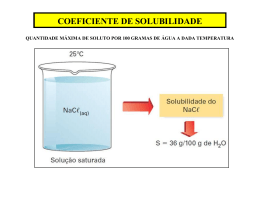
DISSOLUÇÃO Ocorre quando as forças atrativas entre as partículas de soluto e solvente são suficientes para superar as forças atrativas no solvente puro e no soluto puro. SOLUBILIDADE – quantidade máxima de material que se pode dissolver numa certa quantidade de solvente, numa temperatura constante, para formar solução estável. Ex.: 950 g de nitrato de prata em 100 ml de água a 100°C 0,00217 g de cloreto de prata em 100 ml de água a 100°C Dissolução de líquidos em líquidos •Miscíveis •Imiscíveis Octano + CCl4 miscíveis (apolares) Hidrocarbonetos + água imiscíveis Dissolução de sólidos em líquidos Ex: I2 (apolar) em CCl4 (apolar) sacarose (polar) em água (polar) As forças de pontes de hidrogênio entre a sacarose e a água são suficientemente fortes para compensar a quebra das ligações entre as moléculas de açúcar puro e entre as de água pura. Os sólidos reticulados como grafita, diamante, quartzo e areia não se dissolvem em água, pois a ligação covaente destes sólidos é muito forte para ser substituída pelas ligações hidrogênio, muito mais fracas. Ex: KF Hsol = Hhid + Hret Hsol = -819 + 821 = 2 kJ/mol Normalmente a solubilidade aumenta quando a entalpia de solução fica mais negativa. A solubilidade é favorecida quando a energia necessária para desfazer a rede do sólido é menor que a energia desprendida quando os íons se hidratam (Hhid)
Baixar