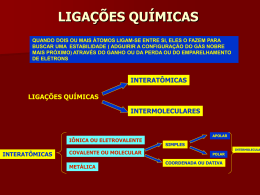
Funções inorgânicas Dissociação iônica NaCℓ Na+ + CℓEletrólitos: - Ácidos; - Compostos iônicos Composto iônico Ionização HCℓ H+ + Cℓ- Composto molecular Obs.: compostos iônicos fundidos e metais também são bons condutores de eletricidade. Funções inorgânicas Teorias ácido-base Arrhenius “Ácido é qualquer espécie que, em meio aquoso, libera H+ como único cátion”. Ex.: HCℓ(aq) H+(aq) + Cℓ-(aq) “Base é qualquer espécie que, em meio aquoso, libera OH- como único ânion”. Ex.: NaOH(aq) Na+(aq) + OH-(aq) Funções inorgânicas Teorias ácido-base Brönsted-Lowry “Ácido é qualquer espécie capaz de doar prótons”. “Base é qualquer espécie capaz de receber prótons”. Ex.: HCℓ(aq) H+(aq) + Cℓ-(aq) H+ + H2O H3O+ --------------------------------------HCℓ + H2O H3O+ + Cℓácido base ácido conjugado base conjugada Funções inorgânicas Teorias ácido-base Lewis “Ácido é qualquer espécie capaz de receber pares eletrônicos”. “Base é qualquer espécie capaz de doar pares eletrônicos”. Ex.: H+ + H2Ö H3O+ ácido base Funções inorgânicas Função Ácido H O H H Cℓ Funções inorgânicas Função Ácido H O H H+ Cℓ- Funções inorgânicas Função Ácido H Cℓ- O H H+ Funções inorgânicas Função Ácido Equação de ionização do ácido clorídrico: HCℓ + H2O (H3O)+ + Cℓ- HIDRÔNIO CLORETO Funções inorgânicas Função Ácido Fórmula geral: hidrogênio HxA Número de átomos de hidrogênio ânion Funções inorgânicas Função Ácido (Arrhenius) H2SO4 ácido sulfúrico HCℓ ácido clorídrico “muriático” HNO3 ácido nítrico H3PO4 ácido fosfórico Funções inorgânicas Função Ácido (Arrhenius) Classificação I) Presença de oxigênio: hidrácidos e oxiácidos; II) Número de hidrogênios ionizáveis: monoácido, diácido, triácido, tetrácido; III) Grau de ionização: forte, moderado e fraco. Funções inorgânicas Função Ácido (Arrhenius) Hidrogênio ionizável H H3PO3 H O P Ácido fosforoso DIÁCIDO O O H Funções inorgânicas Função Ácido (Arrhenius) Hidrogênio ionizável H CH3COOH Ácido acético MONOÁCIDO O H C C H O H Funções inorgânicas Função Ácido (Arrhenius) Força Hidrácidos: Oxiácidos: HCℓ, HBr e HI = fortes; HF = moderado; Demais = fracos n = Diferença entre a qt. de O’s e H’s. Se n = 0 fraco 1 moderado >1 forte Obs.: H2CO3 e orgânicos são fracos Funções inorgânicas Função Ácido (Arrhenius) Nomenclatura Hidrácidos: terminação ÍDRICO Oxiácidos: terminação OSO (NOx<5) ou ICO Exceto H2CO3 (ácido carbônico); NOx 1 ou 2 prefixo hipo. NOx 7 prefixo per. Funções inorgânicas Função Base (Arrhenius) H Na+ O- Funções inorgânicas Função Base (Arrhenius) H Na+ O- Funções inorgânicas Função Base (Arrhenius) Equação de dissociação do hidróxido de sódio: NaOH Na+(aq) + (OH)-(aq) H2O HIDRÓXIDO Funções inorgânicas Função Base (Arrhenius) Fórmula geral: M(OH)x Cátion metálico hidroxila Única base não metálica: NH4OH Funções inorgânicas Função Base (Arrhenius) NaOH Hidróxido de sódio Aℓ(OH)3 Hidróxido de alumínio Ca(OH)2 Hidróxido de cálcio NH4OH Hidróxido de amônio Funções inorgânicas Função Base (Arrhenius) Indicadores ácido-base são substâncias que mudam de cor de acordo com o caráter (ácido ou básico) da solução às quais são misturadas. Tornassol Fenolftaleína Funções inorgânicas Função Base (Arrhenius) Classificação I) Solubilidade em água: grupo 1, grupo 2 (exceto Mg) e NH4OH; II) Número de hidroxilas: monobase, dibase, tribase, tetrabase; III) Grau de dissociação: fortes (solúveis) e fracas (insolúveis e NH4OH). Funções inorgânicas Função Base (Arrhenius) Nomenclatura I) Para bases únicas de um cátion HIDRÓXIDO de NOME DO CÁTION Ex.: NaOH hidróxido de sódio Ca(OH)2 hidróxido de cálcio NH4OH hidróxido de amônio Funções inorgânicas Função Base (Arrhenius) Nomenclatura II) Para bases diferentes de um mesmo metal HIDRÓXIDO de NOME DO METAL (NOx em romanos) ou OSO para menor NOx HIDRÓXIDO + NOME DO METAL + ICO para maior NOx Ex.: CuOH hidróxido de cobre I ou hidróxido cuproso Cu(OH)2 hidróxido de cobre II ou hidróxido cúprico
Baixar