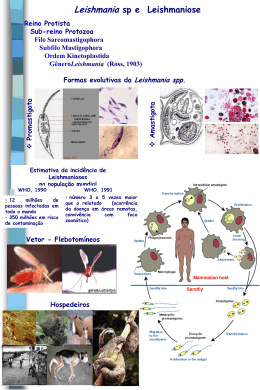
Leishmanioses Os tripanossomatídeos parasitas Família Trypanosomatidae Gêneros Leishmania - leishmaniose cutânea e visceral Trypanosoma - T. cruzi - Doença de Chagas T. brucei- Doença do Sono Phytomonas - parasitas de plantas Leishmania Família Trypanosomatidae Gênero Leishmania Sub-gêneros Leishmania Viannia Mais de 30 espécies descritas Ciclo de vida Ciclo de vida amastigota Hospedeiro mamífero picada picada inseto promastigota http://www.who.int/tdr/media/multimedia/lifecycle.htm Vetor Phlebotomus spp. Lutzomyia spp. “Mosquito palha” A doença é transmitida por insetos flebotomíneos (Phlebotomus spp., Lutzomyia spp.), que são pequenos e se reproduzem e vivem em solo úmido em áreas de matas ou florestas. A fêmea se alimenta de sangue de animais silvestres e/ou domésticos ou homens. Morfologia - promastigotas inseto Formas extracelulares, encontradas no intestino do inseto vetor. Sofrem um processo de diferenciação celular durante a passagem pelo inseto, denominado metaciclogênese. Ciclo de vida amastigota Hospedeiro mamífero picada picada inseto promastigota metacíclico promastigota Hospedeiro mamífero amastigota Hospedeiro acidental Reservatórios Hospedeiro mamífero Roedores silvestres, marsupiais, canídeos HOMEM Amastigotas presentes em macrófagos da pele, gânglios linfáticos, vísceras. Morfologia - amastigotas Formas intracelulares encontradas no hospedeiro mamífero. Multiplicam-se por divisão binária. A célula hospedeira por excelência é o macrófago. Mecanismo de infecção O hospedeiro vertebrado se infecta pela picada do vetor. Os amastigotas são liberados no intestino do vetor e transformamse em promastigotas procíclicos. Estes se reproduzem inicialmente por divisão binária e posteriormente se diferenciam em promastigotas metacíclicos. Os promastigotas invadem macrófagos circulantes ou teciduais e se reproduzem como amastigotas. O vetor ingere macrófagos infectados com o sangue ingerido O macrófago parasitado eventualmente se rompe, liberando amastigotas que passam a infectar outros macrófagos, circulantes ou teciduais. Síndromes clínicas Leishmaniose cutânea – L. braziliensis, L. amazonensis, L. guyanensis Leishmaniose cutâneo-difusa – L. amazonensis Leishmaniose cutâneo-mucosa – L. braziliensis Leishmaniose visceral – L. chagasi Síndromes clínicas Leishmaniose cutânea localizada: exclusivamente lesões cutáneas limitadas, ulcerosas ou não. Leishmaniose cutâneo-mucosa: lessões ulcerosas destrutivas nas mucosas do nariz, boca e faringe Leishmaniose cutâneo- difusa: formas diseminadas cutáneas, não ulcerosas que aparecem em individuos anérgicos. Leishmaniose visceral: formas viscerais em que os parasitas apresentam acentuado tropismo pelo sistema FM do baço, fígado, tecidos linfóides e médula ósea. Quadro clínico - forma cutânea localizada L. (V.) braziliensis L. (V.) guyanensis L. (L.) amazonensis L. (L.) mexicana Evolução clássica: 2-8 sem após infecção 1.Nódulo/Pápula no local infecção 2.Crosta central 3.Úlcera clássica Quadro clínico - forma cutânea localizada L. (V.) braziliensis L. (V.) guyanensis L. (L.) amazonensis L. (L.) mexicana Reservatório: roedores silvestres, marsupiais (gambá), preguiça, tamanduá Quadro clínico - forma cutânea L. (V.) braziliensis L. (V.) guyanensis L. (L.) amazonensis L. (L.) mexicana Reservatório: roedores silvestres, marsupiais (gambá), preguiça, tamanduá Quadro clínico - forma cutânea difusa L. (L.) amazonensis - Anergia da resposta imune - Disseminação da doença (lesões nodulares) e difícil tratamento Reservatório: roedores silvestres Quadro clínico - forma muco-cutânea L. (V.) braziliensis - Evolução pode ser concomitante a uma manifestação de LC ou até vários anos após tratamento de LC - Ulceração e erosão que destroem progressivamente tecidos moles e cartilagens das cavidades oronasal e faríngea. Reservatório: ? roedores silvestres Quadro clínico - forma muco-cutânea L. (V.) braziliensis Em geral, o acometimento inicial é de cornetos e septos nasais, faringe, pálato e úvula. Posteriormente a doença pode se extender à epiglote, laringe e cordas vocais, o que caracteriza doença grave. Quadro clínico - forma muco-cutânea L. (V.) braziliensis •Doença crônica, associada a considerável morbidade e estigma social. •Tratamento é prolongado e tóxico. Quadro clínico - forma visceral ou Calazar L. (L.) chagasi L. donovani L. infantum No Brasil, crianças são grupo de risco. QC: febre irregular, perda de peso acentuada, aumento de baço e fígado, e anemia. No Velho Mundo – possível evolução como Pós Calazar dermal (PKDL) após o tratamento. Quadro clínico - forma visceral L. chagasi L. donovani L. infantum •Período de incubação pode variar de 10 dias a 24 meses, com média de 2 a 6 meses. •Porém, somente uma parcela dos indivíduos infectados irão evoluir com sinais e sintomas da doença. Forma visceral - reservatórios L. chagasi - Área urbana: canídeo é o reservatório principal (infecção é mais prevalente do que no homem) - Ambientes silvestres: raposa e marsupiais foram encontrados infectados. Forma visceral - vetor L. chagasi Vetores de Leishmaniose Visceral no Brasil: Mosquito palha, birigui, tatuquira, etc.. -Lutzomyia longipalpis (NE, N, SE, CO), adaptado a ambientes sivestres, rurais e urbanos. -Lutzomyia cruzi (Mato Grosso) -Desenvolvimento do ovo – adulto é de ~ 30 – 40 dias -Principal atividade: crepuscular e noturna Epidemiologia Leshmanioses: zoonoses que envolvem diferentes espécies de Leishmania, hospedeiros invertebrados e hospedeiros vertebrados. O homem é um hospedeiro acidental (exceto para L. donovani na India). Doença de transmissão relacionada à proximidade de áreas de desmatamento, ou próximas a florestas. Recentemente, tem se expandido para áreas urbanas, especialmente a doença visceral, ou calazar. Epidemiologia Hospedeiros invertebrados: Mosquitos da família Psychodidae, subfamília Phlebotominae Aproximadamente 30 espécies distribuidas nos géneros: Lutzomyia e Psychodopigus (Novo Mundo) Phlebotomus (leishmaniases da Europa, Asia e Africa) Epidemiologia Características gerais dos vectores de Leishmania: Orden Diptera, Familia Phlebotominae: são hemimetabólicos. Somente as fémeas são hematófagas quando vão pôr seus ovos. O fazem no solo ou lugares úmidos das florestas, matas, bosques ou plantações. As larvas se transformam em adultos em (aprox.) um mes. As fémeas geralmente se alimentam de sangue de animais silvestres, mas algumas especies são antropófilas. Epidemiologia A distribuição geográfica das diferentes espécies de Leishmania está relacionada com a distribuição dos vectores. Exemplo: L.(V.) brasiliensis no Brasil é transmitida por: Lutzomyia intermedia: ampla distribuição geográfica, hábitos semidomésticos Lutzomyia pessoai: ampla distrubuição geográfica. Habitat selvagem Lutzomyia wellcomei: presente fundamentalmente na região amazónica L. (V.) amazonensis no Brasil é transmitida por Lu. Flaviscutellata L. (V.) guyanensis é transmitida principalmente por Lu. Umbratilis Lu. longipalpis é vector de LV em práticamente todos os focos investigados. Paisagem - epidemiologia Doença de transmissão relacionada à proximidade de áreas de desmatamento, ou próximas a florestas. Recentemente, tem se expandido para áreas urbanas, especialmente a doença visceral, ou calazar. Leishmaniose – Quadro Mundial População sob risco: 350 milhões Distribuição: 88 países em 4 continentes Prevalência: 12 milhões de casos Mortes: 57.000/ ano Atuais situações de epidemia de LV e LC Coinfecção Leishmania/HIV Distribuição Geográfica da Leishmaniose Cutânea 1,5 milhão de casos novos por ano (CL, ML, DCL) 90% dos casos de leishmaniose cutânea ocorrem no Afeganistão, Brasil, Iran, Peru, Arábia Saudita e Síria. (100.000 casos em Kabul em 2002). 90% dos casos de leishmaniose mucocutânea ocorrem na Bolívia, Brasil and Peru; Distribuição Geográfica da Leishmaniose Visceral 500.000 casos novos por ano (CL, ML, DCL) Distribuição geográfica - leishmaniose visceral 90% dos casos em Bangladesh, Brasil, India, Nepal e Sudão. Nos anos 90, 100.000 mortes no Sudão (dentre 300.000) Leishmaniose Tegumentar (cutánea) no Brasil •Número crescente de casos de Leishmaniasis Tegumentar Americana no Brasil (aumento real + melhoria da notificação) •1980 – 4.560 casos •1985 – 13.654 casos •1990 – 24.753 casos •1995 – 35.748 casos •2000 – 33.439 casos Fontes: Boletim Eletrônico Epidemiológico, LTA, ano 02, n.05, 2002, Min Saúde; MS/SVS, SES e SINAN Leishmaniose Tegumentar no Brasil – Distribuição Geográfica Doença de ampla distribuição no território nacional (N, NE, CO, SE) Agentes: Leishmania braziliensis, L. guyanensis, L. amazonensis Causam doença Cutânea, Muco-cutânea e forma cutânea difusa Fonte: Boletim Eletrônico Epidemiológico, LTA, ano 02, n.05, 2002, Min Saúde LV no Brasil – Incidência Anual •66% dos casos registrados na Bahia, Ceará, Maranhão e Piauí •Últimos 10 anos, média de 3.156 casos novos/ano •Incidência= 2/100.000 hab, ~ 6% evoluem a óbito •Pop de risco: 54,4% casos em menores de 10 anos (desnutrição, imun celular) Fonte: Manual de Vigilância e Controle da LV, Min Saúde LV no Brasil – Distribuição Geográfica •Distribuição ampla: N, NE, SE, CO •Região NE: 90% década 90 para 77% anos 2000 •Urbanização da LV (surtos RJ, BH, Araçatuba, Natal, São Luís, Santarém, etc..) Fonte: Manual de Vigilância e Controle da LV, Min Saúde Distribuição geográfica – leishmaniose visceral / AIDS Europa – 1990 - 1998 Número de casos de AIDS Número de casos de co-infecção AIDS/leishmaniose http://www.who.int/emc-documents/surveillance/docs/whocdscsrisr2001.html Mecanismos de evasão As moléculas de superfície mais abundantes do promastigota são um glicolípide- LPG, e uma glicoproteína com função de protease gp63. O LPG é modificado durante a metaciclogênese, facilitando a migração do promastigota para o esôfago. As modificações no LPG também estão relacionadas à resistência à lise por complemento que os promastigotas metacíclicos apresentam, quando injetados no hospedeiro mamífero. Mecanismos de evasão Mecanismos de evasão multiplicação no intestino – aderência - procíclico “livre” para o próximo hospedeiro - metacíclico Mecanismos de evasão mecanismos de defesa inata… LPG e complemento complexo de lise “chegando em casa…” - o macrófago! Interação com receptor C3bi via complemento e gp63 inibição do burst respiratório burst “arrumando a casa”... o vacúolo parasitóforo Fusão com lisossomos: gp63 é uma protease LPG e outros GL induzem a produção de TGF- e IL-10 E… inibem a produção de NO. Doença Resposta imune 1- Celular Macrófago infectado Ativação do “burst respiratório” e produção de NO Apresentação de antígenos na superfície Linfócitos imunes Th1 (IL2, IFN) Th2 (IL4, IL5) Ausência de ativação de macrófagos Resposta imune A resposta protetora primária contra leishmaniose é mediada por células. • Pacientes com L Cutânea – forte DTH, resposta proliferativa in vitro • Pacientes com L Difusa – ausência de resposta celular e proliferação descontrolada de parasitas e lesões • Pacientes com L Mucosa – hiper-reatividade da resposta celular • Pacientes com L Visceral Aguda – não apresentam DTH e proliferação in vitro. Porém, este quadro é revertido após o tratamento. Th1 Th2 Th1 Resposta imune do tipo 1, baixos títulos de Ac e ampla linfoproliferação Th2 Resposta imune do tipo 2, Infecção progressiva, Ac altos, RI deficiente ou anérgica Diagnóstico Parasitológico 1- Identificação de amastigotas do parasita: • LC – biópsia ou raspado de lesão de pele • LV - aspirado de medula óssea, baço, fígado ou linfonodos. •pesquisa direta – ainda o mais utilizado, fatores influenciam sensibilidade.. •cultura (meio NNN/LIT) – 5 dias a 4 semanas para o diagnóstico. •inoculação de animais – não é muito útil para dx de rotina, 1-3m. SENSIBILIDADE : ESPECIFICIDADE: (variável) (gênero) Diagnóstico parasitológico 2- Identificação de amastigotas do parasita: • LC – biópsia ou raspado de lesão de pele • LV - aspirado de medula óssea, baço, fígado ou linfonodos. pesquisa direta cultura DNA (PCR) Isoenzimas (gold std espécies) anticorpos monoclonais SENSIBILIDADE : ESPECIFICIDADE: Diagnóstico Imunológico 3- Imunodiagnóstico - Reação de Montenegro (ainda muito útil para LC) - Sorologia (imunofluorescência indireta ou ELISA) SENSIBILIDADE : (calazar) ESPECIFICIDADE: (gênero, reações cruzadas) Diagnóstico Métodos diretos: deteção do agente etiológico Vantagens: permite a identificação do agente etiológico. Alta especificidade. Desvantagens: as técnicas envolvidas geralmente requerem maior infraestrutura. Pode ser demorado (até várias semanas de incubação). Dificuldades para serem aplicados em campo. Alto custo. Técnicas: observação de amostras e biopsias, cultura do organismo. PCR convencional e quantitativa Diagnóstico Métodos indiretos: deteção de sinais que permitem inferir a presença do agente etiológico Vantagens: alta sensibilidade, técnicas fácilmente adaptáveis para serem aplicados a campo. Baixo custo. Desvantagens: geralmente baixa especificidade. Não permitem a identificação de cepas, subespécies e espécies. Técnicas: técnicas sorológicas em geral, como ELISA, IFI, fixação de complemento, aglutinação direta ou indireta. No caso específico das leishmanioses cutânea, intradermoreação de Montenegro. Diagnóstico parasitológico 1- Identificação de amastigotas do parasita: • LC – biópsia ou raspado de lesão de pele • LV - aspirado de medula óssea, baço, fígado ou linfonodos. •pesquisa direta – ainda o mais utilizado, fatores influenciam sensibilidade.. •cultura (meio NNN/LIT) – 5 dias a 4 semanas para o diagnóstico. •inoculação de animais – não é muito útil para dx de rotina, 1-3m. SENSIBILIDADE : ESPECIFICIDADE: (variável) (gênero) Diagnóstico parasitológico 2- Identificação de amastigotas do parasita: • LC – biópsia ou raspado de lesão de pele • LV - aspirado de medula óssea, baço, fígado ou linfonodos. pesquisa direta cultura DNA (PCR) Isoenzimas (gold std espécies) anticorpos monoclonais SENSIBILIDADE : ESPECIFICIDADE: Diagnóstico Imunológico 3- Imunodiagnóstico - Reação de Montenegro (ainda muito útil para LC) -Sorologia (imunofluorescência indireta ou ELISA) -(é insatisfatória: pouca especificidade) -Calazar: pode ser negativa. SENSIBILIDADE : (calazar) ESPECIFICIDADE: (gênero, reações cruzadas) Diagnóstico na vigência de AIDS Lesoes atípicas portanto a clinica não e de valor diagnostico. Diagnóstico laboratorial. Terapêutica antimoniais pentavalentes Glucantime, Pentostam (1a escolha) anfotericina B (2a escolha) pentamidina TOXICIDADE DURAÇÃO DO TRATAMENTO RESISTÊNCIA Terapêutica - mecanismos de ação antimoniais pentavalentes (Glucantime, Pentostam) - inibem a via glicolítica e a oxidação de ácidos graxos. anfotericina B - altera síntese de fosfolípides de membrana pentamidina - altera a estrutura do cinetoplasto e síntese de poliaminas. Perspectivas: - antimoniais ou anfotericina em lipossomos - interferon (LV) - miltefosine (via oral) – já registrado na Índia - paramomicina (IM, tópica) - Combinação de drogas ou imunoquimioterapia para evitar Resist. Profilaxia Controle do vetor Controle do hospedeiro mamífero RESERVATÓRIOS PACIENTES Profilaxia Controle do vetor - construção de moradias distantes da mata - telas de proteção - repelentes. Problemas: o vetor não é domiciliar, é capaz de desenvolver resistência aos inseticidas. Os inseticidas apresentam efeito residual curto. Profilaxia RESERVATÓRIOS - eliminação Controle do hospedeiro mamífero dos reservatórios domésticos PACIENTES - tratamento Problemas: - os reservatórios selvagens não podem ser “eliminados”; - o tratamento é longo, existem efeitos colaterais, muitos pacientes não têm acesso ao tratamento. VACINA OMS - Programa de Vigilância e Controle de Leishmaniose Objetivos Reduzir a incidência da doença tão rápido quanto possível a um nível no qual cada país possa integrar atividades de controle e vigilância às suas atividades gerais de promoção de saúde. Para atingir essa meta, a OMS propõe os seguintes objetivos: - Facilitar o diagnóstico precoce e tratamento; - Controlar a população de vetores através de borrifação de inseticidas com ação residual nas casas e uso de mosquiteiros impregnados com inseticida; - promover educação e produzir materiais para treinamento; - detectar e conter epidemias em seus estágios iniciais; - facilitar o diagnóstico precoce e tratamento eficaz das co-infecções Leishmania/HIV. VACINA Profilaxia VACINAS - No começo deste século, utilizava-se inoculação de fragmentos de lesão em áreas do corpo não expostas (Rússia, Europa Oriental; L. major). - Parasitas mortos, com ou sem BCG: vacina atualmente sendo submetida a testes clínicos (L. amazonensis, Brasil; L. major, Sudão). Em fase de desenvolvimento: - Parasitas vivos, recombinantes. - Bacterias ou vírus recombinantes (Salmonella-gp63; Vacciniagp46). -Subunidades definidas (gp63 recombinante; peptídeos sintéticos). - Vacinas de DNA
Download