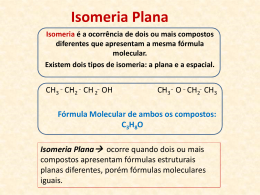
ISOMERIA Isomeria Plana Isomeria Espacial (geométrica e Óptica) DEFINIÇÕES iso = igual meros = parte Isomeria: é o fenômeno pelo qual o mesmo grupo de átomos dá origem a substâncias diferentes devido a arranjos atômicos diferentes. Isômeros: são compostos com a mesma fórmula molecular, mas com arranjos atômicos diferentes; portanto com propriedades diferentes. DEFINIÇÕES Isomeria Plana: é aquela em que os compostos apresentam diferentes fórmulas estruturais planas, portanto a diferença dos compostos é visível no plano. Isomeria espacial: é aquela em que os compostos têm a mesma fórmula plana, mas estruturas espaciais diferentes. ISOMERIA PLANA A Isomeria Plana pode ser: de cadeia, de posição, de compensação ou metameria, de função ou funcional, dinâmica ou tautomeria. A Isomeria Espacial se divide em: Isomeria Geométrica ou Cis-Trans (Z e E) Isomeria Óptica Plana Isomeria 1. Cadeia 2. Posição 3. Função 4. Metameria 5. Tautomeria 1. Geométrica Espacial 2. Óptica ISOMERIA PLANA ISOMERIA DE CADEIA pertencentes a mesma função e que diferem no tipo de cadeia carbônica; CH3- CH = CH2 C3H6 Propeno CH2 CH2- CH2 Ciclopropano ISOMERIA DE CADEIA CH3 CH3- CH - CH3 C4H10 Metilpropano CH3- CH2- CH2 - CH3 Butano ISOMERIA DE POSIÇÃO pertencentes a mesma função orgânica, com a mesma cadeia principal, mas que possuem grupos funcionais ou duplas e triplas ligações em posições diferentes; 1 2 3 4 CH2=CH-CH2-CH3 Buteno-1 C4H8 1 2 3 4 CH3-CH=CH-CH3 Buteno-2 ISOMERIA DE POSIÇÃO 3 2 1 CH3- CH2- CH2- OH Propan-1-ol C3H8O 1 2 3 CH3- CH- CH3 OH Propan-2-ol ISOMERIA DE COMPENSAÇÃO OU METAMERIA diferem pela posição de um heteroátomo na cadeia carbônica; CH3- CH2 -O- CH2 - CH3 C4H10O Etóxietano CH3 -O- CH2 - CH2 - CH3 Metóxipropano ISOMERIA DE FUNÇÃO mesma fórmula molecular que pertencem a funções diferentes. Os casos mais comuns de isomeria plana de função ocorrem entre: Álcoois e Éteres; Aldeídos e Cetonas; Ácido Carboxílicos e Ésteres. ISOMERIA DE FUNÇÃO Álcoois e Éteres: CH3- CH2 – OH Etanol C2H6O CH3- O - CH3 Metóximetano ISOMERIA DE FUNÇÃO Aldeídos e Cetonas: CH3- CH2 - CHO C3H6O Propanal CH3 - CO - CH3 Propanona ISOMERIA DE FUNÇÃO CH3- CH2 -COOH C3H6O2 Ácido Propanóico CH3 -COO- CH3 Etanoato de metila ISOMERIA DINÂMICA OU TAUTOMERIA caso particular de isomeria funcional onde os dois isômeros ficam em equilíbrio dinâmico; Enol CH2 H C OH Aldeído H CH3 - C Tautomeria aldo-enólica O ISOMERIA ESPACIAL ISOMERIA ESPACIAL pode ser explicada por meio de estruturas espaciais. É também chamada ESTEREOISOMERIA ISOMERIA GEOMÉTRICA Isomeria CIS-TRANS mesma fórmula estrutural plana, mas há que se considerar átomos ligantes espacialmente; Exemplo: 1,2-Dicloroeteno CIS TRANS CONDIÇÕES PARA OCORRÊNCIA Compostos com ligação dupla e cada carbono com dupla deve possuir dois radicais diferentes. Compostos cíclicos que possuam dois carbonos com dois radicais diferentes em cada um. ISOMERIA GEOMÉTRICA Cis – Quando os radicais mais simples estiverem do mesmo lado. Trans – Quando os radicais mais simples estiverem em lados opostos. ISOMERIA GEOMÉTRICA ISOMERIA ÓPTICA São aqueles cuja a única diferença está no comportamento diante de uma luz polarizada (luz polarizada é aquela que vibra em um único sentido). Para que um composto orgânico seja opticamente ativo é necessário que suas moléculas seja assimétricas, ou seja, suas moléculas devem possuir carbono assimétrico, que é o carbono que possui os quatro ligantes diferentes, ou seja, carbono com ligação dupla ou tripla nunca pode ser assimétrico. O carbono assimétrico ou quiral é representado por C*. CARBONO ASSIMÉTRICO OU QUIRAL OU ESTEREOCENTRO. O carbono quiral é marcado com um asterísco (*), este carbono possui todos os ligantes diferentes. * Nos enantiômeros, um é a imagem especular do outro, ou seja, um é a imagem refletida do outro. No entanto, eles não são superponíveis. ISOMERIA ÓPTICA Enantiômero Dextrógiro (d, +) - provoca o giro da luz polarizada para a direita. Enantiômero Levógiro (l, -) - provoca o giro da luz polarizada para a esquerda. Mistura Racêmica - ópticamente inativa (mistura de 50% de dextrógiro com 50% de levógiro. DETERMINAÇÃO DO NºDE ISÔMEROS ÓPTICOS (LEI DE VAN'T HOFF) Compostos com nC* diferentes: 2nisômeros opticamente ativos, sendo 2n-1dextrógiros, 2n-1 levógiros e 2n-1racêmicos. ISOMERIA ÓPTICA 2 estereocentros 3-metil-2-pentanol IOA = 2n = 22 = 4, 4 isômeros ópticos ativos EXERCÍCIOS 01) Um isômero do éter CH3OCH3 é o: a) ácido acético. b) éter dietílico. c) propanol. d) etanol. e) etano. EXERCÍCIOS 02)Os ciclenos são isômeros dos: a) alcanos. b) alcinos. c) alcenos. d) ciclanos. e) ciclodienos. EXERCÍCIOS 03)O metilciclopropano é isômero do: a) 1-butino. b) ciclobutano. c) 2-butino. d) ciclopropano. e) ciclobuteno. EXERCÍCIOS 04) Indique, dentre as alternativas a seguir, a que apresenta um hidrocarboneto isômero do 2, 2, 4 – trimetilpentano. a) Octano. b) Pentano. c) Propano. d) Butano. e) Nonano. EXERCÍCIOS 05) Sobre os compostos: éter metil fenílico e meta-hidroxitolueno. (0) São isômeros. (1) Pertencem à mesma função química. (2) Ambos possuem fórmula molecular C7H8O. (3) Ambos são aromáticos. (4) Ambos são isômeros do álcool benzílico. EXERCÍCIOS 06)Os compostos etanol e éter dimetílico demonstram que caso de isomeria? a) Cadeia. b) Posição. c) Compensação. d) Função. e) Tautomeria. EXERCÍCIOS 07) Os compostos etóxipropano metóxibutano apresentam: a) isomeria de cadeia. b) isomeria de posição. c) isomeria de compensação. d) isomeria funcional. e) tautomeria. e EXERCÍCIOS 08) A, B e C têm a mesma fórmula molecular:C3H8O. A tem um hidrogênio em carbono secundário e é isômero de posição de B. Tanto A como B são isômeros de função de C. Escreva as fórmulas estruturais e os nomes de A, B e C. EXERCÍCIOS 09) “A 4-metil-2-pentanona é usada como solvente na produção de tintas, ataca o sistema nervoso central, irrita os olhos e provoca dor de cabeça”. O composto citado é isômero funcional de: a) 1-hexanol. b) hexanal c) 4-metil-butanal. d) 4-metil-1-pentanol. e) pentanona. EXERCÍCIOS Podemos verificar entre os hidrocarbonetos isomeria dos tipos: a) função e posição. b) posição e cadeia. c) metameria e função. d) tautomeria e cadeia. e) metameria e posição. EXERCÍCIOS Tem isomeria cis-trans e apresenta dois carbonos hibridizados em sp² , o composto: a) H2C = CH – CH2 – CH3. b) H3C – CH = CH – CH3. c) H2C = C – CH3 | CH3 EXERCÍCIOS Assinalar entre os compostos abaixo aquele que apresenta carbono assimétrico: a) 2-metilpentano. b) 2-propanol. c) 2 , 3 – dimetilbutano. d) 2 , 3 , 4 – trimetilpentano. e) 3 – metil – 2 – butanol.
Baixar