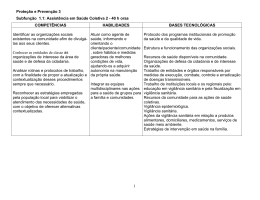
Curso de Farmacovigilância Como reconhecer uma Reação Adversa de Medicamento Dr. Sergio Mengardo Farmacêutico do Núcleo de Farmacovigilância Centro de Vigilância Sanitária CVS-SES-SP Centro de Vigilância Sanitária Núcleo de Farmacovigilância www.cvs.saude.sp.gov.br Classificação de reações adversas quanto ao mecanismo da reação Centro de Vigilância Sanitária Núcleo de Farmacovigilância www.cvs.saude.sp.gov.br Classificação de Rawlins e Thompson Reação adversa tipo A (augmented) • Comum • Relacionada a um efeito farmacológico da droga • Esperada • Relação com a dose • Baixa mortalidade Antimetabólitos ( 5-FU), provocando Leucopenia Os antimetabólitos bloqueiam a reação de metilação interferindo com a síntese de DNA e RNA, provocando a morte celular principalmente de celulas de rápida divisão celular Irritação gástrica com AINEs Centro de Vigilância Sanitária Núcleo de Farmacovigilância www.cvs.saude.sp.gov.br 3 Quanto ao mecanismo Classificação de Rawlins e Thompson Reação adversa tipo B (Bizarre) • Incomum • Não relacionada a um efeito farmacológico da droga • Inesperada • Não tem relação com a dose • Alta mortalidade Síndrome de Stevens-Jonhson por docetaxel Reação anafilática por β lactâmicos Centro de Vigilância Sanitária Núcleo de Farmacovigilância www.cvs.saude.sp.gov.br 4 Quanto ao mecanismo Classificação de Rawlins e Thompson Reação adversa tipo C (cronic) é detectada em estudos farmacoepidemiológicos • Relacionado à dose e ao tempo de uso • Relacionada ao efeito cumulativo do fármaco Tromboembolismo com anticoncepcional Infarto agudo do miocárdio com rofecoxibe Supressão do eixo hipotalâmico-hipofisário-adrenal por corticosteróides Centro de Vigilância Sanitária Núcleo de Farmacovigilância www.cvs.saude.sp.gov.br 5 Quanto ao mecanismo (Adaptado de Edwards; Aroson; 2000 (11)) Reação adversa tipo D (Delayed). • Incomum • Normalmente relacionado à dose • Ocorre ou aparece algum tempo após o uso do medicamento Perfuração gastrointestinal , 13 a 16 dias após o primeiro ciclo do medicamento paclitaxel (Seewaldt et al, 1993) Carcinogênese Tumor de esôfago com bisfosfonatos Centro de Vigilância Sanitária Núcleo de Farmacovigilância www.cvs.saude.sp.gov.br 6 Quanto ao mecanismo (Adaptado de Edwards; Aroson; 2000 (11)) Reação adversa tipo E (end of use) • Relacionado a abstinência • Ocorre logo após a suspensão do medicamento Síndrome de abstinência à opiáceos Isquemia Miocárdica, por suspensão de β bloqueadores Centro de Vigilância Sanitária Núcleo de Farmacovigilância www.cvs.saude.sp.gov.br 7 Quanto ao mecanismo (Adaptado de Edwards; Aroson; 2000 (11)) Reação adversa tipo F (failure), falha inesperada da terapia. • Comum • Relacionado à dose • Freqüentemente causado por interação de medicamentos Categorias de risco emético Alto potencial emético: risco de êmese > 90% (cisplatina IV) Moderado: risco > 30% e < 90% Baixo: 10 – 30% Mínimo: 10% Centro de Vigilância Sanitária Núcleo de Farmacovigilância www.cvs.saude.sp.gov.br 8 Quanto à expectativa Esperado (ou descrito ou conhecido) É aquela cuja descrição consta na bula do medicamento. Inesperado (não descrito ou desconhecido) É aquela cuja descrição NÃO consta na bula do medicamento. Pode ser raro ou desconhecido. Centro de Vigilância Sanitária Núcleo de Farmacovigilância www.cvs.saude.sp.gov.br 9 Eritrofagocitose medicamentosa (indinavir) Fonte: G. IAMBATTISTA; L. OBREGLIO, M.D, ANTONIO VALACCA, M.D. Vito Fazzi General Hospital, Lecce, Italy Centro de Vigilância Sanitária Núcleo de Farmacovigilância www.cvs.saude.sp.gov.br Tricomegalia por interferon alfa-2b Fonte: Almudena Hernández-Núñez, Jesús Fernández-Herrera, de Vigilância Sanitária de la Princesa, 28006 Madrid, Spain Department of Centro Dermatology, Hospital Universitario Núcleo de Farmacovigilância www.cvs.saude.sp.gov.br Centro de Vigilância Sanitária Núcleo de Farmacovigilância www.cvs.saude.sp.gov.br Centro de Vigilância Sanitária Núcleo de Farmacovigilância www.cvs.saude.sp.gov.br Walkin’ snake reported by Joan Fontcuberta Evento desconhecido ... Centro de Vigilância Sanitária Núcleo de Farmacovigilância www.cvs.saude.sp.gov.br 14 Centro de Vigilância Sanitária Núcleo de Farmacovigilância www.cvs.saude.sp.gov.br 15 Tipos de associações • Previamente fixadas nos produtos • Fixadas pelos médicos para o mesmo paciente • Associações ocasionais Centro de Vigilância Sanitária Núcleo de Farmacovigilância www.cvs.saude.sp.gov.br 16 Tipos de Interações • Mecanismos físicos ou físico-químicos diretos • Mecanismos farmacocinéticos • Mecanismos farmacodinâmicos Centro de Vigilância Sanitária Núcleo de Farmacovigilância www.cvs.saude.sp.gov.br 17 Centro de Vigilância Sanitária Núcleo de Farmacovigilância www.cvs.saude.sp.gov.br 18 E1 Parâmetros para classificação Gravidade do efeito Período de latência Leve Moderada Grave Rápido Lento Classificação por previsibilidade Centro de Vigilância Sanitária Núcleo de Farmacovigilância altamente previsível previsível não previsível não estabelecida www.cvs.saude.sp.gov.br Slide 19 E1 Podemos clasificar as interações medicamnetosas qto:Gravidade do efeito: -leves-peq. significado clínico moderadas-aparec/ de efeitos nocivos alterando o estado físico do paciente graves-letais as lleves e moderadas podem ser revertidas as letais devem ser evitadas EDNA; 10/08/2003 Centro de Vigilância Sanitária Núcleo de Farmacovigilância www.cvs.saude.sp.gov.br 20 Atenção: os casos clínicos são fictícios devido a confidencialidade, conforme a Portaria CVS 05/2010 Centro de Vigilância Sanitária Núcleo de Farmacovigilância www.cvs.saude.sp.gov.br 21 Atenção: os casos clínicos são fictícios devido a confidencialidade, conforme a Portaria CVS 05/2010 Relato de Gestação? Contraceptivo RDC 04/2009 Art.4º; § 4º. Os detentores de registro de medicamentos são responsáveis por registrar, acompanhar e avaliar os casos de exposição de pacientes grávidas a medicamentos, quando do seu conhecimento. Contraceptivo associado a outro medicamento Grupo Técnico de Medicamentos Centro de Vigilância Sanitária Núcleo de Farmacovigilância www.cvs.saude.sp.gov.br 22 Table US FDA Pregnancy Category Definitions A B C D X Controlled studies in women fail to demonstrate a risk to the fetus in the first trimester (and there is no evidence of a risk in later trimesters), and the possibility of fetal harm appears remote. Either animal-reproduction studies have not demonstrated a fetal risk but there are no controlled studies in pregnant women or animal-reproduction studies have shown adverse effect (other than a decrease in fertility) that was not confirmed in controlled studies in women in the first trimester (and there is no evidence of a risk in later trimesters). Either studies in animals have revealed adverse effects on the fetus (teratogenic or embryocidal or other) and there are no controlled studies in women or studies in women and animals are not available. Drugs should be given only if the potential benefit justifies the potential risk to the fetus. There is positive evidence of human fetal risk, but the benefits from use in pregnant women may be acceptable despite the risk (e.g., if the drug is needed in a life-threatening situation or for a serious disease for which safer drugs cannot be used or are ineffective). Studies in animals or human beings have demonstrated fetal abnormalities or there is evidence of fetal risk based on human experience or both, and the risk of the use of the drug in pregnant women clearly outweighs any possible benefit. The drug is contraindicated in women who are or may become pregnant. Centro de Vigilância Sanitária Núcleo de Farmacovigilância www.cvs.saude.sp.gov.br 23 Centro de Vigilância Sanitária Núcleo de Farmacovigilância www.cvs.saude.sp.gov.br 24 Atenção: os casos clínicos são fictícios devido a confidencialidade, conforme a Portaria CVS 05/2010 Centro de Vigilância Sanitária Núcleo de Farmacovigilância www.cvs.saude.sp.gov.br 25 Tentativa de suicídio SETOX Centro de Vigilância Sanitária Núcleo de Farmacovigilância www.cvs.saude.sp.gov.br 26 Centro de Vigilância Sanitária Núcleo de Farmacovigilância www.cvs.saude.sp.gov.br 27 Atenção: os casos clínicos são fictícios devido a confidencialidade, conforme a Portaria CVS 05/2010 Centro de Vigilância Sanitária Núcleo de Farmacovigilância www.cvs.saude.sp.gov.br 28 Atenção: os casos clínicos são fictícios devido a confidencialidade, conforme a Portaria CVS 05/2010 1. NOME DO MEDICAMENTO ACOMPLIA 20 mg comprimidos revestidos por película Distribuição: 5.2 Propriedades farmacocinéticas In vitro a ligação de rimonabanto às proteínas plasmáticas humanas é elevada (>99,9 %) e não saturável num intervalo largo de concentrações. O volume de distribuição periférico aparente do rimonabanto parece estar relacionado com o peso corporal, com os doentes obesos a demonstrarem um volume de distribuição maior do que os indivíduos com peso normal. http://www.ema.europa.eu/humandocs/PDFs/EPAR/acomplia/H-666-PI-pt.pdf Centro de Vigilância Sanitária Núcleo de Farmacovigilância www.cvs.saude.sp.gov.br 29 Paciente sexo masculino, 39 anos, com diagnóstico de aspergilose pulmonar, recebeu prescrição de itraconazol 400 mg diários. Após dois meses de tratamento faleceu com uma forma grave de aspergilose sistêmica. Ao longo de todo o tratamento tomou simultaneamente ranitidina 300 mg diários, conforme prescrição médica. Centro de Vigilância Sanitária Núcleo de Farmacovigilância www.cvs.saude.sp.gov.br 30 Centro de Vigilância Sanitária Núcleo de Farmacovigilância Atenção: os casos clínicos são fictícios devido a confidencialidade, conforme a Portaria CVS 05/2010 2009 www.cvs.saude.sp.gov.br 31 Centro de Vigilância Sanitária Núcleo de Farmacovigilância www.cvs.saude.sp.gov.br 32 Atenção: os casos clínicos são fictícios devido a confidencialidade, conforme a Portaria CVS 05/2010 Centro de Vigilância Sanitária Núcleo de Farmacovigilância www.cvs.saude.sp.gov.br 33 Secretaria de Estado da Saúde Centro de Vigilância Sanitária Núcleo de Farmacovigilância Av Dr. Arnaldo, 351 – anexo 03 – 5º andar CEP 01246-901 – Cerqueira César – São Paulo / SP Fone: (11) 3065 4739 Fax: (11) 3065 4744 E-mail: [email protected] www.cvs.saude.sp.gov.br Centro de Vigilância Sanitária Núcleo de Farmacovigilância www.cvs.saude.sp.gov.br
Baixar