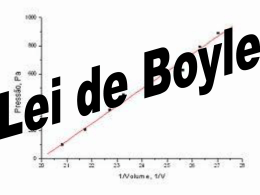
Estudo dos Gases Prof. Fabio Costa 1 SUMÁRIO 1. Características dos gases; 2. Gases Ideais – Definição; 3. Introdução à teoria cinética dos gases; 4. Leis dos gases ideais; 5. Mistura de gases (lei de Dalton); 6. Gases Reais – Definição; 7. Fator de Compressibilidade (Z); 8. Equações de Estado Van der waals. 2 Características dos Gases • Possuem forma e volume indefinidos; • Formam misturas homogêneas; • Possuem alta compressibilidade devido ao grande espaçamento entre suas moléculas; • Possuem baixa densidade. 3 Pressão Pressão é a força F agindo sobre uma área A. Os gases exercem pressão na superfície em que estão em contato. 4 Unidades de pressão Pascal (Pa) 1Nm-2 bar 105Pa atmosfera (atm) 101,325kPa = 1,01325bar torr (Torr) 760Torr = 1atm 1Torr = 133,32Pa milímetros de mercúrio (mmHg) 760mmHg = 1atm Pressão hidrostática de uma columa P P0 gh Gases Ideais (definição) 6 7 Teoria Cinética dos Gases 8 9 10 11 12 Leis dos Gases 13 Leis dos Gases O estado de um gás ideal pode ser definido pelas seguintes variáveis: pressão (P), volume (V), temperatura (T) e quantidade de matéria (n). =>A equação de estado de um gás ideal p= f(n,V,T) Lei de Boyle; Lei de Charles; Pricípio de Avogadro. 14 Lei de Boyle 15 A experiência de Boyle •Condições isotérmicas PV= constante, ou seja P V-1 P1V1 = P2V2 16 Lei de Boyle • Temperatura constante; • O volume de certa massa de gás perfeito é inversamente proporcional à pressão suportada. P . V = K (constante) 17 Lei de Charles 18 Experiencia de Charles e Gay Lussac •Condições isobáricas e isocóricas VT P1 P2 T1 T2 V1 V2 T1 T2 19 Lei de Charles • Pressão constante; • O volume é diretamente proporcional à temperatura absoluta do gás. V / T = K (constante) 20 Princípio de Avogadro 21 Experiencia de Charles e Gay Lussac •Condições isobáricas e isocóricas VT P1 P2 T1 T2 V1 V2 T1 T2 22 Lei de Avogadro • Pressão e Temperatura constantes; • O volume é proporcional ao número de moléculas. V / n = K (constante) 6,02 x 1023 moléculas = 22,4 L (CNTP) Equação dos Gases Ideais PV=nRT V – volume P – pressão n – quantidade (mols) R – constante T – temperatura (K) 24 Densidade dos Gases PV nRT PM m RT V m PV RT M PM d RT 25 Misturas de Gases e Pressões Parciais • A pressão total da mistura gasosa é a soma das pressões parciais que cada gás exerceria se estivesse sozinho (Lei de Dalton). Pt = P1 + P2 + ... + Pn 26 MISTURA GASOSA - PRESSÃO PARCIAL Gás ideal - não há interações entre as moléculas, assim irá se comportar como se estivesse ocupando todo o recipiente sozinho. LEI DE DALTON 1. Em uma mistura de gases ideais, cada gás exerce uma pressão relativa equivalente à fração molar deste em relação à pressão total da mistura. 2. A pressão total de uma mistura é a soma das pressões individuais de cada componente. ni Fraçãomolar: xi nt pressão parcial(Pi ) Pi x i Pt pressão total(Pt ) n Pt P1 P2 .... Pi i 1 Fração molar Pressão total 1.2 As Leis dos Gases (cont.) As pressões parciais pA e pB de uma mistura binária de gases (ideais ou reais) com pressão total p à medida que a composição muda de A puro para B puro. A soma das pressões parciais é igual à pressão total. Se os gases são ideais, então a pressão parcial é também a pressão que cada gás exerceria se estivesse presente sozinho no recipiente. Pressão total, p = pA + pB Pressão parcial de B: pB = xBp Pressão parcial de A: pA = xAp Fração molar de B, xB Exercícios 30 31 32 GASES REAIS (NÃO IDEAIS) 36 37 38 39 INTERAÇÃO ENTRE AS MOLÉCULAS atração repulsivas 40 41 42 43 44 45 46 47 FATOR DE COMPRESSIBILIDADE (Z) 48 49 reais 50 51 52 53 54 55 56 EXEMPLOS 57 58 59 60 61 62 EQUAÇÕES DE ESTADO PARA GASES REAIS 63 64 Bibliografia 1. ATKINS, P., DE PAULA, J. Físico-Química. 8a. ed. Livros Técnicos e Científicos, 2008. 2. WYLEN, G. J. V. Fundamentos da termodinâmica, 6a. ed. São Paulo: Edgard Blucher, 2003. 3. CALLEN, H. B. Thermodynamics and an introduction to thermostatistics. 2a. ed. New York: John Wiley, 1985. 65
Baixar