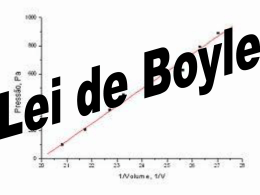
Termodinâmica Gases gases perfeitos Robert Boyle XVII 1 V T ,n ctes p Gay Lussac XVII V T p, n ctes pV nRT Avogadro XIX V n T ,p ctes pV nRT •A temperatura tem de vir expressa em kelvin !!!!!!!!!!!! Constante universal dos gases • R = 8.314 J / mol K = 8.314 J mol-1 K-1 • R = 0.08206 L atm mol-1 K-1 • R = 62.36 torr L mol-1 K-1 O volume ocupado por 1 mole de qualquer gás perfeito a T=273 K e à pressão atmosférica (1 atm) é 22.4 litros. Número de Avogadro O número de moléculas de um gás é dado por N=nNA, onde NA é o número de Avogadro (NA=6.023 1023) k=nR/N=1.38 10-23 J/K é a constante de Boltzmann Lei de Boyle 1 V T ,n ctes p Lei de Boyle 1 V T ,n ctes p Lei de Boyle-aplicação 1 V T ,n ctes p Gay Lussac V T p, n ctes Gay Lussac-aplicação V T p, n ctes O volume permanece quase constante, e aumentando a pressão, aumenta a temperatura Modelo do gás perfeito • As moléculas de um gás perfeito são consideradas pontuais • As interacções entre as moléculas do gás perfeito são desprezáveis Um gás perfeito é todo o gás que obedece à equação dos gases perfeitos A energia interna de um gás ideal é só função da temperatura. Gases reais; equação de Van der Waals • b=volume de uma mole de moléculas • V V-nb Gases reais; equação de Van der Waals • a=constante de proporcionalidade (Pam6 mol-2) 2 n p p a 2 V Equação de Van der Waals a ( p n 2 )(V nb ) nRT V 2
Baixar