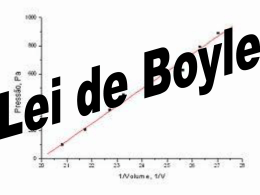
Universidade Estadual de Goiás UnUCET - Anápolis Química Industrial Físico-Química Experimental I A Lei de Boyle Alunos: Bruno Ramos; Wendel Tiago Mendes. Professor: Ademir João Camargo Anápolis, 2005. 1. Introdução Galileu iluminou a primeira parte do século XVII. Newton a última. Entretanto, o meio foi repleto de homens que fizeram deste século o princípio da Idade das Luzes. Nesse período, ocorreu a extensão da Dinâmica dos Sólidos de Galileu à Mecânica dos Fluidos. O assistente de Galileu, Evangelista Torricelli, adicionou movimento aos líquidos. Mais além, ele suspeitava que o ar tinha peso e que o líquido em um barômetro era suportado pela pressão exercida pela atmosfera, ao invés do horror vacui, de Aristóteles. Infelizmente, Torricelli morreu antes de poder estudar o fenômeno. Pouco antes de falecer, contudo, Torricelli escreveu suas idéias a um amigo em Roma. Tais idéias chegaram até Paris, às mãos do filho de um coletor de impostos, Blaise Pascal. Pascal demorou dois anos até começar uma série de experimentos com as idéias de Torricelli. Em 1648, ele deu direções a seu cunhado para que fizesse o experimento no Puy de Dome, uma montanha de 1200 metros, na França central. E assim nascia o barômetro. Isso foi um ano depois da morte de Torricelli. Em 1652, o imperador alemão Ferdinand III ouviu falar do trabalho de Otto von Guerick com vácuos, e exigiu uma demonstração. O que Guerick fez foi modificar um extintor de incêndio comumente utilizado. Então, para o Imperador, ele evacuou dois hemisférios de bronze unidos. Então, a esfera evacuada foi ligada a dois times de cavalos (um a cada hemisfério). Os times não conseguiram abrir a esfera. Entretanto, quando se abriu uma válvula em uma das metades, a esfera se abriu com facilidade. Ferdinand ficou tão impressionado que ordenou que o experimento fosse relatado por Caspar Schott, professor de matemática na Universidade de Wurtzberg. O texto foi publicado em 1657 e o trabalho de Guericke se tornou conhecido por estudiosos de toda Europa. 1.1) A Lei de Boyle Em 1657, estimulado pela leitura do experimento de vácuo efetuado por Guericke, Boyle começou a pensar em construir um instrumento que conseguisse produzir vácuo consideravelmente. Graças à colaboração de seu assistente, Robert Hooke, habilíssimo em sugerir soluções eficazes frente aos mais difíceis problemas experimentais, ele conseguiu – rapidamente – formular uma bomba pneumática, com a qual foi capaz de concluir importantes experiências, como descrito em New Experiments Physico-mechanical, Touching the Spring of the Air and its Effects (Novos experimentos físico-mecânico a respeito da elasticidade do ar e de seus efeitos), 1660. Os experimentos realizados com a bomba pneumática feita por Hooke permitiram a Boyle demonstrar que a suspensão da coluna de mercúrio no tubo barométrico, como descrita na experiência de Torricelli, era devido – sem dúvida – à pressão atmosférica; que o som era impossível no vácuo; que o ar era indispensável à vida e à combustão e – além disso – era caracterizado por uma permanente elasticidade. Após estudar apropriadamente essa característica do ar, e através de posteriores experimentos descritos na segunda edição de New Experiments (1662), Boyle pôde determinar a relação que existe entre o volume a pressão de um gás mantendo-se a temperatura constante, estabelecendo assim o importante princípio físico, conhecido pelo nome de Lei de Boyle. Essa lei estatiza que: O volume de uma amostra de gás é inversamente proporcional à sua pressão, se a temperatura se mantiver constante. Matematicamente: ; O que nos dá: (Eq. I) Onde C é a constante de proporcionalidade, que depende – implicitamente – dos valores de massa e temperatura. Analisando-se a taxa da variação infinitesimal da pressão com a variação infinitesimal do volume, obtém-se: ; Conhecendo-se a função p(v) (Eq. I), pode-se encontrar a taxa de variação acima: (Eq. II) A análise dessa taxa nos informa que a variação da pressão de um gás em relação ao volume por ele ocupado é negativa e não-linear. Os gráficos gerados a partir de resultados obtidos em um experimento comum sobre a Lei de Boyle podem ser representados plotando-se p versus 1/V, de forma que obteríamos um gráfico linear, ou utilizando simplesmente p versus V, situação na qual obteríamos um gráfico hiperbólico, como mostrado abaixo: Figura 1. Modelo de uma curva obtida a partir de um experimento comum sobre a Lei de Boyle 2. Objetivo Comprovar a relação entre pressão e volume de um gás expressa pela Lei de Boyle. 3. Metodologia Utilizou-se, nesse experimento, os seguintes materiais: - Uma seringa de vidro de 50 mL; - Uma bureta de 50 mL; - Uma mangueira de silicone, cujo volume aproximava 50 mL. Montou-se o aparato para o experimento conforme indica o esquema a seguir: Encheu-se a mangueira de silicone com uma quantidade aproximada de 50 mL de água de torneira comum. Em seguida, conectaram-se os extremos da mangueira na seringa e na saída da bureta. A torneira desta foi aberta, de modo a permitir o equilíbrio das pressões na mangueira. Após isso, colocou-se água pela extremidade superior da bureta até o menisco atingir a marca de aferição de 0 mL. Montado o aparato, deu-se seqüência às medições das variações do volume de água na bureta de acordo com o deslocamento do êmbolo na seringa. Os valores foram tomados para cálculos posteriores (que serão descritos na próxima sessão deste relatório). O experimento foi realizado a temperatura ambiente (25 ºC). 4. Resultados e discussão 4.1 Dados obtidos pela experimentação: Medição Variação da altura da coluna de água na bureta (m) Pressão correspondente (kPa)* Volume ocupado pelo gás (cm³)** h0 h1 h2 h3 h4 h5 h6 0,000 0,030 0,072 0,110 0,153 0,188 0,230 101,325 101,619 102.031 102,403 102,824 103,167 103,579 50,0 48,0 47,2 46,0 45,3 43,8 43 h7 h8 0,275 0,322 104,020 104,481 42,5 42,2 h9 0,373 104,980 42,3 h10 0,426 105,500 42,6 Tabela 1. Dados coletados durante o experimento. *. A pressão foi calculada da seguinte forma: P = pext + ρgh (Eq. III) Sabendo-se que a pressão externa é igual a 1,013 x 10-2 kPa, que a massa específica da água é 1000 kg/m³, e considerando g = 9,8 m/s²; pode-se escrever a eq. III como se segue: P = 101,325 + 9,8h A partir da eq. IV, foram efetuados os cálculos da pressão do gás. (Eq. IV) **. O volume ocupado pelo gás foi considerado como o volume de gás presente na seringa mais o presente na mangueira (obtido a partir da variação do volume de água na coluna da bureta). 4.2 Gráficos plotados: Pressão x Volume 105 Pressão (kPa) 104,5 104 103,5 103 102,5 102 101,5 101 40 42 44 46 48 50 52 Volume (cm³) Pressão x 1 / Volume 105 Pressão (kPa) 104,5 104 103,5 103 102,5 102 101,5 101 0,019 0,02 0,021 0,022 0,023 0,024 1/Volume (cm-³) 4.3 Discussão geral Os resultados obtidos parecem coincidir e confirmar com o que estatiza a Lei de Boyle. Entretanto, dois valores (indicados em negrito na Tabela 1) apresentaram uma pequena discordância, talvez devido a falhas na leitura, como a própria imprecisão da bureta utilizada; ou até mesmo a pequenos vazamentos, ou outras n fontes de erros possíveis num experimento como esse. 5. Conclusão Com base no experimento feito e nos resultados obtidos, pode-se concluir que foi possível comprovar a veracidade da Lei de Boyle. 6. Bibliografia IMSS. Horror Vacui? I protagonisti: Robert Boyle. Istituto e Museo di Storia della Scienza. Firenze: Italia. Disponível em: http://galileo.imss.firenze.it/vuoto/iboyle.html. Acessado em 01.03.05 HUNTER, M. The Life and Thought of Robert Boyle. Birkbeck College, University of London: London, UK. Disponível em: http://www.bbk.ac.uk/Boyle/biog.html. Acessado em 01.03.05 MARTIKEAN, C. Boyle's Law. Illinois Institute of Technology. Illinois, US. Disponível em: http://www.iit.edu/~smart/martcar/lesson3/lesson3.htm. Acessado em 01.03.05 Fig 1: "Experimental results from a typical Boyle's Law experiment" in DELPIERRE, G.R.; SEWELL, B.T. The Gas Laws: Boyle's Law. GRD Training Corporation: South Africa, 2002. Disponível em: <http://www.physchem.co.za/Kinetic/Graphics/GRD70002.gif>. Acessado em 04.03.05
Baixar