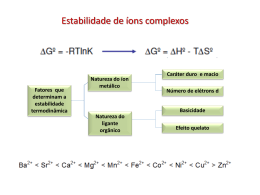
Propriedades magnéticas Esquema de uma balança de Gouy. Susceptômetro Squid Hemoglobina Os materiais cerâmicos refratários apresentam um caráter estratégico para o desenvolvimento do país, já que possibilitam o processamento em temperaturas elevadas (entre 800 e 1600°C) de metais essenciais para o setor aeroespacial, como aços e ligas de alumínio.O emprego de concretos refratários contendo espinélio (MgAl2O4) tem se expandido nas indústrias siderúrgicas, em decorrência do excelente desempenho que este material possui em relação à corrosão por escórias de panelas de siderurgia. espinélio Estrutura dos espinélios DRX dos cristais de β-Ag2MoO4. Concreto refratário contendo o espinélio MgAl2O4 Estabilidade de íons complexos Fatores que determinam a estabilidade termodinâmica Natureza do íon metálico Caráter duro e macio Número de elétrons d Basicidade Natureza do ligante orgânico Efeito quelato 1. Dependência do íon metálico: número de elétrons d Tendências na estabilidade de complexos metálicos Esta ordem surge em parte devido ao decréscimo no tamanho dentro da série e em parte devido a efeitos do campo ligante. 1. Dependência do íon metálico: número de elétrons d Tendências na estabilidade de complexos metálicos Esta ordem surge em parte devido ao decréscimo no tamanho dentro da série e em parte devido a efeitos do campo ligante. • Os valores de Δhhidrtação refletem a força da ligação M-L e a influência da EECC sobre a estabilidade dos complexos. • Quanto maior é a força da ligação M-OH2 , maior é a energia liberada (calor) na reação de hidratação (valor mais negativo) ÁCIDOS E BASES DUROS E MACIOS Tendências na estabilidade de complexos metálicos. Uma das primeiras correlações foi a série de estabilidade de IrvingWilliams. Ba2+ < Sr2+ < Ca2+ < Mg2+ < Mn2+ < Fe2+ < Co2+ < Ni2+ < Cu2+ > Zn2+ Uma segunda observação é que certos ligantes formam seus complexos mais estáveis com metais como Ag+, Hg2+ e Pt2+ e outros parecem preferir íons como Al3+, Ti4+ e Co3+. Estabilidade de íons complexos 2. Dependência do íon metálico e do ligante: caráter duro macio Pearson, 1963 6,48 Efeito quelato Efeito quelato: entropia x entalpia Dependência do tamanho do anel quelato Efeito quelato dependência do número de anéis Macrocíclicos Efeito macrocíclico Ácidos duros preferem complexar com bases duras e ácidos macios preferem complexar com bases macias, sob condições semelhantes de força ácido-base. Uso do EDTA 38 Ethylenediaminetetraacetic acid (EDTA) pK1 = 2,00 pK2 = 2,67 pK3 = 6,16 pK4 = 10,26 Arsênio hiperceratose • A ordem decrescente de toxicidade dos compostos de arsênio: arsina > arsenito > arseniato > ácidos alquil-arsênicos > compostos de arsônio > hiperpigmentação arsênio elementar. • O arsênio trivalente (arsenito) é 60 vezes mais tóxico do que a forma oxidada pentavalente (arseniato). • Os compostos inorgânicos são 100 vezes mais tóxicos do que as formas parcialmente metiladas (MMA e DMA). ulceração Hemocromatose Hereditária Ferro Tratamento Sangria Terapêutica 2. Dependência dos Ligantes Variação do potencial de redução em função do tipo de ligante
Baixar