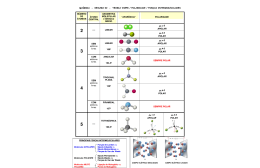
Propriedades físicas- químicas dos compostos orgânicos • Ligações polares e apolares: • Moléculas polares e apolares: ≠ 0 ⇒ molécula polar = 0⇒ molécula apolar • Polaridade e solubilidade: Soluto polar tende a dissolver bem em solvente polar. Soluto apolar tende a dissolver bem em solvente apolar. • Cadeia e solubilidade em água: O aumento da cadeia orgânica diminui a solubilidade, ou seja, quanto maior a parte apolar (carbono + hidrogênio) de um composto orgânico, menor é a tendência de uma substância dissolver em água. Grupos polares (– , − , − ), possuem afinidade pela água, assim, compostos que apresentam esses grupos apresentam maior solubilidade em água. Obs.: as vitaminas hidrossolúveis são polares e as vitaminas lipossolúveis (A, D, E, K) são apolares. • • • • Forças Intermoleculares Dipolo Induzido – Dipolo Induzido Dipolo Permanente – Dipolo Permanente Ligação de Hidrogênio Apolar Ligeiramente Polar Polar Muito Polar Hidrocarbonetos Aldeído, Cetona, Éteres Álcoois, Fenol Ácido Carboxílico Forçar intermoleculares e ponto de ebulição: quanto mais intensas forem às ligações intermoleculares mais alto será o ponto de ebulição, quando comparamos duas substâncias com massas moleculares próximas. Massa molecular e ponto de ebulição: quando duas substâncias apresentam a mesma interação intermolecular, aquela que tiver maior tamanho (massa molecular) terá maior ponto de ebulição. Cadeia carbônica e ponto de ebulição quando duas substâncias apresentam a mesma massa molecular e o mesmo tipo de força intermolecular, aquela que tiver maior comprimento da cadeia principal, terá o ponto de ebulição maior. Bibliografia Peruzzo, Miragaia Francismo; Canto, Eduardo Leite do. Química na abordagem do cotidiano 3 (Química Orgânica). 4ª Edição. São Paulo. Editora Moderna, 2006. www.soexatas.com Página 1
Baixar