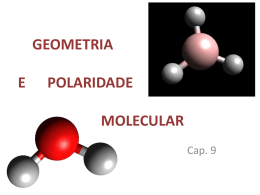
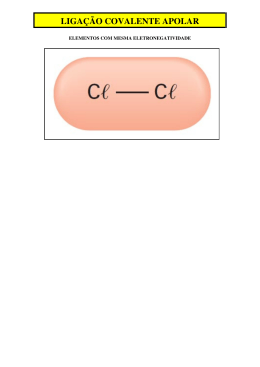
QUÍMICA - RESUMO 02 - TEORIA VSEPR / POLARIDADE / FORÇAS INTERMOLECULARES NÚMERO DE ÁTOMOS ÁTOMO CENTRAL 2 ---- GEOMETRIA MOLECULAR e ÂNGULO MÉDIO “APARÊNCIA” POLARIDADE µR = 0 APOLAR LINEAR µR ≠ 0 POLAR µR = 0 3 4 SEM elétrons livres LINEAR APOLAR 180º µR ≠ 0 POLAR COM elétrons livres ANGULAR SEM elétrons livres SEMPRE POLAR 104,5º µR = 0 APOLAR TRIGONAL PLANA 120º µR ≠ 0 POLAR COM elétrons livres PIRAMIDAL 107º SEMPRE POLAR µR = 0 APOLAR 5 µR ≠ 0 POLAR TETRAÉDRICA ---109,5º PRINCIPAIS FORÇAS INTERMOLECULARES Moléculas APOLARES Forças de London ou Dipolo Induzido ou Dipolo Momentâneo ou Forças de Van der Waals Moléculas POLARES Dipolo Permanente ou Dipolo-Dipolo ou Forças de Van der Waals Moléculas MUITO POLARES Ligação de Hidrogênio ou Ponte de Hidrogênio CAMPO ELÉTRICO DESLIGADO CAMPO ELÉTRICO LIGADO
Baixar