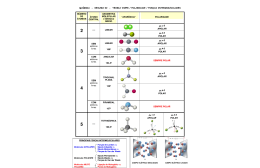
Valores eternos. TD Recuperação ALUNO(A) MATÉRIA ANO SEMESTRE Química I 2º 1º DATA Julho/2013 PROFESSOR(A) TOTAL DE ESCORES ESCORES OBTIDOS Helder ---- ---- 1. Na escala de eletronegatividade, tem-se: Li H 1,0 2,1 Br 2,8 N 3,0 O 3,5 Esses dados permitem afirmar que entre as moléculas a seguir, a mais polar é: a) b) c) d) e) O2 (g) LiBr (g) NO (g) HBr (g) Li2 (g) 2. NH3, H2O e CH4 são, respectivamente, moléculas: a) b) c) d) e) polar, polar, apolar polar, polar, polar apolar, apolar, polar polar, apolar, apolar apolar, apolar, apolar 3. Identifique as misturas escrevendo os termos homogênea ou heterogênea ao lado de cada uma. a) b) c) d) e) f) g) h) Água e álcool ______________________________________________________ Água, gasolina e álcool_______________________________________________ CCl4 , CH3CH2OH e água _____________________________________________ Vela e gasolina _____________________________________________________ Gasolina e óleo diesel________________________________________________ Óleo comestível e etanol com água ____________________________________ Sal (NaCl) e querosene_______________________________________________ CCl4 , óleo e gasolina ________________________________________________ 4. A cromatografia em coluna é um processo de separação baseado na interação intermolecular de substâncias com as fases estacionária e móvel. Considere um experimento em que o fator determinante é a interação entre a fase estacionária (sílica gel) e as substâncias fenol e naftaleno, representadas a seguir: Determine a sequência em que os compostos sairão da coluna cromatográfica e justifique sua resposta. Si O H Si O O Si H OH H O O Si O O Si fenol naftaleno spilica gel 5. São dados dois composto a seguir. Mostre as pontes intra e intermoleculares que ocorrem, determinando qual dos dois possui maior ponto de ebulição. I. H 2N II . H H O NH2 O 6. Suponha um litro de cada substância dada a seguir. Determine em cada par a substância de maior ponto de ebulição. Justifique sua resposta. OH CH3 e I. II. e O NH III. e IV. I F 7. Em linguagem química, a expressão “semelhante dissolve semelhante” refere-se ao fato de que: a) b) c) d) e) gases só podem ser dissolvidos por outros gases. solventes polares dissolvem solutos não polares e vice-versa. solventes polares dissolvem apenas solutos de transparência semelhante. solventes polares dissolvem solutos polares e solventes não polares dissolvem solutos não polares. solventes polares e não polares dissolvem apenas solutos cujas massas molares sejam semelhantes às suas. 8. Ponha os compostos em ordem crescente de seus pontos de ebulição: II. I. III. NH2 OH V IV. O OH VI. O 9. Quais as forças intermoleculares (ponte de hidrogênio, dipolos permanente e dipolos induzidos) presentes nos compostos? O NH O Cl O d) c) a) b) NH2 CH3 O O O e) O g) f) CH3F O H C OH N H H O NH2 i) h) C OH O 10. O controle de dopagem no esporte envolve a análise de várias substâncias. Entre as substâncias de uso proibido para os atletas está o zeranol, um esteroide cuja fórmula pode ser representada por: O Essa substância pode ser usada apenas para o crescimento do gado de corte; há pesquisas que investigam se, nos seres humanos, a ação do zeranol induz o aparecimento de câncer. Na fórmula do zeranol quais funções orgânicas estão presentes? HO O OH HO O 11. Analisando a reação a seguir, marque “V” para verdadeiro e “F” para falso: C H 2SO 4 ( ) os reagentes 1 e 2 são um ácido carboxílico e um álcool, H 3C OH + HO-CH2-CH 3 etanol respectivamente, que reagem entre si formando um éter, cuja 1 2 nomenclatura é etanoato de etila. O ( ) os reagentes 1 e 2 são um ácido carboxílico e um álcool, C respectivamente, que reagem entre si formando um éster, cuja H2SO4 H3C O-CH2-CH3 + H 2O nomenclatura é etanoato de etila. etanol 3 4 ( ) os reagentes 1 e 2 são dois ácidos carboxílicos porque apresentam grupos OH. ( ) os reagentes 1 e 2 são dois alcoóis porque apresentam grupos OH. ( ) os reagentes 1 e 2 são um ácido carboxílico e um álcool, respectivamente, que reagem entre si formando éster e água. 12. Considere as seguintes reações que podem ocorrer com o ácido fólico, C6H4(COOH)2, dependendo das condições experimentais e dos reagentes com o qual esta substância é misturada: I O O C OH OH O OH OH C O O C C OH + Zn OH OO- C C O 2- IV C O O C OH + Ca(OH)2 OH Zn2+ + H2 O C C C O c) III. d) IV. OH OC2H5 + H2O + C2H5OH O Dentre essas reações, produzem sais de ácidos carboxílicos SOMENTE: a) I. b) II. C C O O O C O + H2O aquecimento C II III C O OOO 2- Ca2+ + 2H2O 13. No ano de 2011 comemora-se o Ano Internacional da Química. A celebração, coordenada pela UNESCO/IUPAC, ressalta os inúmeros benefícios da química para a humanidade, e tem o mote Química para um Mundo Melhor. Seu objetivo principal é a educação, em todos os níveis, e uma reflexão sobre o papel da química na criação de um mundo sustentável. Uma das participações mais importantes da química no bemestar social consiste no desenvolvimento de fármacos e medicamentos que evitam e curam doenças, como, por exemplo, o perindopril, empregado no controle da hipertensão arterial. O O NH Na molécula do perindopril estão presentes os grupos funcionais: ( ( ( ( ( ( ( ) ) ) ) ) ) ) amida álcool cetona éster ácido carboxílico amina, éter. N H perindopril C N 15. A aspoxicilina, ao lado representada, é uma substância utilizada no tratamento de infecções bacterianas. Coloque nos parênteses os números correspondentes as funções 1, 2, 3 e 4 circuladas na estrutura, ) ) ) ) O OH 14. Dê o nome do composto a seguir: ( ( ( ( O H Amida Amina Ácido carboxílico éster ( ( ( ( ) fenol ) aldeído ) álcool ) nitrila 16. Sejam as reações abaixo: O OH HO OH HN O CH3 CH3 a) Determine a fórmula estrutural dos produtos das reações b) Qual a nomenclatura dos produtos nas duas reações 17. Seja a reação abaixo: OH LiOH O a) Proponha a fórmula estrutural dos produtos. b) Determine a função a que pertence o produto orgânico c) Qual a nomenclatura do produto formado 18. Dada a cadeia carbônica, verifica-se que a soma dos valores das posições das ramificações na cadeia é: a) 4 b) 6 c) 8 d) 10 e) 12 . 19. Qual a nomenclatura IUPAC dos hidrocarbonetos a seguir? a) b) 20. Assinale a alternativa que apresenta exemplos de moléculas que formam interações do tipo ponte de hidrogênio intermolecular. a) b) c) d) H2O2, CH3OH, NH3 H2O, CH4, CH3-O-CH3 H2O, HF, CH3CHO CHF3, H2O2, HF 21. A classificação da cadeia carbônica ao lado é: a) b) c) d) Aberta, alicíclica, homogênea,insaturada. Acíclica, ramificada, insaturada, heterogênea. Acíclica, ramificada, saturada, homogênea. Aberta, normal, saturada. heterogênea . OH N N 22. No composto ao lado temos: a) b) c) d) O 2 carbonos terciários e três primários. 2 heteroátomos e 1 carbono quaternário. 7 carbonos terciários e 3 átomos primários. Dois anéis aromáticos e 16 hidrogênios O HO 23. Sejam os compostos abaixo: b) a) Analise as afirmações e ponha ”V” para verdadeiro e “F” para falso : ( ( ( ( ( ( ) no composto a ) no composto b ) no composto a ) no composto a ) no composto b ) no composto b a cadeia principal tem 12 carbonos a antena posta na “cabeça” do boneco é o radical isopropil a ramificação no carbono 3 é o metiil a ramificação no carbono 4 é o isobutil as mãos são representadas pelo tercbutil a cabeça é constituída do anel ciclopentano 24. Quantos átomos de hidrogênio há na molécula do cicloocteno? 25. Classifique cada carbono da estrutura em primário, secundário, terciário e quaternário. 9 1 2 NHCH3 6 HO CH2CH2CHCH CCH 3 5 3 4 OCH CH3 7 2 8 26. Proponha a nomenclatura dos alcanos abaixo, a) b)
Baixar