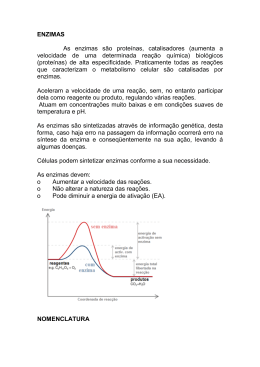
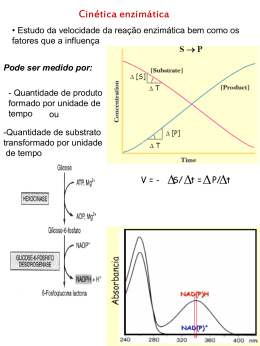
Enzimas: Cinética, inibição e regulação CONDIÇÕES FUNDAMENTAIS DA VIDA: 1.Autorreplicação; 2.Catálise de reações químicas com eficiência e seletividade Enzimas • Moléculas catalisadoras que aumentam a velocidade das reações, sem sofrerem alterações no processo global; • Na faixa de 5 a 17 ordens de magnitude. Praticamente todas as reações que caracterizam o metabolismo celular são catalisadas por enzimas. Enzimas RESÍDUOS DE AAS COM GRUPOS DE CADEIAS LATERAIS QUE SE LIGA AO SUBSTRATO CATALISA A TRANSFORMAÇÃO BIOQUÍMICA http://www.youtube.com/watch?v=s4jEZ9Os6QM Enzimas Estado de transição •OS CATALISADORES AUMENTAM A VELOCIDADE DAS REAÇÕES POR DIMINUÍREM AS ENERGIAS DE ATIVAÇÃO (interação covalente e fracas entre enzima e substrato); •NA EVOLUÇÃO, AS ENZIMAS DESENVOLVERAM-SE PARA DIMINUIR SELETIVAMENTE AS ENERGIAS DE ATIVAÇÃO DAS REAÇÕES NECESSÁRIAS PARA A SOBREVIVÊNCIA CELULAR Enzimas Ribozima Molécula de RNA com atividade catalítica Nomenclatura SUFIXO ASE UREASE_ CATÁLISE DA UREIA DNA POLIMERASE_ POLIMERIZAÇÃO DNA PEPSINA_ DO GREGO PEPIS (DIGESTÃO) ACORDO INTERNACIONAL EM BIOQUÍMICA Classificação das Enzimas Classificação das Enzimas Isozimas Isozimas - enzimas que catalisam a mesma reação mas apresentam estruturas diferentes (primária e/ou quaternária). Podem ser : - constituem diferentes enzimas produzidas por diferentes genes; Desidrogenase lática PROPRIEDADES DAS ENZIMAS • SÍTIO ATIVO 1.Cadeias laterais de AAs (fenda ou bolso_3D) 2.Eficiência catalítica 3.Especificidade •Sítio de ligação do substrato; •Sítio catalítico. PROPRIEDADES DAS ENZIMAS COFATOR • Um ou mais íons inorgânicos ou molécula orgânica ou metalorgânica complexa (coenzima). PROPRIEDADES DAS ENZIMAS Cofator (inorgânico) Algumas enzimas requerem a presença de íons metálicos para que a reação catalítica ocorra (Mg, Zn, Fe, Ca, Cu, Mn). Anidrase carbônica é uma enzima que tem um papel importante no transporte do CO2 e no controle do pH do sangue. Zinco Coenzima_ carreadores transitórios de grupos funcionais específicos. A maioria deles é derivada das vitaminas (deve estar na dieta em pequenas quantidades). Coenzima Grupo prostético (coenzima) As enzimas quando ligadas covalentemente ou nãocovalentemente às coenzimas, são chamadas de holoenzimas Apoenzima Holoenzima PROPRIEDADES DAS ENZIMAS Regulação Localização específica Modelos enzimáticos Especificidade enzimática 1. Chave-fechadura Não é o ideal, estabiliza o substrato. Modelos enzimáticos • Especificidade enzimática 2. Encaixe induzido Interações ótimas só ocorrem no estado de transição. FATORES QUE AFETAM A VELOCIDADE DA REAÇÃO CONCENTRAÇÃO DO SUBSTRATO Unidade de enzima (U) - quantidade de enzima que catalisa a transformação de 1 µmol de substrato por min [ES] SÍTIOS DE LIGAÇÃO OCUPADOS FATORES QUE AFETAM A VELOCIDADE DA REAÇÃO Temperatura e estabilidade molecular A temperatura ótima para a maioria das enzimas humanas está entre 35 e 40ºC. Acima de 40ºC, as enzimas desnaturam. Bactérias termófilas apresentam temperaturas ótimas acima de 70ºC. FATORES QUE AFETAM A VELOCIDADE DA REAÇÃO Efeito do pH Cadeias laterais ionizáveis ou não ionizáveis Atividade enzimática É obtida pela determinação da velocidade da reação catalisada pela enzima sob condições definidas. Cinética enzimática Equação de Michaelis-Menten reversível É baseado nos seguintes pressupostos: • E, S e ES estão em equilíbrio; •a conversão de ES em E + P é uma etapa irreversível e limitante da velocidade. •Velocidade inicial é calculada quando a enzima é misturada ao substrato, sendo nesse momento o produto muito pequeno. Km= K2 + K3/K1 A velocidade da reação é diretamente proporcional à concentração da enzima Constante de Michaelis-Menten (Km) Afinidade da enzima e do seu substrato específico Qual correlação entre Km e Vmáx? Km=Vmáx/2 Km=[S] Experimentalmente (grandes qtdes de substrato) Cinética enzimática Gráfico de Lineweaver-Burk A inversão de Vo e [S] possibilta a determinação de Vmax e Km Inibição enzimática Inibidores enzimáticos são substâncias que interferem na atividade das enzimas, bloqueando o processo catalítico. Inibidores irreversíveis Inibidores reversíveis Inibidores fisiológicos Fármacos Substâncias tóxicas Inibição enzimática Inibidores Irrevesíveis Gases tóxicos derivados de Ácidos fluor-fosfórico (HPO2F2, H2PO3F) organofosforados carbamatos Sítio ativo da colinesterase Inibidores Irrevesíveis Inibição enzimática Inibidores reversíveis Inibição Competitiva E + S + I ⇄ ES + EI 1. Os inibidores competitivos são geralmente substâncias análogas à do substrato; 2. A enzima pode complexar ou o substrato ou o inibidor mas não ambos simultaneamente; 3. Ocorre aumento do Km (Km aparente), sem modificação da Vmáx; 4. A ação dos inibidores competitivos é abolida a concentrações elevadas do substrato. 5.Reversão (aumento do substrato). Síntese bacteriana tetraidrofolato Síntese das bases de ácidos nucléicos Inibe DNA polimerase Inibição enzimática Inibição Não-competitiva E + S + I ⇄ ES + EI + EIS 1. O inibidor se liga à enzima num local diferente do sítio ativo; 2. A enzima pode combinar-se simultaneamente com o substrato e o inibidor; 3. Ocorre diminuição aparente do Vmáx (menos enzimas); 4. O inibidor afeta a configuração mais apropriada à catálise. Ex: metais pesados SH proteínas Regulação enzimática Controle alostérico Regulação enzimática Modificação covalente A atividade de muitas enzimas é regulada por modificações de natureza covalente que se conjugam com as interações alostéricas (não covalentes) e as ampliam. A modificação covalente pode ser ocorrer pela adição de diferentes radicais, pelos processos denominados fosforilação, glicosilação, galactosilação, metilação, entre outros. quinase e fosfatase
Download

















![Bruno Albuquerque da Silva [Modo de Compatibilidade]](http://s1.livrozilla.com/store/data/000260332_1-fa0796033fc627370db0cc3b94225b99-260x520.png)
