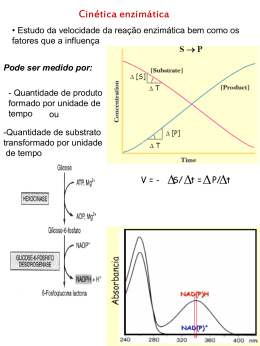
Universidade Federal do Rio de Janeiro Bioquímica Enzimas 2º período - Enfermagem Éverton Dias D’Andréa 1 Setembro 2011 Nutes: Núcleo de Tecnologia Educacional para a Saúde é um órgão suplementar do Centro de Ciências da Saúde da UFRJ que articula ações de formação de recursos humanos, pesquisa e desenvolvimento na área da Educação em Ciências e Saúde. Bioquímica Enfermagem Introdução a Enzimologia Introdução A manutenção da vida depende: • da auto-replicação dos organismos vivos; • da realização de reações químicas, sendo que estas reações químicas devem atender duas exigências fundamentais: - precisam ser altamente específicas de modo a gerar produtos definidos - devem ocorrer a velocidades adequadas à fisiologia da célula A insuficiência na produção ou na remoção de metabólitos pode levar a condições patológicas. alto grau de especificidade por seu substrato aceleram reações químicas ENZIMAS funcionam em soluções aquosas a maioria funcionam em pH e temperatura fisiológicas • As enzimas aceleram a velocidade de uma reação química sem serem consumidas no processo. • Como suas concentrações permanecem constantes eles são eficientes em pequenas quantidades. Enzima Substrato Produto Enzima + + Energia de ativação sem enzima Diferença entre a energia livre de S e P S Energia de ativação com enzima P Caminho da Reação • Enzimas são catalisadores que aumentam a velocidade da reação de 5 à 17 ordens de grandeza. Anidrase carbônica Estrutura das enzimas • Todas as enzimas são proteínas, como tal sua função depende da sua estrutura. • A estrutura da enzima dependerá da sequência primária; secundária; terciária e quartenária. Estrutura Primária Formada pela sequência de aminoácidos unidos pela ligação peptídica. Estrutura Secundária Se refere a arranjos particularmente estáveis entre os aminoácidos, gerando estruturas regulares recorrentes. Estrutura Terciária Descreve todos os aspectos do enovelamento tridimensional de uma proteína. Estrutura Quartenária Ocorre quando uma proteína possui duas ou mais subunidades polipeptídicas. Muitas enzimas são proteínas (podem variar de 12.000 a 1 milhão de Da): algumas requerem um co-fator (íons inorgânicos ou uma co-enzima); grupo prostético: coenzima ou covalentemente à proteína enzimática; íon metálico ligado muito forte ou holoenzima: enzima cataliticamente ativa completa, juntamente com sua coenzima e/ou íon metálico ligado; apoenzima ou apoproteína – parte protéica de uma enzima sem quaisquer cofatores ou grupos prostéticos; sítio ativo – região que forma a maquinaria para a reação química de catálise, é constituída por grupo de aminoácidos. Classes de enzimas • Especificidade da enzima pelo substrato Sítio catalítico – microambiente específico • 40% forma similar; • enovelação: folhas beta pregueadas anti-paralelas + α-helice pequenas. Hidrólise enzimática aminoaa teminal aa aa aa aa aa elastase tripsina aa apolares: Gly, Ala,Val aa positivos: Arg, Lys quimiotripsina aa aromáticos: Phe, Tyr, Trp carboxiteminal Modelos para explicar a formação do complexo Enzima-Substrato Modelo chave e fechadura – o sítio catalítico é rígido e complementar à forma e ao tamanho do substrato. Modelo encaixe induzido – o sítio catalítico não está totalmente pré-formado, a enzima se ajustaria ao substrato. Catálise Ácido-Base – que ocorre com a participação de aminoácidos com cadeias laterais ionizáveis, capazes de doar ou liberar prótons durante a catálise para estabilizar os intermediários (H+, OH-). Catálise Covalente – resulta do ataque nucleofílico ou eletrofílico de um radical do sítio catalítico sobre o substrato, ligando-o covalentemente à enzima e induzindo a sua transformação em produto. Mecanismo da quimiotripsina Catálise por íons metálicos – metais firmemente ligados ao sítio catalítico interage entre a enzima e o substrato estabilizando o estado de transição. Co-fator – molécula inorgânica pequena que uma apoenzima requer para a sua atividade. Coenzimas – funcionam como aceptores de átomos ou de grupos funcionais. Durante a reação a coenzima e o substrato são alojados no sítio catalítico da enzima. O fato de as coenzimas estarem se renovando constantemente permite que sua concentração celular seja menor do que as concentrações do substrato. Classificação das enzimas As enzimas são classificadas de acordo com o tipo de reação que catalisam. • Oxido-redutases – enzimas que catalisam reações de óxido-redução, transferência de elétrons. lactato desidrogenase lactato piruvato • Transferases – catalisam a transferência de um grupamento de uma molécula a outra. alanina aminotransferase alanina α-cetoglutarato piruvato L-glutamato • Hidrolases – catalisam a reação de hidrólise de uma única ou várias ligações covalentes por introdução de uma molécula de água. peptidase • Liases – catalisam reações de dupla ligação adicionando ou removendo grupamentos. piruvato carboxilase piruvato acetaldeído • Isomerases – catalisam reações transferindo grupos dentro da mesma molécula formando isômeros. Fosfoglicose isomerase • Ligases – catalisam reações formando ligações do tipo C-C, C-S, C-O e C-N acopladas à quebra de ATP. acetil CoA carboxilase Acetil-CoA Reações enzimáticas com mais de um substrato Sequencial (formação do complexo ternário) Creatina cinase Lactato desidrogenase Pingue-pongue ou duplo deslocamento Aspartato aminotransferase Fatores que afetam a velocidade enzimática Temperatura pH Cada enzima tem seu pH ótimo [produto] Influência da concentração de enzima e substrato 5[S] 4[S] 3[S] 2[S] [S] Velocidade da reação tempo [E] Introdução à Cinética Enzimática • Estudo da velocidade da reação Pode ser medido por: - Quantidade de produto formado ou - Quantidade de substrato transformado (sempre na unidade de tempo) Velocidade da reação [produto] Atividade enzimática pode ser medida pela velocidade da reação catalisada tempo [S] Cinética enzimática Representação de uma reação enzimática em 2 etapas E + S k1 k-1 ES k2 P Após curto tempo - estabilidade dinâmica com relação a [E] e [ES] é alcançado Para uma determinada [S] inicial, haverá um intervalo de tempo em que a velocidade da reação será relativamente constante, chamada de Vinicial, V0 ou simplesmente V da reação Vo = K2 [ES] [Et]=[E] + [ES] V de Formação de ES = K1 [E] [S] V de degradação de ES = K –1[ES] + K2 [ES] Já que Formação de [ES] = Degradação de [ES] K1 ([Et]-[ES]) [S] = K –1[ES] + K2 [ES] K1[S][Et] - K1[S][ES] = (K –1+ K2) [ES] [ES] = [Et] [S] [S] + (K –1+ K2) / k1) Km [ES] = [Et] [S] Km Se, V0 = k2 [ES] + [S] Então: V0 = k2 [Et] [S] Km +[S] Em V máxima [Et] = [ES] Então V max = k2 [Et] Sendo assim Vo = Vmax [S] Km +[S] Equação de Michaelis-Menten Uma propriedade importante: Quando V = Vm 2 Km = 2 . [S] - [S] Vm = 2 Vm . [S] Km +[S] = 2 . [S] Km +[S] Km= [S] Propriedades importantes de Km: • É numericamente igual a [S] na qual a velocidade da reação é metade da Vmax. • Característico de cada enzima. • Reflete a afinidade da enzima pelo seu substrato. Km = [S] Gráfico Linewevear-Burk 1 v Km Vmax [S] 1 Vmax 1 v 1 Vmax -1 Km 1 [S] Consequências importantes de Km Km Km Afinidade da enzima pelo substrato Afinidade da enzima pelo substrato v 1/V Vmáx V/2 Km Km [S] -1/Km -1/Km 1/s Inibição enzimática Inibidores de enzimas são moléculas que interferem com a catálise diminuindo ou interrompendo as reações enzimáticas. Quanto ao tipo de inibição: • inibição inespecífica: diminuição da atividade de todas as enzimas por temperatura, pH ou agentes desnaturantes (ex. uréia). • inibição específica: agente inibidor diminui a atividade de uma enzima específica ou de um grupo restrito de enzimas. A inibição pode ser irreversível ou reversível. Inibidor Competitivo Inibidor análogo não metabolizável do substrato compete com o mesmo pelo sítio catalítico da enzima livre. Km é modificado, mas Vmáx não é alterada. É necessário de [S] maior para deslocar o inibidor. Intoxicação por metanol metanol metanol metanol Álcool desidrogenase formaldeído formaldeído formaldeído cegueira Álcool etanol etanol desidrogenase etanol metanol etanol metanol etanol etanol etanol acetaldeído acetaldeído acetaldeído acetaldeído 1- sem inibidor 2- com inibidor [ I ] 3- com inibidor 2[ I ] Inibidor Não-Competitivo Inibidor se liga numa região deferente do sítio catalítico da enzima. Vmáx diminui, mas o Km não é alterado. [S] maior não diminui a inibição. 1- sem inibidor 2- com inibidor [ I ] 3- com inibidor 2[ I ] Inibidor Incompetitivo O inibidor se liga somente no complexo ES em sítio próprio. Inibidor não possui semelhança estrutural com o substrato. Km e Vmáx da enzima diminuem. 1- sem inibidor 2- com inibidor [ I ] 3- com inibidor 2[ I ] Exemplos de inibidores farmacológico • 3'-azido-2',3'-didesoxitimidina (AZT) • nevirapina • sulfonamidas Inibidores Competitivos de proteases do vírus HIV Gag e Gag Pol são clivados pela protease do vírus HIV em 9 pontos específicos para produzir proteínas funcionais. O precursor Gag vai originar proteínas estruturais e o precursor Pol vai originar enzimas como transcriptase reversa, integrase e proteases. Amprenavir Inibidor Irreversível O inibidor se liga covalentemente a um grupo funcional da enzima formando um complexo estável. Ácido acetil salicílico Sítio Ativo da Ciclooxigenase •Inibidor irreversível Ligação covalente Ácido acetil salicílico •Inibidor competitivo e reversível Interações sem ligação covalente Ácido mefenâmico Regulação da atividade enzimática das enzimas alostéricas Funcionam através da ligação não-covalente e reversível de um metabólito regulador (modulador) São maiores e mais complexas, possuem duas ou mais cadeias polipeptídicas. Não obedecem a cinética de Michaelis-Menten. Tipos de enzimas alostéricas: homotrópica (modulador é idêntico ao substrato); heterotrópica (modulador é diferente do substrato) Um modulador alostérico pode ser tanto um inibidor quanto um ativador. Aspartato Transcarbamilase (ATCase) – síntese de pirimidinas Fosfofrutokinase 1 (PFK-1) Regulação da atividade enzimática modificação covalente reversível Fosforilação – Regula inúmeros processos metabólicos ativando enzimas chaves das vias metabólicas. por Feedback negativo Coordena o fluxo de enzimas por uma via metabólica. A B C D E Ativação proteolítica Aplicações das enzimas Setor industrial – permitem usarem processos mais econômicos, diminuindo consumo de energia e recursos, mais confiáveis que poluem menos. Saúde – são usadas para detectar algum tipo de doença, ou dano tecidual, ou como marcador de exames. Algumas doenças são causadas pela falta de enzimas (ex. fenilcetonúria; intolerância a lactose). Infarto do miocárdio
Download