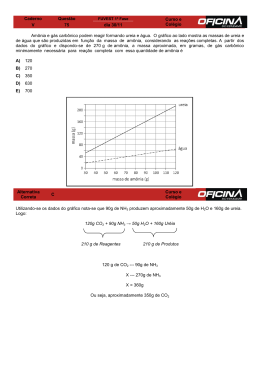
Trabalho de RB de Química – 1ª série – E.M 4º Bimestre Data de entrega: 02/12/2014 1) Classifique as soluções abaixo em eletrolíticas ou não eletrolíticas: 1) O2 (gás oxigênio) 2) Mg(OH)2 (hidróxido de magnésio) 3) HNO3 (ácido nítrico) 9) A força de um ácido é medida pelo(a): a) poder de corrosão de metais. b) conteúdo de oxigênio. c) velocidade de ionização. d) grau de ionização. e) poder de volatilidade. 4) CaSO4 (sulfato de cálcio) 10) Explique o significado das seguintes transformações: 5) C12H22O11 (açúcar) a) isotérmica (lei de Boyle). b) isobárica (lei de Charles). c) isovolumétrica (lei de Gay-Lussac). 22 2) Ao se dissolver 6 . 10 moléculas de ácido acético em 21 água, percebe-se que somente 9 . 10 moléculas se ionizam. a) Qual o grau de ionização do ácido nessas condições? b) O ácido é forte ou fraco? Justifique a sua resposta. 3) Ordene os seguintes ácidos oxigenados, do mais fraco para o mais forte: HClO, H3PO4, HClO4 e HNO3. 4) Uma certa massa de gás, ocupando o volume de 20 L à pressão de 4,0 atm, sofre uma transformação isotérmica (temperatura constante) e no estado final, a pressão é igual 10 atm. Determine o volume final da massa gasosa. 5) Uma massa de oxigênio gasoso encontra-se a 200 K e 3,0 atm. Se essa amostra sofrer uma transformação isovolumétrica até chegar a 300 K, qual será sua pressão final? 6) A experiência a seguir é largamente utilizada para diferenciar soluções eletrolíticas de soluções não eletrolíticas. O teste está baseado na condutividade elétrica e tem como consequência o acendimento da lâmpada. A lâmpada acenderá quando no recipiente estiver presente a seguinte solução: a) O2 b) H2O c) HCl d) C6H12O6 e) N.d.a 7) O gás hidrogênio (H2) reage com o gás nitrogênio (N2) a uma temperatura elevada para formar o gás amônia (NH3). A partir da equação que representa a reação citada, determine: 3 H2 + 1 N2 → 2 NH3 a) o número de mols de amônia (NH3) produzido a partir de 15 mols de H2. b) a massa, em gramas, de hidrogênio (H2) necessária para produzir 68 gramas do gás amônia (NH3) Dado: massas molares (g/mol): H = 1 e N = 14. 8) Determine a quantidade de mols de NH3 necessária para ocupar um volume de 60 litros sob a pressão de 0,82 atm e na temperatura de 27°C. Dado: R = 0,082 atm.L/mol.K
Baixar