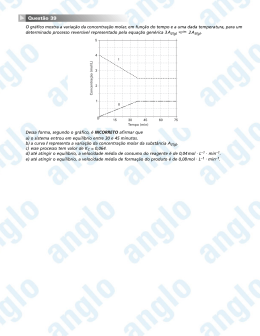
Propriedades Coligativas Profa. Kátia Aquino O que são? São as propriedades de uma solução que são influenciadas pela quantidade de soluto. Tal influência não depende da natureza do soluto. Vamos recapitular... Mudanças de estado físico As mudanças de estado físico dependem de: Temperatura e Pressão Fonte: http://jovensemambiente.blogspot.com/ Diagrama de fases O ponto P é um ponto comum às três curvas e é denominado ponto triplo ou ponto tríplice, neste ponto as três fases – sólido, líquido e gasoso, estão em equilíbrio. O ponto triplo da água, por exemplo, ocorre quando a mesma está à temperatura 0,01°C sob pressão de 0,006 atm (4,58 mmHg). Fonte: http://www.brasilescola.com/fisica/diagrama-fases.htm Hidrogênio metálico Consequência de temperatura e pressão extremas Ponto tríplo do Hidrogênio: 0,072 atm e -258,7 °C Isto ocorre por que a grandes profundidades dentro de Júpiter, a pressão é tão formidável (3,95 milhões atm) que os átomos de hidrogênio são rompidos e os elétrons ficam em liberdade. Deste modo, nesta região interna onde existem grandes temperaturas (67.727°C) e pressões, os átomos resultantes consistem de prótons. Isto produz um estado no qual o hidrogênio se torna metálico. Dizemos, portanto, que o hidrogênio metálico líquido consiste de prótons e elétrons ionizados, tal como ocorre no interior do Sol (15.699.727°C) só que a uma pressão muito mais baixa. Fonte: Observatório Nacional Água sólida por influência de altas pressões Planeta extrasolar Glieser 436b Este planeta foi descoberto em agosto de 2004 por Paul Butler e Geoffrey Marcy e é conhecido como o planeta de “gelo quente”. É um planeta semelhante ao Netuno, sua temperatura superficial é de 439°C. Fonte: NASA Comparação do tamanho de Glieser 436b e Netuno Pressão de vapor Líquido Gás Fonte: http://saber.sapo.ao/wiki/Pressão_de_vapor A pressão de vapor de alguns líquidos A pressão de vapor de líquidos será menor quanto mais forte forem as interações Intermoleculares. Fonte: http://www.portalsaofrancisco.com.br/alfa/dilatacao/evaporacao-e-ebulicao.php As interações intermoleculares Ponte de hidrogênio Ponte de hidrogênio Dipolo-Dipolo As partículas dispersas em uma solução Soluto molecular Ex: glicose(s) 1 mol glicose(l) 1mol Total de moléculas: 1mol Partículas dispersas=1mol Soluto iônico Ex: Al2(SO4)3(aq) 2Al3+(aq) + 3SO42- (aq) 1mol 2x1x0,85 3x1x0,85 1,7 mol 2,55 mol Partículas dispersas: 4,25 mol (íons)+ 0,15 (15% que não ionizou)= 4,4 mol Fator de Van’t Hoff α=85% Total de íons: 1,7+2,55= 4,25 mol Ou você pode usar: Soluto molecular i=1 Soluto iônico i = α(q – 1) + 1 Partículas Dispersas: n° de mols iniciais x i Propriedades coligativas Tonoscopia Tonoscopia Lei de Raoult: Onde: Constante Tonométrica Concentração molal Para solutos moleculares i=1 i = α(q – 1) + 1 Fator de Van’t Hoff (só para íons) Fonte: http://www.colegioweb.com.br/quimica/tonometria-ou-tonoscopia- Ebulioscopia Lei de Raoult: ∆te = Ke . Mm . i Onde: Constante ebuliométrica Fonte:http://hermes.ucs.br/ccet/defq/naeq/materia l_didatico/textos_interativos_30.htm Pvapor = Patm Te0 = temperatura absoluta de ebulição do solvente (K) Lv = calor latente de vaporização do solvente (cal/g) R = constante dos gases perfeitos = 2 cal/mol . K Crioscopia Pvapor solido = Pvapor líquido Lei de Raoult: Onde: Constante crioscópica Fonte:http://www.profpc.com.br/propriedades_coligativas.htm Uma utilidade prática do abaixamento da temperatura de congelamento é a utilização de água e etilenoglicol no radiador de carros de países de clima frio, a mistura pode baixar a temperatura até –35° C. R: constante dos gases perfeitos = 2 cal/mol k Tc0: temperatura absoluta de congelamento do solvente (K) Lf: calor latente de fusão do solvente (cal/mol) Osmoscopia Pressão osmótica No final do processo iguala-se a pressão osmótica MSP=membrana semi-permeável Fonte:http://www.profpc.com.br/propriedades_coligativas.htm Resumindo... Efeito coligativo Propriedade Diminuição da pressão de vapor Tonoscopia Aumento do ponto de ebulição Ebulioscopia Diminuição do ponto de congelamento Crioscopia Aumento da pressão osmótica Osmoscopia Você sabia... Quando patinamos no gelo, de fato os patins deslizam sobre uma fina camada de água líquida, essa camada se forma devido à pressão exercida pelas lâminas dos patins, pressão essa que provoca a fusão do gelo. Uma utilidade prática do abaixamento da temperatura de congelamento é a utilização de água e etilenoglicol no radiador de carros de países de clima frio, a mistura pode baixar a temperatura até –35° C. Para fazermos carne seca, adicionamos sal à carne. O cloreto de sódio (sal de cozinha) retira a água da carne por osmose , impedindo o crescimento de microorganismos. Osmose e os seres vivos O processo de osmose está presente em muitos mecanismos de transporte celular, principalmente entre células vegetais e microorganismos unicelulares. No caso dos vegetais ocorre o transporte de água do solo úmido (meio hipotônico) para o interior da raiz (meio hipertônico). No caso de microorganismos unicelulares, geralmente com concentrações de solutos bem maiores que o meio externo (água doce), ocorre transporte contínuo de água para o seu interior; para não estourar, o microorganismo precisa bombear para fora o excesso de água. O contrário ocorre em microorganismos unicelulares de água salgada, havendo gasto de energia para repor a perda de água para o meio exterior mais concentrado, impedindo que o microorganismo murche. No Monte Everest, que está a uma altitude superior a 8.600 m a água entra em ebulição à 70°C. O café solúvel e o processo de Liofilização Bons estudos !
Baixar