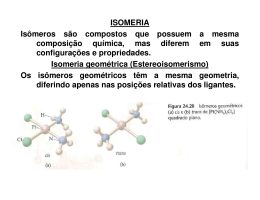
Vestibular UERJ 2011 Curso Prova Comentada Colégio COMENTÁRIO QUÍMICA A prova de Química do Exame Discursivo do vestibular da UERJ 2011 foi bastante tradicional em relação aos assuntos cobrados e apresentou questões mais fáceis que nos anos anteriores. A primeira questão abordava radioatividade, tema bastante recorrente nos anos anteriores. Com nível de dificuldade bastante reduzido, era necessário saber apenas os conceitos de meia-vida e de decaimento de radioisótopos. A segunda questão tratava de reações inorgânicas, mais especificamente sobre reações de dupla troca, sendo necessário identificar o metal ao qual a questão fazia referência por meio de conceitos bem comuns, como a reatividade de metais alcalinos em água e o conceito de substâncias isoeletrônicas. A terceira questão apresenta conceitos bem superficiais sobre acidez e basicidade de compostos orgânicos, tendo que indicar apenas a função que apresenta o maior caráter ácido. Em um segundo momento, tratava de interações intermoleculares, tendo que informar a substância apresentada que faz ligação de hidrogênio. A quarta questão falava sobre termoquímica. Era necessário calcular o valor da variação de entalpia da reação por meio das energias de ligação, fornecidas em uma tabela, tendo que ter atenção apenas em relação aos sinais de cada valor de energia: quebra de ligação — processo endotérmico — sinal positivo, e formação de ligação — processo exotérmico — sinal negativo. A questão pedia também a geometria da molécula do metanal, uma pergunta bastante tranquila para um candidato de específica. O conceito abordado pela quinta questão é o de equilíbrio químico, podendo ser considerada uma questão fácil, pois o equilíbrio era homogêneo e não ocorria variação das concentrações dos gases nitrogênio e oxigênio. Em outro momento, pedia-se também a fórmula estrutural das substâncias apolares (no caso N2 e O2); procedimento simples de ser feito, desde que se saibam as famílias às quais pertencem esses elementos. A questão seis é a primeira a se destacar na prova. Abordava cinética química pedindo, pela interpretação de um gráfico, o cálculo da velocidade média de uma reação. Era preciso estar atento à conversão de concentração mol por litro para gramas por litro. Isomeria era o tema abordado pela questão sete, bastando conhecer o conceito de isomeria de posição (pela mudança da localização da instauração) e o de isomeria geométrica (pela identificação da condição necessária para sua ocorrência). Além disso, há referência à reação de adição de bromo, solicitando ao candidato que indique quantos carbonos quirais existem no produto da reação. Na questão oito, o assunto são as ligações químicas, especificamente a ligação covalente no HCl, e as condições em que um composto molecular conduz corrente elétrica. A questão nove traz a mistura dos conceitos de polímeros e gases ideais, solicitando ao candidato que usasse a equação dos gases para chegar à massa pedida. Finalmente, a questão dez cobra estequiometria e cálculo de pH, revelando-se relativamente simples. Nela, a quantidade total de mol de íons H+ na solução deveria ser calculada por estequiometria, tomando-se o cuidado de equilibrar a equação fornecida. Professor: Gustavo Schueler
Download