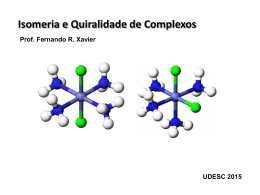
ISOMERIA Isômeros são compostos que possuem a mesma composição química, mas diferem em suas configurações e propriedades. Isomeria geométrica (Estereoisomerismo) Os isômeros geométricos têm a mesma geometria, diferindo apenas nas posições relativas dos ligantes. A isomeria cis-trans não é possível nos complexos com NC 2 ou 3, nem nos complexos tetraédricos, pois nestes sistemas todas as posições são adjacentes entre si. Isomeria óptica Os isômeros ópticos são moléculas imagens especulares que não podem ser sobrepostas. Isomeria óptica Os isômeros ópticos são moléculas imagens especulares que não podem ser sobrepostas. A DIFERENÇA MAIS CARACTERÍSTICA, IDENTIFICADA COM O QUALITATIVO ÓPTICO, ESTÁ NA ATIVIDADE ÓPTICA – AS SOLUÇÕES AQUOSAS DE 2 ISÔMEROS POSSUEM A PROPRIEDADE DE FAZER GIRAR O PLANO DA LUZ POLARIZADA (DESVIO ANGULAR DO PLANO DE POLARIZAÇÃO DA LUZ POLARIZADA PARA A DIREITA OU PARA A ESQUERDA). Isomeria de ionização Este tipo de isomeria se deve à troca de íons entre o íon complexo e íons externos. Descreve compostos de coordenação que têm composição idêntica, mas diferem no tipo de íons produzidos por ionização. - Estrutras dos isômeros de sulfatopentamincobalto (III) bromopentamincobalto(III). 2- ligação brometo e sulfato de de Exemplos: [Co(en)2 (NCS)2]Cl e [Co(en)2 (NCS) Cl] NCS [Pt(NH3)3 Br] NO2 e [Pt(NH3)3 NO2] Br Os isômeros em que ocorre a substituição de um grupo coordenado por água de hidratação são muito semelhantes a estes, e o tipo de isomeria se denomina, às vezes, isomeria de hidratação. [Cr(H2O)6] Cl3 Violeta [Cr(H2O)5 Cl] Cl2 Verde [Cr(H2O)4 Cl2] Cl Verde escuro Isomeria de ligação Sempre que um grupo ligante monodentado pode coordenar-se através de dois átomos diferentes, ocorre isomeria de ligação. Para que haja isomeria de ligação, tudo o que se requer, do ponto de vista teórico, é que o grupo ligante possua 2 átomos diferentes que tenham cada um um par de elétrons não compartilhados. Ex. [(NH3)5Co-NO2] Cl2 e [(NH3)5 Co-ONO] Cl2 (NH4)2 [Pt(SCN)6] O íon tiocianato pode unir-se ao metal através do N ou do S: Isomeria de Coordenação Ocorre sempre que são possíveis duas combinações diferentes: [Cr(NH3)6] [Cr(NCS)6] e [Cr(NH3)4 (NCS)2] [Cr(NH3)2(NCS)4] [Co(NH3)6] [Cr(C2O4)3] e [Co(C2O4)3] [Cr(NH3)6] Neste tipo de isomeria a parte catiônica e a parte aniônica são ambas complexas apresentando uma distribuição de ligantes diferentes.
Download