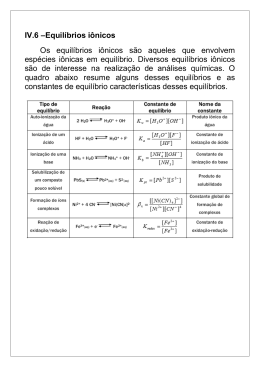
FISICO-QUIMICA Prof. Chico de Andrade e-mail : [email protected] EQUILÍBRIOS QUÍMICOS MOLECULARES A idéia do equilíbrio químico A primeira é a igualdade de Equilíbrios velocidades iônicos. das reações opostas. Para existir o equilíbrio a velocidade v1(reação direta) deve ser igual a v2 (reação inversa). Reações reversíveis são as reações que podem ocorrer nos dois sentidos, circunstâncias. conforme Por as exemplo, acima de certa temperatura T1, o gás N2O4 se converte totalmente no gás NO2. Ao contrário, abaixo da temperatura T2 é o NO2 quem se converte totalmente no N2O4. Pode-se atingido o concentrações substancias constantes equilíbrio, as de as todas presentes (não ficam necessária- mente iguais. Pode ocorrer que as concentrações dos chamados produtos sejam maiores que as dos reagentes, ou o contrário. Excepcionalmente, todas as concentrações podem ser iguais. e Nos primeiros só participam moléculas. iônicos A segunda característica é que, Moleculares Nos equilíbrios participam íons e moléculas (ou agregados iônicos). Os equilíbrios moleculares são, gasosos, em geral, homogêneos (uma fase) ou heterogêneos (duas ou mais fases) envolvendo gases e sólidos. Os iônicos são quase todos em fase aquosa contendo íons dissolvidos depositado com sem sólido (homogêneos) sólido ou depositado (heterogêneos). entender que no intervalo de temperaturas T2 < T < T1 as duas reações ocorrem ao mesmo tempo. Colocando-se um dos gases num recipiente fechado numa temperatura compreendida nesse intervalo, haverá a transformação parcial no outro gás. Quando as velocidades das duas reações ficam iguais, dizemos que os gases estão em equilíbrio químico. As A terceira característica é que existe uma relação matemática entre as substancias concentrações no das equilíbrio, conhecida como Constante de Equilíbrio (veja mais um pouco aqui.) O Princípio de Le Chatelier (Fuga ante a força). Princípio da Fuga ante a Força(Le Chatelier). características qualquer equilíbrio químico. de Trata-se do Princípio que rege os deslocamentos dos FISICO-QUIMICA equilíbrios e afirma Prof. Chico de Andrade e-mail : [email protected] que 1,a reação direta foi “Quando uma ação externa completa.Nesses perturba em extremos,não há equilíbrio.Se equilíbrio, ele se desloca para ele vale 0,4 significa que a um dos dois lados de modo a reação direta andou 40% até fugir atingir o equilíbrio. Veja mais um sistema da perturbadora”. são (a) ação Essas ações variação casos sobre equilíbrios aqui. da temperatura do equilíbrio, (b) Veja também (em inglês)um variação da concentração (ou conjunto de animações em: da pressão, no caso de gases) e (c) adição (parcial) ou remoção de algum dos componentes. Lembre que apenas no caso (a) o valor da Constante de Equilíbrio sofre alteração. Aprenda mais ao clicar aqui. Veja um vídeo com exercício resolvido aqui O grau de Avanço da reação direta. O grau de avanço da reação direta indica percentualmente quanto ela andou até atingir o equilíbrio. Ele é dado pelo quociente entre a quantidade (mols, geralmente) de algum reagente que foi consumido até atingir o equilíbrio e a sua quantidade inicial. O grau de avanço é um número no intervalo aberto entre zero e 1. Se o avanço é zero a reação direta não aconteceu.Se ele for http://www.chem.ox.ac.uk/vrchemis try/ChemicalEquilibrium/HTML/pag e01.htm#
Baixar