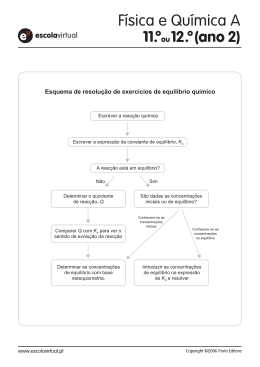
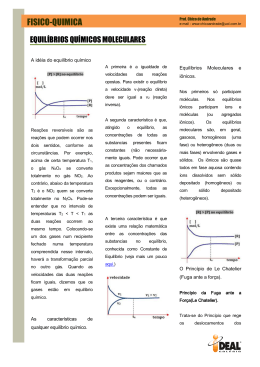
Equilíbrio Químico •São poucas as reacções que se dão num único sentido, a maioria é reversível em maior ou menor extensão Ex: N2O4 (g) D 2NO2 (g) •O equilíbrio químico é atingido quando as velocidades das reacções directa e inversa são iguais e as concentrações dos reagentes e dos produtos não variam com o tempo. •Figura 1: Variação das concentrações de NO2 e N2O4 ao longo do tempo em três situações diferentes: (a) no inicio só está presente NO2; (b) no inicio só está presente N2O4; (c) no inicio só está presente uma mistura de NO2 e N2O4. 1 Formas de exprimir as constantes de equilíbrio •Equilíbrio é caracterizado por uma constante (Ke) que no caso da reacção acima é dada 2 NO2 Ke N 2O4 •Equilíbrio homogéneo: quando todas as espécies envolvidas se encontram na mesma fase aA (g) D bB (g) Ke Bb Aa Em fase gasosa as concentrações podem ser expressas em atm. A Ke está relacionado com o Kp através da equação Kp Ke( RT ) Dn R = Constante dos gases perfeitos (0,0821 Latm/(K.mol) T = Temperatura (K) Dn = b-a = moles de produtos no estado gasoso – moles de reagentes no estado gasoso. •Equilíbrio heterogéneo: é uma reacção reversível envolvendo reagentes e produtos em fases diferentes. CaCO3 (s) D CaO (s) +CO2 (g) Ke CO2 PCO2 2 •Equilíbrio múltiplo C D AB E F C D E F AB Ke1 A+BDC+D C+DDE+F A+BDE+F Ke2 KeT Ke1 Ke2 Factores que afectam o equilíbrio químico 1. Concentração 2. Pressão: só afecta as concentrações dos gases. 3. Volume: afecta os gases uma vez que tanto líquidos como sólidos o volume é constante. 4. Temperatura: um aumento da temperatura favorece reacções endotérmicas e uma diminuição de temperatura favorece reacções exotérmicas. 3 Em caso de perturbação do sistema o que é que acontece? Principio de Le Chatelier: se um sistema em equilibrio fôr perturbado externamente, o sistema ajusta-se de forma a minimizar a acção dessa perturbação. 4 Variação da concentração no equilíbrio químico Ex: A 350ºC a constante de equilíbrio Ke para a reacção N2(g)+3H2(g) DNH3(g) é de 2,37x10-3. Numa dada experiência, as concentrações de equilíbrio são para N2 = 0,683 M; H2 = 8,80 M e NH3 =1,05 M. Suponhamos que se adicionar à mistura algum NH3 de forma a que a concentração aumente para 3,65M. (a) Use o principio de Le Chatelier para prever o sentido em que a reacção se desloca até atingir um novo equilíbrio. (b) Confirme a previsão calculando o quociente reaccional Qc e compare o seu valor com Ke. 5 Variação da pressão no equilíbrio químico • Variações na pressão não afectam as concentrações das espécies reagentes nas fases condensadas (por exemplo, numa solução aquosa) porque os líquidos e os sólidos são virtualmente incompressíveis. • Por outro lado, as concentrações dos gases são geralmente afectadas por variações de pressão. • Exemplo: considere os seguintes sistemas em equilíbrio • – (a) 2PbS(s)+3O2(g) D2PbO(s)+2SO2(g) – (b)PCl5(g) DPCl3(g)+Cl2(g) – (c)H2(g)+CO2(g) DH2O(g)+CO(g) Preveja o sentido da reacção global, em cada um dos casos, em resultado de um aumento de pressão (diminuição de volume) no sistema a temperatura constante. 6 Variação da pressão no equilíbrio químico • Uma variação na temperatura pode alterar a constante de equilíbrio. Os outros factores não provocam essa alteração. • Um aumento de temperatura favorece reacções endotérmicas e uma diminuição de temperatura favorece reacções exotérmicas. 7 Exercício: Considere o seguinte sistema em equilíbrio: N2F4 (g) D 2NF2 (g) DHº = 38,5 KJ Preveja as alterações no equilíbrio se (a) A mistura reaccional for aquecida a volume constante; (b) O gás NF2 for removido da mistura reaccional a temperatura e volume constantes; (c) A pressão da mistura reaccional diminuir a temperatura constante; (d) Um gás inerte, como o hélio, for adicionado à mistura reaccional a volume e temperatura constante. 8
Baixar