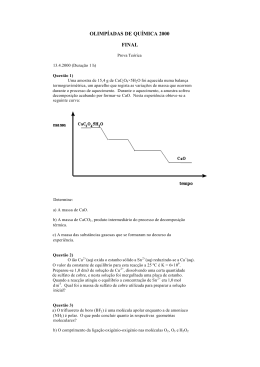
Escola da Apel Técnicas Laboratoriais de Química Trabalho elaborado por: Cátia Lucélia Sousa e Silva 11ºA5 nº5 Turno: B Março de 2004 Objectivos Este trabalho laboratorial, tem como objectivos, a síntese de um analgésico, o ácido acetilsalicílico, mais conhecido por aspirina; e calcular o respectivo rendimento desta reacção. Introdução Através das reacções de síntese, podemos obter determinado produto com a combinação de duas substâncias diferentes, neste caso o ácido salicílico vai reagir com o anidro etanóico, tendo como catalizador o ácido sulfúrico, e o produto final da reacção química será o ácido acetilsalicílico e o ácido etanóico. O ácido acetilsalicílico ou éster acético do ácido salicílico, acima referido é um analgésico, conhecido internacionalmente por aspirina e muito utilizado como antipirético, antireumático, antigripal, etc. A equação química que traduz a reacção de síntese ocorrida neste trabalho experimental, pode ser esquematizada da seguinte forma: COOH COOH O O H + CH3 Ácido salicílico(s) + C O C CH3 O O anidrido etanóico(l) CH3 C + CH3COOH O , ácido + ácido acetilsalicílico(s) etanóico(g) Durante esta actividade, precisamos de utilizar uma técnica de separação de substâncias: a filtração, que consiste na separação de uma fase sólida de outra líquida, passando esta última através de um meio poroso e permeável, o filtro. Este retém o resíduo sólido (filtrante), deixando passar o fluido (filtrado). Para a realização deste protocolo experimental será necessário o máximo de cuidado e protecção utilizando para além da bata, óculos, luvas e máscara, visto que trabalhamos com substâncias perigosas. Material - balança balão de Erlenmeyer banho de água bata caixa de petri espátula frasco de Kitasato funil de Buchner luvas máscara óculos papel de filtro placa de aquecimento proveta termómetro trompa de vácuo Produtos/Reagentes - ácido salicílico (C7H6O3) o Riscos: - nocivo por ingestão, - irritante para a pele e para os olhos o Segurança: não respirar as poeiras - anidrido etanóico (C4H6O3) o Riscos: - Inflamável, - Provoca queimaduras o Segurança: Guardar fora do alcance das crianças. Em caso de contacto com os olhos,lavar imediatamente com água e consultar o médico. - ácido sulfúrico concentrado (H2SO4) - água destilada Procedimento Experimental 1. Mediu-se 5 g de ácido salicílico, directamente no balão de Erlenmeyer, com a intenção de diminuir as perdas de material, e registou-se a massa de ácido com rigor. 2. Mediu-se 7 ml de anidrido etanóico. 3. Juntou-se o anidrido etanóico ao ácido salicílico. 4. Adicionou-se 5 gotas de ácido súlfurico concentrado ao conteúdo do balão de Erlenmeyer. Este ácido servirá, não só para catalizar a reacção, mas também para tornar o meio ácido, pois caso não o fosse, esta reacção iria dar origem a outros produtos. 5. Preparou-se um banho de água a aproximadamente 60º. 6. Colocou-se no banho de água o balão de Erlenmeyer, com a preparação atrás realizada. 7. Deixou-se reagir durante cerca de 15 minutos, agitando de vez em quando, de modo a dissolver todo o ácido salicílico. 8. Retirou-se o balão de Erlenmeyer do banho de água e adicionou-se 10 ml de água fria. Agitou-se cuidadosamente, até não se observar a libertação de vapores. 9. Pesou-se um papel de filtro, dobrou-se e colocou-se no funil de Buchner. 10. Filtrou-se os cristais obtidos a pressão reduzida, pois este tipo de filtração é muito eficaz e rápida; lavou-se com o mínimo de água fria e deixou-se secar ao ar, para que a solução ficasse mais concentrada por evaporação do solvente, secando o sólido. 11. Calculou-se a massa dos cristais obtidos. 12. Calculou-se o rendimento da reacção. Observações\Medições Neste trabalho experimental, observou-se que ao aquecermos a solução em banho-maria libertou-se vapores desagradáveis e irritantes. Este fenómeno voltou a acontecer quando adicionamos água, sendo o vapor libertado ácido acético, um dos produtos da reacção, que ao agitar foi totalmente libertado. Durante o aquecimento da preparação em banho de água, esta depois de algum tempo foi ficando com aspecto homogéneo e incolor. Logo depois da filtração era já visível cristais de pequenas dimensões. Descrição: Massa do papel de filtro Massa do ácido salicílico Volume do anidrido etanóico Massa do conjunto (papel de filtro + ácido acetilsalicílico) Massa do ácido acetilsalicílico (massa prática) Massas: 0,69 g 5,00 g 7,0 ml 5,91 g 5,22 g Cálculos/Resultados C7H6O3 (s) + C4H6O3 (l) C9H8O4 (s) + CH3COOH (g) mC9H804 = 5, 91 – 0,69 = 5,22 g M (C7H6O3) = 7*12 + 8 + 3*16 = 138 g/mol M (C4H603) = 4*12 + 6 + 3*16 = 102 g/mol M (C9H8O4) = 9*12 + 8 + 4*16 = 180 g/mol Calculo do reagente limitante: d(C4H603) = 1,082 g/cm3 d = m/V (=) m = V*d (=) m = 7*1,082 (=) m = 7,6 g de C4H6O3 n(C4H6O3) = m/M = 7,6/102 = 0,075 mol n(C7H6O3) = m/M = 5/138 = 0,036 mol Logo o reagente limitante é o ácido salicílico Cálculo da Massa Teórica: 1 mol de C7H603 138 g 5g 1 mol de C9H8O4 180 g x x = 6, 52 g Cálculo do Rendimento: = mprática / mteórica * 100 = 5,22 / 6,52 * 100 = 80 % Conclusões Após a realização deste relatório, podemos concluir que todos os objectivos foram alcançados com algum sucesso, ou seja, conseguiu-se sintetizar o ácido acetilsalicílico e calcular o respectivo rendimento, sem registos de acidentes. Contudo, o valor obtido do rendimento não foi o melhor, visto que o rendimento foi de 80%, deduz-se que existiram fontes de erro que provocaram um menor rendimento da reacção. Esse facto pode estar relacionado com alguma perda de material, nas transferências de substâncias e na filtração. Outros supostos factores que contribuíram, para valor de rendimento, podia ter sido no decorrer da reacção principal ocorreram outras secundárias consumindo os reagentes; estes podiam conter impurezas. O ácido salicílico pode não ter dissolvido na totalidade. O ácido sulfúrico adicionado para catalizar a reacção e tornar o meio ácido, pode não ter sido o suficiente; ou então, o papel de filtro, por estar húmido, podia também ter contribuído para o erro. Concluí também, que é muito importante conhecer as substâncias que vamos utilizar para que assim possamos nos proteger devidamente pois, todo o cuidado é pouco. A aspirina sintetizada nesta actividade experimental não é igual à fabricada industrialmente, pois contém impurezas. Terminado este trabalho, posso afirmar, que este foi muito importante para mim, pois fiquei a conhecer mais e melhor a diversidade de substâncias sintetizadas em laboratório, no entanto muito utilizadas no dia a dia. Bibliografia ## Simões T. S., Queirós M. A., Smões M. O. (1999), Técnicas Laboratoriais de Química, Porto, Porto Editora. # Pinto H. C., Carvalho M. de J., Fialho M. M. (2003), Técnicas Laboratoriais de Química, Lisboa, Texto Editora. # Internet: http://qmc.ufsc.br/organica/aula01/aula01_2.html Observações: ________________________________________ ___________________________________________________________ ___________________________________________________________
Baixar