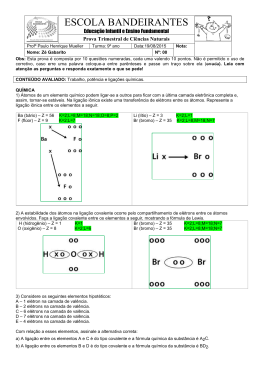
EXAME FINAL QUÍMICA – 9º ANO TABELA PERIÓDICA ATUAL Atualmente, os elementos químicos são agrupados em ordem crescente de número atômico (Z), em linhas horizontais, denominadas períodos ou séries, e em colunas verticais, denominadas famílias ou grupos. CLASSIFICAÇÃO PERIÓDICA DOS ELEMENTOS PERÍODOS OU SÉRIES Existem sete (7) períodos, sendo que o número de cada período corresponde ao número de camadas eletrônicas que existem nos elementos desse período. FAMÍLIAS OU GRUPOS Existem dezoito (18) colunas verticais, que podem ser representadas de duas maneiras: IA, IIA, IB, IIB, . . . . . . . ., 0 ou 1, 2, 3 . . . . . . . . . . . . ., 18. Os elementos de uma mesma família apresentam a mesma configuração eletrônica na sua camada de valência (última camada) e propriedades químicas semelhantes. Algumas dessas famílias ou grupos apresentam nomes especiais. Nas configurações acima, n é o número do nível da última camada (camada de valência). CLASSIFICAÇÕES DOS ELEMENTOS Pode ser feita em função das propriedades gerais dos elementos: metais: são bons condutores de calor e eletricidade. Apresentam brilho característico, são dúcteis (produzem fios) e maleáveis (produzem lâminas). ametais: em geral, são mais condutores de corrente elétrica e calor, não apresentam brilho e são quebradiços. gases nobres: sua principal característica química é a grande estabilidade, ou seja, possuem pequena capacidade de se unirem com outros elementos. Os elementos nas vizinhanças do traço em destaque na ilustração acima apresentam propriedades intermediárias entre os metais e ametais, e são conhecidos por semimetais. O hidrogênio não se enquadra em nenhum desses grupos, porque apresenta características diferentes. EXERCÍCIOS 1) (UNIP-SP) – A tabela abaixo representa a porção superior de classificação periódica, tendo sido os símbolos escolhidos arbitrariamente e não correspondendo aos símbolos usuais dos elementos químicos. O número atômico do elemento E é 9. D W E M G J L R X Y U Q Z T 2) Quantos elementos ficam situados na fila horizontal em branco entre os elementos Y e U? a) 3 b) 8 c) 10 d) 18 e) 32 3) Que elemento possui maior numero atômico a) L b) X c) G d) Q e) T 4) (UNESP – SP) – Nesta tabela periódica, os algarismos romanos substituem os símbolos dos elementos. I II III IV V IX VI VII X Sobre tais elementos, é correto afirmar que a) I e II são líquidos à temperatura ambiente b) III é um gás nobre c) VII é um halogênio d) o raio atômico de IV é maior que o de V e menor que o de IX e) VI e X apresentam o mesmo número de camadas eletrônicas Tabela relacionada as questões seguintes. Observe a colocação dos elementos na tabela abaixo, representados por símbolos que não correspondem aos verdadeiros, e depois responda às questões a seguir Q T Z R Y V X U P 5) O elemento de transição é: a) T b) X c) V d) U e) Y 6) O elemento mais eletropositivo de todos os indicados é: a) U b) Z c)Y d) R e) Q 7) O elemento de menor ponto de ebulição é: a) Y b) P c) R e) T d) X 8) O elemento que apresenta 6 elétrons na camada de valência é: a) T b) X c) Y d) P e) R LIGAÇÕES QUÍMICAS Ligação Iônica Ligação que transfere elétrons, formando aglomerados iônicos. Os íon são partículas de um átomo (ou grupo de átomos) quer perdeu ou recebeu um ou mais elétrons. Ligação Covalente É a ligação que compartilha elétrons dos átomos que se ligam. Cada átomo passará a ter uso comum do par de elétrons na camada de valência. Ligação Covalente Dativa Uma ligação semelhante a covalente comum e ocorre entre um átomo que já atingiu a estabilidade eletrônica e outro ou outros que necessitam de dois elétrons para completar sua camada de valência. Ligações Metalicas É a ligação feita entre os metais. Exemplos: - Ouro 18 quilates é uma liga de ouro e cobre - Bronze é uma liga de cobre e estanho - Latão é uma liga de cobre e zinco - Aço é uma liga de ferro com pequena quantidade de carbono. 1) Complete as frases: a) A união entre átomos é chamada de _____________________________. b) A ligação iônica _______________ elétrons., formando um aglomerado iônico. c) Na ligação covalente _________________ elétrons dos átomos que se ligam. d) Só nas ligações metálicas são feitas entre os _________________. 2) Faça os esquemas das ligações iônicas colocando Notação de Lewis: (+3) (-7) a) Al F3 (+2) (-7) d) CaF2 (+) (-6) (+) (-7) b) H2S c) NaCl (+3) (-6) e) Al2O3 (+) (-6) f)Na2O 3) Faça os esquemas das ligações covalentes: (+) (-6) (+5) (-7) a) H2O2 b) NF3 (+4) (-7) (+3) (-6) d) CF4 e) Al2O3 (+4) (-6) c) CO2 (-7) f) Cl2 4) Faça os esquemas de ligações covalentes dativas: (+6)(-6) a) SO2 (+)(+6)(-6) c) H2SO4 (+6) (-6) b) SO3 (+)(+5)(-6) d) HNO3 5) Em 1985, foi divulgada em uma publicação científica a descoberta de uma molécula tridimensional de carbono, na qual 60 átomos formam uma esfera com 12 pentágonos e 20 hexágonos, como uma bola de futebol. Em homenagem ao arquiteto e pensador norte-americano Buckminster Fuller, a molécula foi denominada bucminsterfullerene ou simplesmente buckyball. A molécula C60 também é chamada de futeboleno. Os átomos de carbono estão unidos entre si por ligações caracterizadas pelo compartilhamento de pares de elétrons. Portanto, os átomos de carbono no futeboleno ficam unidos por meio de uma ligação. a) iônica b) metálica c) covalente d)de hidrogênio e) iônica e uma covalente
Baixar