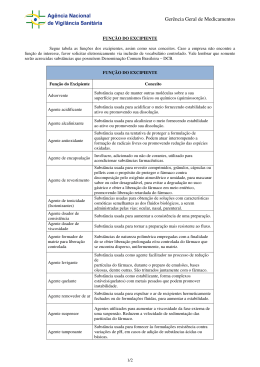
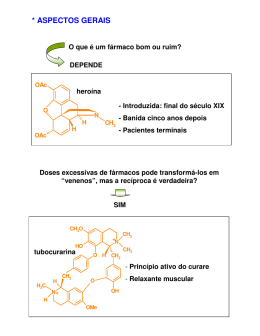
Design de fármacos Objectivos do design de um fármaco Aumentar a actividade (aumentar as interacções); Reduzir os efeitos secundários (aumentar a selectividade); Ser administrado ao doente de uma forma fácil e eficiente; Tornar mais fácil a sua síntese e ser mais económica. Modos de actuação A variação das propriedades físico-químicas: polaridade com isto varia a solubilidade o que permite ultrapassar as barreiras tecido-sangue; pka (acidez ou basicidade do composto); Aumentar o tempo de vida do fármaco no organismo tornando-os mais resistentes à hidrólise e metabolismo; Diminuir o tempo de vida do fármaco no organismo tornando-os menos tóxico. Diminuição da polaridade Converter os grupos polares, -OH, -COOH, -, NH2, -NHR em éteres, esteres ou amidas respectivamente. Por adição de um grupo extra, grupo hidrofóbico com maior tamanho. Variando a polaridade dos grupos funcionais Aumento da polaridade No caso dos anti fúngicos o aumento da polaridade dos grupos funcionais, permitiu a administração oral do fármaco (o farmaco tem que ter uma certa solubilidade em água para se dissolver e ser absorvido Variação do pKa Uma forma de variar o pka é “aprisionar” o azoto dentro de um anel. A Benzamidina é anti-trombótico Aumentar o tempo de vida do fármaco no organismo tornando-os mais resistentes à hidrólise e metabolismo Modos de actuação 1. Protecção estérea 2. Efeitos electrónicos: bioisosteres 3. Modificações estereo electrónicas 4. Bloqueadores metabólicos 5. Remoção de grupos metabólicos susceptíveis 6. Deslocamento dos grupos 7. Variação do anel Protecção estérea Permitem aumentar o tempo de vida do fármaco no organismo tornando-os mais resistentes à hidrólise e metabolismo 1. Protecção esterea:os grupos mais susceptíveis à hidrólise enzimática são os esteres e amidas. A estratégia que se usa é adição de um grupo alquílico volumoso próximo desse grupo funcional 2. Grupo terc-butilico no agente anti-reumático D1927, funciona como protecção esterea ao grupo amida. O HS O N N H O H N O CONHMe C CH3 H3C CH3 Protecção esterea Efeitos electrónicos: bioisosteres Bioisosteres (def.) é um grupo químico usado para substituir outro grupo químico dentro do fármaco, os quais são biológicamente equivalentes mas não necessáriamente quimicamente equivalentes. A substituição de um grupo por outro serve para promover a optimização das propriedades biológicas do fármaco. Ex1: substituição do grupo metilo por uma amina. NH2 tem a mesma valência e tamanho que o grupo metilo e tem propriedades electrónicas completamente diferentes dado que pode fornecer electrões para o grupo carboxílico, evitando a hidrólise. Ex2: Substituição do grupo ester por grupo amida (o oxigénio é substituido por azoto). As amidas sãomais resistentes à hidrólise, dado que fornece electrões ao grupo carbonilo e o carbono fica menos electrofílico. Exemplo é o desenvolvimento do antagonista da dopamina. NEt NEt O NH NH OMe OMe EtO2S EtO2S Modificações estereo electrónicas Exemplo da procaína e lidocaína: procaína é uma anestésico local que se hidrolisa rapidamente, pelo que se substitui o grupo ester por um grupo amida, e os grupos metilo protegem o grupo carbonilo dos ataques dos nucleófilos da enzima CH3 O C OCH2CH2CH2NEt2 H2N Procaína H2N O N C CH NEt 2 2 H CH3 Lidocaína Bloqueadores metabólicos Exemplo é o acetato de megestrol (contraceptivo oral) é oxidado na posição 6 para formar o grupo –OH. Formando-se em seguida o conjugado polar que pode ser eliminado pelo sistema. A introdução do grupo -CH3 evita o metabolismo e prolonga a vida do fármaco. Remoção de grupos metabólicos susceptíveis As reacções metabólicas mais comuns, entre outras são: R R CH3 R Oxidação aromática do grupo metil R R COOH R R C-hidroxilação aromática R OH Exemplo da substituição de um grupo susceptível de ser alterado é a tolbutamida (anti-diabético), em que o grupo metilo foi substituído por um cloro Me O H H S N C N CH2CH2CH2CH3 O O Tolbutamida Cl O H H S N C N CH2CH2CH2CH3 O O Cloropropamida Deslocamento de grupos (I) Ex: é o Salbutamol (anti-asmático) é semelhante à nor-adrenalina, contudo não é metabolizado OH HO HO H OH Me C CH2NHC Me Salbutamol HO Me H OH C CH2NH2 Nor-adrenalina Compostos de catecol 2OH-C6H4 sofrem metilação de um grupo fenólico. Dado que ambos estão envolvidos na ligação ao receptor, a metilação de um deles impede a sua metabolização do fármaco, mas torna-o inactivo. MeO HO HO H OH Me C CH2NHC Me Catecol O-metil transferase Me HO H OH Me C CH2NHC Me Me Deslocamento de grupos (II) O problema foi ultrapassado adicionando um grupo metileno entre o grupo fenil e hidroxilo. Isto veio trazer a ideia que a ligação ao receptor envolve uma região e não um ponto. Variação do anel Exemplo do tioconazol e do fluconazol (que é mais estável) Cl N N S H C O N N N N F Cl Cl N OH C O F N Diminuir a tempo de vida do fármaco no organismo (I) A não eliminação do fármaco pode levar à toxicidade e a efeitos laterais persistentes. A diminuição da estabilidade química e metabólica pode ser útil. Caso 1: introdução do grupo metilo, uma vez que este é oxidado a álcool ou a ácido carboxílico. O exemplo é o composto L787257 (testado contra a artrite). SO2Me SO2Me Cl Cl CH2OH N N N N CH3 CO2H Caso 2: Os fármacos podem-se “autodestruir” quando as condições se modificarem. Um exemplo é o atracurium (antagonista neuromuscular) é estável a pH ácido, mas em condições ligeiramente alcalinas, como as existentes no sangue degrada-se. Diminuir a tempo de vida do fármaco no organismo (II) Caso 3: Cromakalim é um anti-asmático que tem efeitos secundários a a nível do coração, pelo que quando entra na circulação sistémica que ser rapidamente eliminado. Os compostos derivados da cromakalim a ser testados clinicamente Têm um grupo ester que pode ser hidrolisado e um grupo -OH que pode ser conjugado. O O N O NC OH O N N N N O Me Me Me OH Me Me N N O HO O2S OH O CO2Et Cromakalim São rápidamente metabolizados Me Me Redução da toxicidade Existem grupos funcionais que podem ser transformados em metabolitos tóxicos: nitroaromáticos, aminas aromáticas, bromoarenos, hidroxilaminas, polihalogenados. Ex1: N N N N OH N C O N N N N N C O N F Cl Cl N OH F Fluconazole Ex2: Mudança de posição do substituinte HN H N NC N N O NC grupos Design de fármacos alvo São fármacos que atingem o sítio exacto do corpo onde são precisas. Fármacos de procura e destruição de células tumorais: consiste em ligar o fármaco a um “bloco estrutural” molecular que vai ser necessário à célula cancerosa que se divide rapidamente. Temos o caso do fármaco-aminoácido e da ligação fármaco-base do ácido nucleico; Ex: uracil mustarda Cl O N HN O N H Cl Fim
Baixar