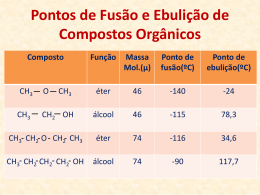
Orgânica – Propriedades Físicas SOLUBILIDADE “SEMELHANTE DISSOLVE SEMELHANTE” ÁGUA – substância mais polar que existe na natureza. HIDROCARBONETOS - apolares DEMAIS FUNÇÕES – polares até ± 5 C. A polaridade decresce com o aumento da cadeia carbônica. Quanto maior a cadeia carbônica de uma substância, menor é sua solubilidade em água. SOLUBILIDADE Ácido carboxílico: mais polar Éter: menos polar Oxigênio entre C = pouca interação com a água. Maior interação com a água. Maior solubilidade. Exemplo: Solubilidade em água de algumas cetonas H3C CH3 O Propanona: Infinita H3C O CH3 2-pentanona: 6,3 g/100 mL O Butanona: 26 g/100 mL CH3 H3C O H3C CH3 3-pentanona:5 g/100 mL PONTO DE FUSÃO e EBULIÇÃO MESMA FUNÇÃO, DIFERENTE MASSA MOLAR Quando a função é a mesma, quanto maior a cadeia carbônica, maior o ponto de fusão e ebulição. ↑M ↑PE FÓRMULA CH2O2 C2H4O2 C3H6O2 C4H8O2 C5H10O2 C6H12O2 Nome usual ac.fórmico ac.acético ac.propiônico ac.butírico ac.valérico ac.capróico Nome IUPAC Ac. metanóico Ac. etanóico Ac. propanóico Ac. butanóico Ac. pentanóico Ac. hexanóico PE (°C) 100,7 118,2 140,9 163,5 186,0 205,0 PONTO DE FUSÃO e EBULIÇÃO Os hidrocarbonetos variam seu ponto de ebulição conforme o número de átomos de carbono que possuem em suas moléculas. PETRÓLEO PONTO DE FUSÃO e EBULIÇÃO FUNÇÃO DIFERENTE, MASSA MOLAR PRÓXIMA Quando a função é diferente, quanto maior a força atrativa entre as moléculas, maior o ponto de fusão e ebulição. ↑ FORÇA ATRATIVA ↑PE HC (apolar) < dipolo-dipolo (polar) < ponte de hidrogênio (muito polar) PONTO DE FUSÃO e EBULIÇÃO FORÇAS ATRATIVAS: - ponte de hidrogênio: ocorre entre compostos muito polares, que possuem H ligado a O ou a N. - OH álcool fenol ac. carboxílico - NH amina 1ª e 2ª amida 1ª e 2ª - forças de van der Waals dipolo-dipolo ou dipolo permanente: ocorre entre moléculas polares, como: éter, aldeído, cetona, éster, amina e amida 3ª, nitrocomposto, haleto dipolo induzido-dipolo instantâneo: uma interação molecular muito fraca, denominada Forças de London. Ocorre entre moléculas apolares, ou seja, entre hidrocarbonetos. PONTO DE FUSÃO e EBULIÇÃO álcool etílico ( C2H6O) CH3 - CH2OH éter dimetílico ( C2H6O) CH3 - O - CH3 LÍQUIDO (PE = 78°C) ponte de H GASOSO (PE = - 23,5°C) Van der Waals (dip-dip) PONTO DE FUSÃO e EBULIÇÃO QUANTO MAIS POLAR, MAIOR O PONTO DE EBULIÇÃO PONTO DE FUSÃO e EBULIÇÃO MESMA FUNÇÃO, MESMA MASSA MOLAR Quando a função e a massa é a mesma, quanto maior o número de ramificações, menor será o PE. + LINEAR ↑PE PONTO DE FUSÃO e EBULIÇÃO pentano - PE=36ºC dimetil propano - PE=9,5ºC metil butano - PE=28ºC
Baixar