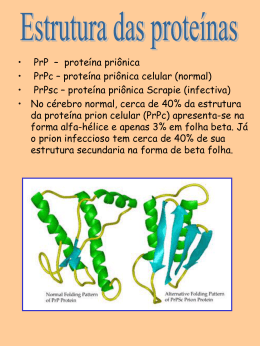
Estrutura tridimensional de proteínas Prof. Dr. Francisco Prosdocimi Níveis de Estruturas Protéicas A conformação espacial das proteínas • As proteínas não são traços rígidos porque suas ligações químicas podem realizar rotação – A maioria das ligações químicas não são planares • Cada proteína tem uma estrutura específica que depende de – sua estrutura primária – interações químicas resultantes entre as cadeias laterais dos aminoácidos – modificações pós-traducionais – condições do meio em que elas estão inseridas Temas importantes 1. A conformação tridimensional (3D) depende da seqüência de aminoácidos 2. A função depende da estrutura 3. Cada proteína existe em um ou em pequeno número de formas estruturalmente estáveis 4. As principais forças para a estabilização de estruturas são forças não-covalentes 5. Existem padrões estruturais comuns que ajudam a organizar o entendimento apolipoprotein A-I (PDB code 1AV1) Estrutura formada apenas por alfas-hélices Conformação nativa • Proteína dobrada em conformação funcional • Dobramento espacial se dá principalmente por interações fracas – principalmente hidrofóbicas – Ligações de H e iônicas são otimizadas em estruturas termodinamente mais favoráveis • Estabilidade estrutural – Tendência a manter a conformação nativa – Ligações dissulfeto são incomuns, mas estabilizam proteínas de organismos termófilos • Camada de solvatação: formada pela água envolvendo uma molécula hidrofóbica Estrutura de uma treptavidina, proteína modificada a partir da estreptavidina humana que funciona biotecnologicamente para ligar outras moléculas, como a biotina. Formada apenas por folhas beta e loops (2Y3E) Ligações peptídicas e o ângulo omega • Ligações peptídicas teem geometria rígida e planar Trans: ω = 180º Ângulos torsionais, phi e psi • Responsáveis pela curvatura na estrutura da proteína • Entre o C-α e o N (do NH2) e o C (do COOH) Omega, phi e psi Diagrama de Ramachandran • Devido a restrições espaciais, nem todos os ângulos são possíveis • Impedimento estérico: dois átomos não podem ocupar o mesmo lugar • Azul escuro: áreas sem sobreposição • Assimetria do diagrama vem do fato de que os resíduos das proteínas são L-aminoácidos – Gly tem menos impedimentos estéricos Estrutura secundária de proteínas Prof. Dr. Francisco Prosdocimi Estruturas secundárias • Descreve o arranjo espacial dos átomos na cadeia principal • Ocorre quando os ângulos diedros (phi e psi) permanecem quase iguais durante todo um segmento da proteína • Tipos – – – – Hélices α Conformações β Voltas β Indefinida (loops, coils, turns) Alfa-hélices • O arranjo mais simples que as proteínas podem assumir é um arranjo helicoidal • Esqueleto polipeptídico fica enrolado em torno de um eixo imaginário – Cada volta contém 3,6 resíduos – Φ = -57º; ψ = -47º • Grupos R se voltam para fora do eixo • Em média, 25% dos aminoácidos de qualquer proteína estão em hélices α All-alpha proteins Estabilidade da alfa hélice • A hélice é comum porque nesse modelo as posições das ligações de hidrogênio estão otimizadas – Entre um H ligado ao NH2 e um O do COOH – Cada ligação peptídica participa de ligação de hidrogênio, conferindo estabilidade • Para isso, todos os aminoácidos precisam ter o mesmo tipo de isomeria óptica (L ou D) Tendência dos aa’s em formar hélices • O grupo lateral interfere na capacidade do aminoácido em formar hélices – Volume e forma de Asp, Ser, Thr e Cys desestabilizam se estiverem muito próximos – Pro e Gly dificultam a formação de hélices • Relações com o vizinho também são importantes • Componentes amino a carbonil formam dipolo elétrico Restrições para a formação de hélice-α 1951 1. Tendência do resíduo em formar hélice 2. Interações entre os grupos R espaçados 3-4 aa 3. Volumes dos grupos R adjacentes 4. Ocorrência de Pro e Gly 5. Interações entre resíduos das extremidades com o dipolo Conformação β (beta) • Esqueleto estendido em forma de zigue-zague • Folhas β paralelas e antiparalelas – Paralela: Φ = -119º; ψ = 113º – Anti-par: Φ = -139º; ψ = 135º • Quanto as folhas são próximas, os grupos R devem ser pequenos – Teias e queratinas... Gly e Ala Estruturas em folhas Beta • Beta-propeller Beta-barril Voltas-β • A presença de resíduos em voltas ou alças invertem a direção da cadeia Ramachandran para estruturas 2D • Valores de phi e psi bem definidos Dicroismo circular (CD) • Uma assimetria estrutural em uma molécula leva a diferenças de absorção de luz polarizada • A medida dessa diferença permite-nos ter uma ideia da estrutura secundária de uma proteína Estruturas terciárias e quaternárias de proteínas Prof. Dr. Francisco Prosdocimi Estrutura terciária (3D) • Arranjo tridimensional total de todos os átomos de uma proteína • Alcance mais longo e dimensão total, quando comparado com 2D • Segmentos distantes na estrutura 1D podem ser atraídos por interações fracas • Algumas proteínas são formadas por mais de um complexo polipeptídico (quaternária) • Proteínas fibrosas e globulares Proteínas fibrosas • Queratina, colágeno, fibroína – Proteínas estruturais: força e elasticidade • Insolúveis em água: aa’s hidrofóbicos (Ala, Val, Leu, Ile, Met e Phe) • Alfa queratina: cabelo, pelo, unhas, garras, penas, chifres, cascos e parte externa da pele • Pontes dissulfeto estabilizam e dão mais resistências às cadeias Colágeno • Tecidos conectivos: tendões, cartilagens – Garante resistência • Hélice específica (phi = 51º; psi = 153º) • Existem mais de 30 variantes do colágeno dependendo do tecido e da função Fibroínas de seda • Folhas beta • Rica em A e G – Alto empacotamento • Ligações de H entre as cadeias B • Não é elástica, mas é flexível Proteínas globulares • Diversidade estrutural reflete diversidade funcional – Dobramento gera estrutura compacta • Teem partes em hélices-a e partes em folhas-B • Motivos estruturais – Padrão identificável – Envolve elementos 2D e conexões entre eles Classificação estrutural das proteínas Classificação estrutural das proteínas SCOP – Famílias de proteínas Estrutura quaternária • Dímeros, homodímeros, heterodímeros • Trímero, tetrâmero • Oligômero, multímero Desnaturação de proteínas • Condições diferentes das celulares levam as proteínas à desnaturação • Perda da estrutura leva também à perda da função • Calor, pHs extremos, temperatura (?), solventes orgânicos, detergentes Renaturação de proteínas • A sequência terciária é determinada pela sequência primária, certo? • As proteínas desnaturadas, portanto, podem voltar aos estados nativos através de renaturação, quando o estímulo é retirado Enovelamento protéico • Lento e gradual • Diminuição da entropia até alcançar um estado estável • Algumas proteínas se dobram de forma assistida pelas proteínas chaperonas Vaca louca • A doença de CreutzfeldtJakob, é causada por uma falha no enovelamento de proteínas • Mecanismo não muito entendido, mas parece que as proteínas em forma priônica transformam as outras tbm em proteínas com esse formato Conclusões • Estrutura da proteína é estabilizada principalmente por interações fracas • Estrutura secundária consiste no arranjo espacial de átomos de trechos de proteínas, definidas por ângulos phi e psi específicos • A estrutura 3D das proteínas tem dois tipos básicos: proteínas fibrosas e globulares • A estrutura quaternária vem da junção de várias subunidades terciárias oriundas de genes • A estrutura das proteínas pode ser destruída pela desnaturação, o que mostra que a função depende da estrutura • Enovelamento de proteínas envolve múltiplos mecanismos
Baixar