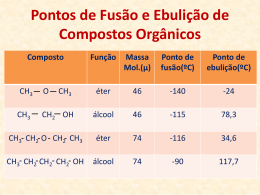
Reacções de Alcenos e Alcinos Reactividade de C=C Electrões na ligação π estão menos “seguros”. Electrófilos são atraídos para os electrões π. Forma-se carbocatiões como intermediários. Nucleófilo adiciona-se ao carbocatião. O resultado é a adição à dupla ligação. Mecanismo de reacção O mecanismo de reacção descreve como a reacção ocorre. Quais as ligações que se quebram e quais as ligações que se formam. A ordem em que tem lugar a quebra de ligação e a formação de ligação. O papel do catalisador (se estiver presente algum). A energia do sistema durante a reacção. Diagrama de energia Diagrama de energia: o gráfico mostra as alterações de energia durante a reacção química; a energia é colocada no eixo-y e o progresso da reacção é colocado no eixo do x. Coordenada de reacção: A medida do progresso da reacção. Desenhada no eixo do x no diagrama de energia da reacção. Calor de reacção H:A diferença de energia entre os reagentes e os produtos. Exotérmica: os produtos da reacção têm energia mais baixa que os reagentes; o calor é libertado. Endotérmica: os produtos da reacção são de mais alta energia que os reagentes; o calor é absorvido. Diagrama de energia Figura mostra um diagrama de energia de uma reacção que ocorre num passo entre C e A-B para dar C-A e B. Diagrama de energia Estado de transição: Uma especie instável de energia máxima formada durante a curso da reacção; o máximo no diagrama de energia. Energia de Activação Ea: A diferença em energia entre os reagentes e o estado de transição. Ea determina a velocidade da reacção. Se Ea é grande ocorre baixa colisão molecular com suficiente energia para atingir o estado de transição, e a reacção é lenta. Se Ea é pequena muitas colisões geram energia suficiente para atingir o estado de transição, a reacção é rápida. Diagrama de energia Figura mostra um diagrama de energia numa reacção em dois passos com formação de um intermediário. Desenvolver o Mecanismo de Reacção Desenhar experiências para mostrar os detalhes de uma dada reacção química. Propor um conjunto de passos que justificam a transformação geral. O mecanismo torna-se estabelecido quando é consistente com todos os testes que possamos fazer. Isto não significa que o mecanismo está correcto, é apenas a melhor explicação que possamos ter. Adição electrofílica ao alcenos Adição dos haletos de hidrogénio (HCl, HBr, HI) Adição de água (H2O/H2SO4) Hidrohalogenação Hidratação catalisada por ácido Adição de halogénios (Cl2, Br2) Halogenação Adição de HX Decorre com reagentes puros ou em solvente polar como o ácido acético. CH2 =CH2 + HCl Ethylene H Cl CH2 -CH2 Chloroeth ane Adição é regioselectiva. Reacção regioselectiva: A reacção ocorre preferencialmente numa direcção. CH3 CH=CH2 + HCl Prop ene Cl H H Cl CH3 CH-CH2 + CH3 CH-CH2 2-Chloropropane 1-Ch loroprop ane (not observed ) Regra de Markovnikov: Na adição do HX à dupla ligação, H adiciona ao carbono já com maior número de hidrogénios ligados. Adição do HCl ao 2-Buteno O mecanismo de dois passos Passo 1: Formação do catião sec-butil, um carbocatião 2° como intermediário de reacção Passo 2: Reacção do catião sec-butil (um electrófilo) com ião cloreto (um nucleófilo) completa a reacção. HCl + 2-Buteno Figura mostra um diagrama de energia da reacção em dois passos, da adição do HCl ao 2-buteno,. A reacção é exotérmica. Carbocatiões Carbocatiões: são espécies que contêm um átomo de carbono, com apenas 6 electrões na camada de valência e têm portanto uma carga positiva. Carbocatiões são: Classificados como 1°, 2°, ou 3° dependendo do número de carbonos ligados ao carbono com carga positiva. Electrófilo: significa que gostam de electrões Ácido de Lewis; significa que são aceitadores de pares de electrões. Carbocatiões Os ângulos de ligação em torno do carbono com carga positiva é aproximadamente 120°. Carbono usa orbitais hibridas sp2 para formar ligações sigma aos três grupos ao qual está ligado. A orbital não hibridada 2p permanece perpendicular à ligação sigma e não tem electrões. Carbocatiões O carbocatião 3° é mais estável que o carbocatião 2°, e requer menos energia de activação para a sua formação. O carbocatião 2° é, mais estável que o carbocatião 1°, e requer menos energia de activação para a sua formação. Carbocatiões 1º e grupo metil são instáveis e nunca observados em solução. Estabilidade Relativa dos Carbocatiões Efeito Indutivo: A polarização da densidade electrónica da ligação covalente como resultado da electronegatividade do átomo próximo. A presença da carga positiva no carbono exerce um efeito indutivo electrãoatractor que resulta na polarização dos electrões adjacentes através da ligação sigma. Portanto, a carga positiva do carbocatião não está localizada no carbono trivalente mas sim está deslocalizada pelos átomos próximos. Quanto maior a área de deslocalização da carga positiva, maior a estabilidade do carbocatião. Estabilidade Relativa dos Carbocatiões Figure mostra deslocalização da carga positiva pelo efeito indutivo electrão atractor da carga positiva do carbono trivalente Adição de H2O ao Alceno Adição de H2O ao alceno chama-se hidratação. A hidratação do alceno catalisada por ácido é regioselectiva: hidrogénio adiciona preferencialmente ao carbono menos substituido da dupla ligação. Portanto H-OH adiciona ao alceno de acordo com a regra de Markovnikov. CH3 CH=CH2 + H2 O Propene CH3 CH3 C=CH2 + H2 O 2-Methylpropene H2 SO4 H2 SO4 OH H CH3 CH-CH2 2-Propanol CH3 CH3 C-CH2 HO H 2-Methyl-2-propanol Passo 1: Transferência de protão para o alceno forma-se um carbocatião. + CH3 CH=CH2 + H O H slow , rate determining + CH3 CHCH3 + O H o A 2 carb ocation intermediate H H Passo 2: Reacção ácido-base de Lewis forma-se um ião oxonium. + CH3 CHCH 3 + O-H fast H CH3 CHCH3 O+ H H An oxonium ion Passo 3: Transferência do protão para o solvente forma o álcool. CH3 CHCH3 + H-O-H + O H H fas t + CH3 CHCH3 + H-O-H O H H Adição de Cl2 e Br2 Decorre com reagentes puros ou em solventes inertes como CH2Cl2. CH3 CH=CHCH3 2-Butene + Br2 CH2 Cl2 Br Br CH3 CH-CHCH3 2,3-D ibromob utan e Adição de Cl2 e Br2 Adição é estereoselectiva. Reacção estereoselectiva: A reacção no qual um estereoisomero é formado ou destruido preferêncialmente em relação aos outros que podem ser formados ou destruidos. Adição ao cicloalceno, por exemplo, dá apenas o produto trans. A reacção ocorre com anti- estereoselectividade. Br + Br2 Cyclohexene CH2 Cl2 Br t rans -1,2-Dibromocyclohexane Adição de Cl2 e Br2 Passo 1: Formação de ião bromonium como intermediário Passo 2: Ião haleto abre o anel de três membros. Adição de Cl2 e Br2 Adição anti-coplanar ao ciclohexeno corresponde à adição transdiaxial. Br + Br2 Br Br trans diaxial (les s stable) Br trans diequatorial (more stable) Rearranjos de Carbocatião Como se tem visto, o produto da adição electrofilica ao alceno envolve a ruptura da ligação pi e formação de duas ligações sigma no seu lugar. Na seguinte adição, contudo sómente 17% do produto esperado é formado. Rearranjo: A reacção no qual o produto(s) têm diferente conectividade dos átomos do que no reagente de partida. Rearranjos de Carbocatião No rearranjos que examinamos, tipicamente o grupo alquilo ou átomo de hidrogénio migra com os seus electrões da ligação do átomo adjacente para o átomo deficiente em electrões como ilustrado pelo mecanismo. O passo chave neste tipo de rearranjos é chamado deslocamento-1,2. Rearranjos de Carbocatião Passo 1: Transferência do protão do HCl para o alceno para dar como intermediário o carbocatião 2°. + + H Cl A 2° carbocation intermediate 3,3-Dimethy-1-butene Cl + Passo 2: Migração do grupo metil com os electrões da ligação, do átomo de carbono adjacente para dar o carbocatião 3º mais estável. The tw o e le ctr ons in this bond m ove to the e le ctr on-de ficie nt carbocation. + A 2° carbocation intermediate + A 3° carbocation intermediate Rearranjos de Carbocatião Passo 3: Reacção do carbocatião 3° (electrófilo e ácido de Lewis) com ião cloreto (nucleófilo e base de Lewis) dá o produto rearranjado. + Cl + A 3° carbocation intermediate Cl Rearranjos de Carbocatião Rearranjos também ocorrrem na hidratação dos alcenos catalisada por ácido, especialmente onde o carbocatião formado pode rearranjar formando um carbocatião mais estável. Th is H mi grates to an adjacen t carbon CH3 H3O+ CH3 CHCH= CH2 + H2 O 3-Meth yl-1-bu te n e CH3 CH3 CCH2 CH 3 OH 2-Meth yl-2-bu tan ol Carbocatiões - Sumário O carbono com carga positiva tem hibridação sp2 com ângulos de ligação de cerca de 120°. A ordem de estabilidade é 3°>2°>1°. Carbocatiões são estabilizados por efeito indutivo electrão-atractor na carga positiva. Metil e carbocatião primário são muito instáveis pelo que nunca são formados em solução. Carbocatiões podem sofrer rearranjos por deslocamento-1,2, quando o carbocatião é mais estável que o carbocatião original. O padrão mais observado vai do 2° para 3°. Carbocatiões-Sumário Carbocatiões intermediários sofrem 3 tipos de reacções: 1. Rearranjos por deslocamento-1,2 para formar um carbocatião mais estável. 2. Adição do nucleófilo (ex: ião haleto, H2O). 3. Perda do protão para dar uma alceno (o reverso do 1º passo em hidrohalogenação e hidratação do alceno por catálise ácida). Hidroboração-Oxidação O resultado da hidroboração seguida de oxidação do alceno é a hidratação da dupla ligação carbono-carbono. 1 . BH3 OH 1-Hexene 2 . NaOH, H2 O2 1-Hexanol Porque -H adiciona ao carbono mais substituido da dupla ligação e OH adiciona ao carbono menos substituido, referimo-nos à regioquímica da hidroboração/oxidação como hidratação antiMarkovnikov. Hidroboração-Oxidação Hidroboração é a adição do BH3 ao alceno para formar o trialquilborano. H H B H CH2 =CH2 CH3 CH2 Boran e CH3 CH2 H B CH2 =CH2 H Ethylborane (an alkylborane) CH2 CH3 CH2 =CH2 B H CH3 CH2 D iethylboran e (a dialkylborane) CH2 CH3 B CH2 CH3 Trieth ylborane (a trialkylborane) Borano é comumente usado como solução de BH3 em tetrahidrofurano (THF). + B2 H6 T etrahydrofuran (T HF) 2 + O BH3 •• O •• •• 2 BH3 •THF Hidroboração-Oxidação Hidroboração é regioselectiva e syn estereoselectiva. Regioselectividade: -H adiciona ao carbono mais substituido e o boro adiciona ao carbono menos substituido da dupla ligação. Estereoselectividade: Boro e -H adiciona à mesma face da dupla ligação (syn estereoselectividade). CH3 + BH3 1-Met hylcyclopentene CH3 H BR2 + CH3 H BR2 H H (Syn addit ion of BH3) (R = 2-m et hylcyclopentyl) Hidroboração-Oxidação Químicos justificam a regioselectividade propondo a formação de um estado de transição com 4 átomos. E a syn estereoselectividade por factores estereos. Boro, a parte maior do reagente, adiciona ao carbono menos substituido e o hidrogénio ao carbono mais substituido. H B H CH3 CH2 CH2 CH=CH2 B CH3 CH2 CH2 CH-CH2 Hidroboração-Oxidação Trialquilboranos são raramente isolados. Tratamento com peróxido de hidrogénio alcalino (H2O2/NaOH), oxida o trialquilborano a álcool e borato de sódio. (RO) 3 B A trialkylborate + 3NaOH 3ROH + Na3 BO3 Sodium borate Ozonólise de um alceno Ozonólise de um alceno quebra a dupla ligação carbono-carbono e forma dois grupos carbonilo (C=O) em seu lugar. Ozonólise é uma das poucas reacções orgânicas que quebra a dupla ligação carbono-carbono. CH3 CH3 C=CHCH2 CH3 2-Methyl-2-penten e 1 . O3 2 . ( CH3 ) 2 S O O O CH3 CCH3 + HCCH2 CH3 + CH3 -S-CH 3 Propanone Propanal Dimethylsu lfoxide (a ketone) (an ald ehyd e) (D MSO) Ozonólise de um alceno Ozono (18 electrões de valência) é fortemente electrofilico O O O O O O O O O O O O Ozone is st rongly electrophilic because of the positive formal charges on the t wo end oxygens. Reacção inicial forma-se um intermediário chamado a molozonide. O O O O O O O O O A m olozonide Ozonólise de um alceno O intermediário molozonide rearranja a ozonide. O tratamento do ozonide com dimetilsulfide origina os produtos finais. CH3 CH=CHCH3 2-Butene O3 O O O CH3 CH-CHCH3 A mol ozo nid e H H3 C H O C C O O CH3 A n o zoni de (CH3 ) 2 S O 2 CH3 CH A cetal dehy de Redução de Alcenos Alcenos reagem com H2 na presença do catalisador que é um metal de transição para dar um alcanos. Os catalisadores mais usados são Pd, Pt, e Ni. A reacção é chamada redução catalitica ou hidrogenação catalitica. + H2 C ycloh e xen e Pd 25°C , 3 atm C ycloh e xan e Redução de Alcenos O padrão mais comum é a adição syn dos hidrogénios; ambos os hidrogénios adiciona à mesma face da dupla ligação. Redução catalitica é syn estereoselectiva. CH3 + H2 CH3 1,2-D imeth ylcycloh exene Pt CH3 CH3 cis-1,2-D imeth ylcyclohexane Redução Catalitica dos alcenos Figura mostra adição Syn do H2 ao alceno envolvendo catalisador que é metal de transição. (a) H2 e o alceno são adsorvidos ao catalisador. (b) Um H é transferido formando uma nova ligação C-H. (c) Um segundo H é transferido. O alcano é desadsorvido. Calor de Hidrogenação Tabela mostra o calor de hidrogenação de vários alcenos Calor de Hidrogenação Redução envolve a conversão de uma ligação pi para uma ligação sigma. Quanto maior o grau de substituição da dupla ligação, mais baixo é o calor de hidrogenação. Maior grau de substituição, mais estável é a dupla ligação. O calor de hidrogenação do alceno trans é mais baixo que o isómero cis. O alceno trans é mais estável que o isómero cis. A diferença é devido à tensão da interacção não ligante no alceno. Calor de Hidrogenação Figure mostra calor de hidrogenação do cis-2-butene e trans-2- butene. trans-2-butene é mais estável que o cis-2-butene por 1.0 kcal/mol Acidez dos alcinos terminais O tratamento do 1-alcino com uma base muito forte como amida de sódio, NaNH2, converte o alcino a anião acetilido. H-C C-H + NH2 Acet ylene Sodium pKa 25 Amide (St ronger (St ronger acid) base) H-C C:- + NH3 Aceylide anion (Weaker base) Ke q = 1013 Ammonia pKa 38 (Weaker acid) O ião hidróxido não é suficientemente base para formar o anião acetilido. H-C C-H + OH pKa 25 (Weaker (Weaker base) acid) H-C C:- + H–OH pKa 15.7 (St ronger (St ronger base) acid) Aniões acetilidos na síntese O anião acetilido é uma base forte e um nucleófilo. Pode doar um par de electrões ao carbono nucleófilo e formar uma ligação carbono-carbono. H-C C:- + H + H C Cl H nucleophilic subst it ution H-C C CH3 + Cl Neste exemplo, o electrófilo é carga parcial positiva do carbono do clorometano. Forma-se uma nova ligação carbono-carbono e a ligação carbono-halogénio é quebrada. Porque o grupo alquilo é adicionada ao alcino original e a reacção chama-se alquilação. Aniões acetilidos na síntese A importância da alquilação com aniões acetilidos é que pode ser usada para criar estruturas carbonadas maiores. 1. NaNH 2 CH 3CH 2C CH HC CH 2. CH3CH 2Br Ace tyle ne 1-Butyne 3. NaNH 2 4. CH3CH 2CH 2Br CH 3CH 2C CCH 2CH 2CH 3 3-H eptyne Hidratação de alcinos catalisada por ácidos Em ácido sulfúrico concentrado e sais de Hg(II) os alcinos sofrem hidratação de acordo com a regra de Markovnikov. O produto inicial é um enol, um composto que contém um grupo hidroxi ligado a uma dupla ligação carbono-carbono. O enol é um equilibrio com a forma ceto. Este equilibrio é chamado o tautomerismo ceto-enólico. CH3 C CH + H2 O Propyne H2 SO4 HgSO4 OH CH3 C=CH2 Propen-2-ol (an enol) O CH3 CCH3 Propanone (Acetone) Redução de alcinos Tratamento do alcino com H2 na presença de um metal de transição catalisador resulta na adição de duas moles de H2 e a conversão do alcino a alcano. CH3 C CCH3 + 2H2 Pd , Pt, or Ni 3 atm 2-Butyne CH3 CH2 CH2 CH3 Butane Escolhendo o catalisador adequado é possivel parar a reacção com adição de uma mole de H2. O catalisador mais utilizado com este proposito é o catalisador de Lindlar. H 3C C C CH 2CH 3 2-Pen tyne H2 Lindlar caalys H 3C CH 2-CH 3 H H cis -2-Pentene Redução de alcinos Redução usando o catalisador Lindlar é syn estereoselectiva. Redução de um alcino usando uma metal em solução alcalina, como Li, Na, ou K em amónia liquida é anti estereoselectiva forma- se o alceno trans. H 3C C C CH2 CH 3 2-Pe ntyne Li NH 3(l) H 3C H H CH2 CH 3 trans-2-Pe nene FIM
Baixar