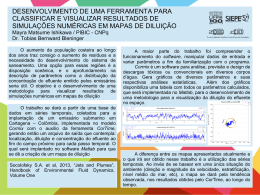
pH da solução e a diluição do ácido Intro 01 02 Introdução Quanto você acha que o pH de uma solução pode variar se diluirmos essa solução 10X? Veja como o pH varia de acordo com a concentração da solução neste experimento. Cadastrada por Leandro Fantini Material - onde encontrar em laboratórios e lojas especializadas Material - quanto custa entre 10 e 25 reais Tempo de apresentação até 10 minutos Dificuldade intermediário Materiais Necessários * * * * * * * * Segurança requer cuidados básicos pHmetro; Três béqueres de 50,00mL; Um béquer de 250,00mL; Uma piceta com água destilada; Uma proveta de 5,00mL; Dois balões de 50,00mL; Água destilada; Papel absorvente. pHmetro Vidrarias e reagentes pH da solução e a diluição do ácido Intro 01 02 Passo 1 Mãos à obra Não é o objetivo principal desse experimento demonstrar como se manuseia o pHmetro, até porque existem vários modelos de pHmetro no mercado e cada um com características próprias. Mas caso você não tenha familiaridade com este aparelho, consulte o manual ou peça ajuda a uma pessoa habilitada a operá-lo. Inicialmente estávamos com uma solução de ácido clorídrico (HCl) de concentração 0,1mol/L. Fizemos a medição do pH dessa solução e logo após retiramos uma alíquota. Diluímos a solução 10 vezes e procedemos a leitura novamente. Mais uma vez retiramos outra alíquota da solução já diluída de 10 vezes e tornamos a diluí-la de 10 vezes e procedemos a leitura do pH novamente. Para estas diluições nós retiramos 5,0mL da solução e transferimos para um balão volumétrico de 50,00mL e completamos o volume com água destilada, como mostra o vídeo que está no próximo passo. Fazendo a diluição de 10 vezes pHmetro funcionando pH da solução e a diluição do ácido Intro 01 02 Passo 2 O que acontece O pH é uma medida da concentração hidrogeniônica, (quantidade de H+) que se aplica em quase todas as soluções aquosas do dia-a-dia. Por exemplo, pode-se determinar o pH de refrigerantes, produtos de limpeza, da água de uma piscina, vinagre, remédios e tantos outros. O pH é uma escala que varia de 0 a 14, sendo que valores < 7 são classificados com ácidos, > 7 bases ( Hidróxidos ) ou alcalinos, e solução que possuem pH = 7 são neutras. Para se determinar o pH de uma solução, faz-se necessário determinar a concentração do íon H+ presente na amostra. De maneira simplificada pode-se trabalhar com a seguinte equação: pH = - log[H+] ou [H+] = 10-pH Inicialmente, usamos uma solução de HCl 0,1 mol/L. Como HCl(aq) --> H+(aq) + Cl-(aq), a concentração de H+ também será de 0,1 mol/L. Se pegarmos esta concentração e aplicarmos na equação acima teremos: pH pH pH pH = = = = - log 0,1 - log 10-1 - (-1) 1 , exatamente como observamos no início do experimento. Na segunda parte eu fiz uma diluição de 10 vezes. [H+] = 0,1/10 = 0,01 ou 10-2, mai uma vez se aplicarmos esse valor na equação teremos: pH = - log 10-2 pH = - (-2) pH = 2 Por isso, a cada diluição de 10 X na solução, o pH variou de uma unidade, passando de 1 para 2 por exemplo. Portanto se uma solução apresenta pH 1 e outra pH 3, a diferença de concentração entre elas será da ordem de 100 vezes.
Baixar