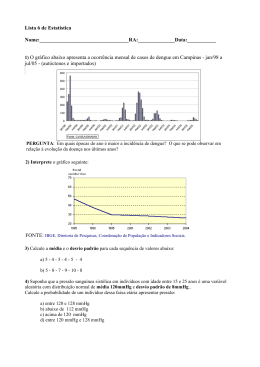
Professor: Murilo Lopes QUÍMICA: 2º ANO CÁLCULOS QUÍMICOS Email: [email protected] 1.Introdução O conhecimento dos gases e de suas propriedades é de grande importância na química, uma vez que os gases estão sempre presentes em nosso dia-a-dia. De fato, o ar que respiramos é indispensável à nossa vida, como também à vida dos animais e vegetais (vivemos imersos na atmosfera terrestre). Vários elementos químicos importantes estão presentes em substâncias gasosas, em condições ambientes: H2, N2, O2, F2, Cl2 e os gases nobres. Muitos compostos químicos importantes também são gasosos: CO2, CO, NO, NO2, N2O, NH3, SO2, H2S, HCl, CH4 etc. 2.O Estado Gasoso Os gases possuem massa. Os gases sempre tendem a ocupar todo o volume do recipiente que os contém (grande expansibilidade); Os gases são menos densos do que os sólidos e os líquidos (isto é, em igualdade de massa, ocupam um volume muito maior); Os gases sempre se misturam entre si (grande difusibilidade); Os volumes dos gases variam com a pressão e com a temperatura. Quando estudamos um gás, devemos considerar as seguintes grandezas fundamentais: a massa, o volume, a pressão e a temperatura. As influências da pressão e da temperatura são tão grandes que realmente só tem sentido mencionarmos o volume de um gás fornecendo também sua pressão e sua temperatura. 3.Pressão dos Gases A pressão dos gases é também medida em milímetros de mercúrio, unidade que resulta de uma experiência clássica de Torricelli: quando um tubo completamente cheio de mercúrio é emborcado num recipiente que também contenha mercúrio, a altura h em que o mercúrio “estaciona” depende exclusivamente da pressão do ar atmosférico. Esse aparelho, denominado barômetro de mercúrio, serve para medir a pressão atmosférica. Se a experiência de Torricelli for feita ao nível do mar, a altura h será 76 cmHg (centímetros de mercúrio), ou 760 mmHg (milímetros de mercúrio), ou 760 torr (Torricelli), ou, ainda, 1 atm (atmosfera). 1 atm = 76 cmHg = 760 mmHg = 760 torr 1 mmHg = 1 torr 2 1 atm = 101.325 Pa (ou N/m ) 2 1 mmHg = 133,322 Pa (ou N/m ) Aula 1 ESTUDO DOS GASES 5.Lei de Boyle-Mariotte Em uma transformação isotérmica, provoca-se a variação do volume e da pressão de determinado gás, porém mantém-se a temperatura constante; daí a origem do nome isotérmico (do grego: iso = igual;thermo = calor). Desse modo, chegamos à conclusão: P1.V1 = P2.V2 6. Lei de Gay-Lussac Em uma transformação isobárica, provoca-se a variação da temperatura e do volume de determinado gás, porém mantém-se a pressão constante; daí a origem do nome isobárico (do grego: iso = igual;bárico = pressão). Desse modo, conclusão:V1/T1=V2/T2. chegamos à 7.Lei de Charles Em uma transformação isovolumétrica, provoca-se a variação da temperatura e da pressão de determinado gás, porém mantém-se o volume constante; daí a origem do nome isovolumétrico (do grego: iso = igual;volumétrica = volume). Desse modo, chegamos à conclusão: P1./T1=P2/T2 4.A Temperatura dos Gases No Brasil, a escala usual é a escala Celsius (ºC), que é uma escala centesimal; nos EUA, por exemplo, é usada a escala Fahrenheit (ºF). Em trabalhos científicos, todavia, usa-se a escala absoluta ou Kelvin (K), pois ela traz grandes simplificações nas leis e fórmulas em geral e é adotada pelo SI (sistema internacional). Tk = Tc + 273 Fale com o Coordenador de Química: [email protected] 1 Professor: Murilo Lopes QUÍMICA: 2º ANO CÁLCULOS QUÍMICOS Aula 1 Email: [email protected] 8.Equação de Claperyon A equação desenvolvida por Émile Clapeyron relaciona as três variáveis de estado (pressão, volume e temperatura) com a quantidade de partículas (número de mols) que compõe um gás. A relação que ficou conhecida como A Equação de Clapeyron ou Equação de um gás ideal se dá da seguinte forma: P.V=N.R.T R: constante universal dos gases perfeitos. Seu valor depende das unidades utilizadas para medir as variáveis de estado, podendo ser: ESTUDO DOS GASES variação do volume, a temperatura do pneu, em ºC, ao final da viagem, era: a)660ºC b)57ºC c)330ºC d)272ºC e)26,7ºC 7ª)(F.M. Pouso Alegre-MG) Um gás ocupa um volume de 200mL a uma pressão de 380 mmHg a uma temperatura de 27ºC. Seu volume nas condições normais de temperatura e pressão será: a)91,0 b)910,00 c)0,911 d)0,099 e)0,009 8ª)(Mackenzie-SP) Dada volume obtido de NH3 a mesmas condições de volumétrica da reação é coeficientes da equação. a equação: N2 + 3H2 → 2NH3, qual o partir de 25 L de N2, supondo ambos nas pressão e temperatura, se a proporção 1:3:2, pois coincide com a proporção dos a)10L b)20L c)30L d)40L e)50L p: pressão V: volume T: temperatura n: número de mols O número de mols (n) do gás é dado pela razão entre a massa do gás (m) e sua massa molar (M): 9ª)Dada a equação: 2Cl2O5 → 2Cl2 + 5O2, qual o volume de O2 obtido a partir de 12L de Cl2O5, ambos a P e T constantes, tendo como proporção volumétrica igual a 2:2:5. a)10L b)20L c)30L d)40L e)50L 10ª)(UFMG) Qual o volume ocupado por 19g de flúor (F2) a 27ºC e 1,64 atm? Dado massa molar F=19. a)2 litros b)2,7 litros c)7,9 litros d)7,5 litros e)9,2 litros 11ª)(FEI-SP) Qual é a temperatura de um gás em ºC, sabendo-se que 2,5 mols desse gás ocupam o volume de 50L à pressão de 1.246 mmHg na referida temperatura? Dado R= 62,3. . EXERCÍCIOS a)127ºC b)128ºC c)227ºC d)347ºC e)398ºC a)313 K b)213 K c)413 K d)913 K e)113 K 12ª)(FMLT-MG) 8,2 litros de um gás estão submetidos a uma pressão de 5 atm, e do mesmo utilizou-se 0,8 mol. Considerando R= 0,082, qual é a sua temperatura em ºC? 2ª)Qual é a temperatura Kelvin correspondente a 222ºC? a)256ºC b)625ºC c)352ºC d)845ºC e)532ºC a)490 K b)485 K c)495 K d)444 K e)478 K 13ª)(UFRN) Uma amostra de uma substância pesando 0,8g desloca 0,03L de ar, medidos a 27ºC e pressão aproximadamente igual a 0,94 mmHg. Determine a massa molecular da substância? (dado= 0,082) 1ª)Qual é a temperatura Kelvin correspondente a 40ºC? 3ª)(UERJ) Vinte litros de gás hidrogênio foram medidos a 27ºC e 700 mmHg de pressão. Qual será o novo volume do gás, a 87ºC e 600 mmHg de pressão? a)20L b)25L c)29L d)28L e)23L 4ª)(EEM-SP) De um estado inicial de 4L e 300 K, um gás perfeito é submetido a uma expansão isobárica até duplicar seu volume. Tendo a pressão constante, calcule a temperatura do gás durante a compressão isotérmica? a)700 K b)600 K c)800 K d)750 K e)500 K 5ª)(UFPE) Reduza às condições normais de pressão e temperatura 38 L de cloro, que foram medidos a 127ºC e à pressão de 720 mmHg, a 273 K e 760 mmHg de pressão, qual o volume ocupado? a)68u. b)67u. c)66u. d)69u. e)61u. 14ª)(UFPA) Qual é o número de moléculas existentes em 5,6L de um gás qualquer, medido nas condições normais de temperatura e pressão? Dado = 6x1023. a)1,5x10 23 b)1,6x10 23 c)1,9x10 25 d)1,8x10 24 e)1,2x10 23 16ª)(Fuvest-SP) Dois recipientes contêm, respectivamente, 0,5 mol de metano e 1,5 mol de monóxido de carbono. Sabendo-se que esses gases estão submetidos à mesma temperatura e pressão (constantes). Se o volume do metano é 9L, qual é o volume do monóxido de carbono? a)21L b)23L c)48L d)39L e)27L a)24,57 L b)35,4 L c)28,7 L d)98,3 L e)12,23L 6ª)(F.M. Pouso Alegre-MG) Ao sair de viagem, o motorista calibrou os pneus de seu veículo colocando no seu interior 2atm de pressão, num dia quente (27ºC). Ao chegar ao destino, mediu novamente a pressão dos pneus e encontrou 2,2 atm. Considerando-se desprezível a 17ª)(Unb-DF) Dois recipientes de mesmo volume estão abertos e possuem, respectivamente, 2,5 atm e 4 atm. Se a temperatura do primeiro recipiente for de 47ºC, qual é a temperatura do segundo recipiente em ºC? a)232ºC b)239ºC c)287ºC d)264ºC e)212ºC Fale com o Coordenador de Química: [email protected] 2 Professor: Murilo Lopes QUÍMICA: 2º ANO CÁLCULOS QUÍMICOS Email: [email protected] Fale com o Coordenador de Química: [email protected] Aula 1 ESTUDO DOS GASES 3
Download