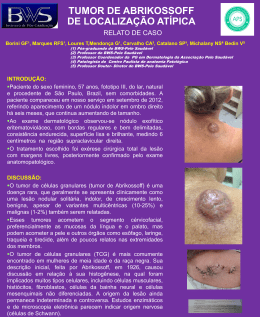
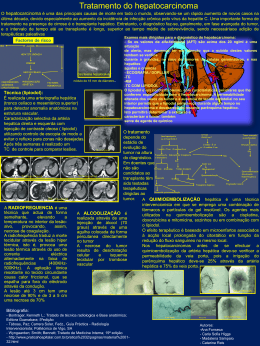
KAREN CORREA BARRACAR TUMOR VENÉREO TRANSMISSÍVEL EM CÃES LONDRINA 2011 KAREN CORREA BARRACAR TUMOR VENÉREO TRANSMISSÍVEL EM CÃES Trabalho apresentado para o cumprimento de atividades referentes ao Módulo 07 do curso de Especialização Lato sensu em Clínica Médica e Cirúrgica em Pequenos Animais - UCB LONDRINA 2011 TUMOR VENÉREO TRANSMISSÍVEL EM CÃES Elaborado por Karen Correa Barracar Aluna do curso de Clínica Médica e Cirúrgica de Pequenos Animais da UCB Foi analisado e aprovado com grau: ................. Londrina, _____ de________________ de _______. ______________________________ Membro ______________________________ Membro ______________________________ Professor Orientador Presidente Londrina, dez.2011 SUMÁRIO 1. Introdução..........................................................................................................4 2. Revisão de Literatura.......................................................................................5 2.1. Etiologia......................................................................................................5 2.2. Diagnóstico.................................................................................................5 2.2.1. Histórico do Animal..................................................................................6 2.2.2. Exame Clínico.........................................................................................6 2.2.3. Diagnóstico Citológico.............................................................................7 2.2.4. Diagnóstico histopatológico.....................................................................7 2.2.5. Diagnóstico Diferencial............................................................................8 2.3. Tratamento.................................................................................................8 2.3.1. Ciclofosfamida.........................................................................................9 2.3.2. Metotrexato............................................................................................10 2.3.3. Sulfato de Vincristina.............................................................................10 2.3.4. Vimblastina............................................................................................11 2.3.5. Doxorrubicina........................................................................................11 2.3.6. Prednisona............................................................................................12 2.3.7. Ivermectina............................................................................................12 3. Alterações Hematológicas ..............................................................................14 4. Conclusões......................................................................................................15 Referências Bibliográficas....................................................................................16 4 TUMOR VENÉREO TRANSMISSÍVEL EM CÃES 1 – INTRODUÇÃO O Tumor Venéreo Transmissível (T.V.T.) é uma neoplasia de células redondas relatada pela primeira vez por Huzzard em 1820, mas foi Sticker, em 1904, quem descreveu de forma detalhada essa neoplasia. É conhecido também por condiloma canino, granuloma venéreo, sarcoma infeccioso e tumor de Sticker (SILVA et al., 2007). O (T.V.T.) é encontrado em todo o mundo e mais comumente nos países de climas temperados e em áreas com grandes populações de cães errantes (ETTINGER et al., 1997). O contágio entre os cães ocorre, tanto na fêmea como no macho, pela implantação de células tumorais viáveis nas membranas mucosas durante o coito, por arranhaduras, lambeduras, mordeduras ou pelo ato de cheirar um animal portador (VARACHIN et al., 2001). O crescimento da massa ocorre geralmente entre de 2 e 6 meses após o acasalamento ( DAS.,DAS, 2000). Afeta comumente a genitália externa de cães (MAC EWEN, 2001); mas há relatos de (T.V.T.) extragenital, acometendo pele, cavidade bucal e nasal, órgãos como fígado, baço, globo ocular, mesmo na ausência de lesões genitais (HIGGINS, 1966). De acordo com as características celulares, uma nova nomenclatura para o (T.V.T.) tem sido proposta, onde esses tumores são classificados em três tipos: (T.V.T.) linfocitóide, (T.V.T.) plasmocitóide e (T.V.T.) misto (AMARAL et al., 2004; BASSANI-SILVA, 2005; GASPAR, 2005). Os tumores plasmocitóides são os mais malignos, que ocasionam maiores injúrias e os mais resistentes aos tratamentos (BASSANI - SILVA, 2005; GASPAR, 2005). 5 Diante do exposto trabalho, o objetivo foi abordar as principais características envolvidas no TVT canino. 2 – REVISÃO DE LITERATURA 2.1 – Etiologia A origem do (T.V.T.) é incerta, apesar dos muitos estudos realizados a fim de elucidá-la. Em um desses estudos foi demonstrado que células do (T.V.T.) expressam antígenos que apenas tumores de células redondas de origem histiocíticas expressam, reforçando a idéia da origem histiocítica do (T.V.T.) (MOZOZ, et al.,1996). Em outro estudo no qual se utilizou microscopia eletrônica, foram encontradas estruturas semelhantes a partículas virais no (T.V.T.) (AMBER ET al., 1985). Adams e colaboradores (1968) relataram que um retrovírus do tipo C pode estar associado a este tumor. 2.2 – Diagnóstico O diagnóstico é baseado no histórico do animal, exame clínico, exame citológico ou biópsia para exame histopatológico – sendo esse o meio mais confiável de diagnóstico (DAS; DAS, 2000). Caso ainda haja dúvida, poderá ser 6 realizada a análise de cromossomos, além de técnicas de imuno-histoquímica que empregam anticorpos (VARASCHIN, 2001). O (T.V.T.) pode ser identificado pela lisozima e alfa-1-antitripsina (A.A.T), os quais foram expressos por 40% e 56% respectivamente em 25 cães estudados (MOZOZ et al., 1996). 2.2.1– Histórico do Animal O histórico descrito pelo proprietário, como presença de secreção sanguinolenta vaginal ou peniana, e o aspecto macroscópico da lesão, placas friáveis com aspecto de couve-flor, são sugestivos de (T.V.T.) (FLORES et al., 1993). 2.2.2 – Exame Clínico Os (T.V.Ts.) podem ser solitários ou múltiplos e são massas friáveis, hemorrágicas e semelhantes a couves-flores, necróticas ou traumatizadas (PETERSON, J.L et al., 2003). Os sinais clínicos variam de acordo com a localização do tumor. Cães acometidos pela forma clássica do (T.V.T.) apresentam lambedura da genitália externa, descarga vaginal/prepucial sanguinolenta e/ou com presença de pus quando há contaminação bacteriana. Há crescimento de massa tumoral na região e em casos extremos pode haver retenção urinária (VARASCHIN, et al., 2001). Os cães acometidos pelo (T.V.T.) de forma cutânea apresentam o 7 crescimento de nódulos que podem ou não estarem ulcerados, muitas vezes associados a exsudato purulento e miíases (MOUTINHO.,1995). Quando há comprometimento nasal pode haver epistaxe, descarga nasal serosa, espirro e respiração com a boca aberta além de aumento de volume no local onde a massa se encontra. Nesses casos há relato de propagação até a região do palato (GINEL et al., 1995). 2.2.3 – Diagnóstico Citológico Microscopicamente o (T.V.T.) apresenta células grandes, de formato redondo a poliédrico, com citoplasma claro e presença de vacúolos; o núcleo é grande, basofílico e central (WHITE, 1991). Entre essas células são observadas fibras reticulares, entretanto não há evidência de que sejam produzidas pelas células do (T.V.T.). Outra característica é a presença de numerosas figuras de mitose (SANTOS et al., 2005). 2.2.4 – Diagnóstico Histopatológico O (T.V.T.) também pode ser diagnosticado através de exame histopatológico, após biópsia incisional (WILLARD et al., 1989). É encontrado tecido necrótico com núcleo picnótico, cariorrexia e cariólise. Células arredondadas infiltrativas, com destruição de tecidos. Pode-se encontrar 8 um processo de neovascularização com crescimento difuso infiltrante (GOMEZ, N. et al.,1994). 2.2.5 – Diagnóstico Diferencial Linfomas Cutâneos e Carcinoma Espinocelular (GOMEZ,N et al.,1994). 2.3 – Tratamento Existem vários protocolos de tratamento para o (T.V.T.). A excisão cirúrgica é efetiva em alguns animais nos quais a ressecção total é possível. No entanto, a freqüência da recorrência após uma cirurgia e a dificuldade na obtenção de uma excisão completa em algumas localizações torna a cirurgia uma má opção em muitos casos. A cirurgia não é útil no caso de (T.V.T.) metastático. A radiação é efetiva, e pode ser usada como meio de tratamento único ou como adjuvante a cirurgia. A maioria dos cães mostra uma resposta total após dose única. A quimioterapia é o tratamento de escolha no caso de (T.V.T.) múltiplos ou metastáticos e também pode ser usada como um tratamento de primeira linha para tumores locais solitários. Ambos os protocolos com agentes únicos ou com multiagentes são efetivos (PETERSON, J.L et al., 2003). 9 A quimioterapia foi relatada com os agentes ciclofosfamida, metotrexato, vincristina, vimblastina e doxorrubicina (BOSCOS, 1988). Associações destes quimioterápicos foram testadas, como exemplo, ciclofosfamida e prednisona (HERNANDEZ-JAUREGUI, 1974), vimblastina com ciclofosfamida ou metotrexato (THEILEN e MADEWEE, 1987) , vincristina e doxorrubicina (CALVERT et al..,1982) e vincristina e ivermectina (GERVAZONI et al., 2007). A terapia mais eficaz e praticada na rotina clínica consiste no uso do sulfato de vincristina como agente único (HARMELIN et al., 1995, ANDRADE, 2008). A cura completa é esperada em mais de 90% dos cães tratados com sulfato de vincristina na dose de 0,5-0,7mg/m² por via endovenosa uma vez por semana durante 4 a 6 semanas (LIPPONEN, 1993). Entretanto, devido à extensa utilização desse fármaco para o tratamento do (T.V.T.), aliada à existência de neoplasias com características malignas, notou-se um aumento no número de aplicações. Além disso, ocorre atualmente aumento de resistência cruzada com a doxorrubicina (ANDRADE, 2008). 2.3.1 – Ciclofosfamida A ciclofosfamida, fármaco de ciclo celular não específico, é um agente alquilante derivado da mostarda nitrogenada que atua incorporando um grupamento alquila ao DNA, impedindo sua síntese e divisão (CHUN et al., 2001). Os efeitos tóxicos incluem leucopenia, êmese, diarréia e anorexia, que podem ser encontradas frequentemente devido à ação citostática inespecífica da ciclofosfamida, com efeitos também sobre outras células em constante divisão, como as células das mucosas esofágica, gástrica e intestinal (CHUN et al., 2001, RODASKI & DE NARDI, 2007). Cistite hemorrágica pode ocorrer devido à irritação da mucosa vesical provocada pela acroleína, um metabólito da ciclofosfamida (RODASKI & DE NARDI, 2007). A dose recomendada da 10 ciclofosfamida é de 50mg/m², (V.O), em dias alternados, durante 4 semanas (ANDRADE, S.F., 2002). 2.3.2 – Metotrexato É um análogo do ácido fólico. É bem absorvido pelo trato gastrintestinal e distribuído por todos os tecidos, exceto S.N.C. Sua excreção renal ocorre por filtração glomerular e secreção ativa. É administrado por via oral, intravenosa e intramuscular. O ácido folínico pode reverter os efeitos adversos do metotrexato. A dose recomendada é de 2,5 mg/m², V.O, ou I.V, diariamente (ANDRADE, S.F.,2002). 2.3.3 – Sulfato de Vincristina O Sulfato de Vincristina é amplamente utilizado na medicina como agente único ou combinados a outros quimioterápicos (ADAMS, 2003). É metabolizado pelo fígado, eliminado por excreção biliar nas fezes e administrado estritamente por via endovenosa, sendo que seu extravasamento acarreta em necrose acentuada da área atingida pelo quimioterápico (ADAMS, 2003). Causa mielossupressão de grau leve, neuropatia periférica, parestesia e anorexia (ENEROTH et al.,2001; ANDRADE, 2008). O sulfato de vincristina utiliza como substrato a P-glicoproteína, por isso deve-se evitar a administração da mesma em cães da raça Collie, pois é 11 verificada má-formação desta glicoproteína por mutação genética do gene MDR1, o que impede sua metabolização de forma adequeda, podendo acarretar em intoxicação de grau severo (neuropatia periférica, mielossupressão leve, parestesia, náuseas e anorexia) (ANDRADE, 2008). 2.3.4 – Vimblastina É um alcalóide derivado da vinca. Não é absorvida pelo trato gastrintestinal. É administrada por via intravenosa e seu extravasamento pode provocar graves danos teciduais. É metabolizada pelo fígado e a excreção dos produtos de decomposição é feita pela bile. Causa mielossupressão em grau leve, neuropatia periférica, parestesia e anorexia. A dose recomendada é de 2 mg/m², I.V, semanalmente ou a cada 2 semanas (ANDRADE S.F., 2002). 2.3.5 – Doxorrubicina A doxorrubicina destrói o D.N.A celular e previne replicação. Não é absorvida pelo trato gastrintestinal. É amplamente distribuída por todos os tecidos, exceto S.N.C e é metabolizada pelo fígado. É excretada pela bile e fezes. Pode provocar reações de hipersensibilidade (urticária), por isso pode ser fazer um pré-tratamento com corticosteróides e anti-histamínicos. A dose recomendada é de 30mg/m², I.V, 1 vez por semana de 4 a 6 semanas (ANDRADE, S.F.,2002). 12 2.3.6 – Prednisona A prednisona é um dos hormônios esteroidais mais utilizados em protocolos antineoplásicos. Apesar desta frequência, seu mecanismo de ação como agente antineoplásico é pouco conhecido, porém relatos afirmam que esse fármaco se combina a receptores citoplasmáticos, inibindo a síntese de D.N.A (CHUN et al., 2001, RODASKI & DE NARDI, 2007). A toxicidade do fármaco consiste no hipercortisolismo onde observam-se frequentemente sinais como poliúria, polidipsia, polifagia, hepatomegalia, queda de pelos, perda de massa muscular e ulceração gástrica (THAMM et al., 1999, CHUN et al., 2001). A dose recomendada de prednisona é de 0,5 mg/kg, V.O, ao dia, durante 4 semanas (ANDRADE, S.F., 2002). 2.3.7 – Ivermectina A ivermectina pertence ao grupo das lactonas macrocíclicas, as quais são divididas em dois grupos: avermectinas (por exemplo, doramectina e ivermectina) e as milbemicinas (por exemplo, moxidectina). Possuem potente ação anti-helmíntica e parasiticida (EDWARDS, 2003). A partir da fermentação, são obtidas 4 entidades diferentes, conhecidas como A1, A2, B1 e B2, sendo o componente B1 o mais ativo contra nematóides e de onde se origina a ivermectina que é comercializada (BARRAGRY, 1987). 13 Funcionam como agonistas do GABA (ácido gama-aminobutírico), neurotransmissor de sinais inibitórios para neurônios motores. A função do GABA é abrir os canais de cloro na junção pós-sináptica, permitindo o influxo desses íons, induzindo o repouso da célula. Na presença da ivermectina, os canais de cloro permanecem abertos quando já deveriam estar fechados, então, apesar do neurônio motor e as células musculares serem capazes de reagirem a impulsos nervosos, a passagem elétrica através da sinapse está bloqueada. Para os parasitas essa estimulação prolongada do GABA resulta em paralisia e morte (BARRAGRY, 1987). Assim sendo, naqueles parasitas onde o GABA não atua como neurotransmissor, a ivermectina não apresenta atividade, por exemplo, em cestódeos e trematódeos (CAMPBELL, 1983). Mesmo utilizando o GABA, os mamíferos não são afetados pela ivermectina e a explicação para isso seria pelo grande tamanho e peso da molécula que encontraria dificuldade em ultrapassar a barreira hematoencefálica, pois em um estudo verificou-se que a concentração de ivermectina em encéfalo de bovino foi menor do que a concentração em todos os outros órgãos do corpo (BARRAGRY, 1987). Entretanto, sabe-se que cães da raça Collie apresentam neurotoxicidade á ivermectina, podendo ser fatal (ANDRADE, 2008). Isto ocorre porque esses cães apresentam mutação no gene MDR1, que é o gene responsável pela produção de P-glicoproteínas, desta maneira ocorre produção de P-glicoproteínas defeituosas que provocam diminuição da excreção de drogas que utilizam a mesma como substrato (DRINYAEV 2004; MEALEY, 2004). Estudos mostram que a ivermectina, além de apresentar propriedade inseticida e anti-helmíntica, é um potente inibidor da P-glicoproteína e consequentemente inibe a resistência a múltiplas drogas (DIDIER e LOOF, 1996; POULIOT et al., 1997; KORYSTOV et al., 2004; GRIFFIN et al., 2005) até nove vezes mais do que os atuais inibidores, ciclosporina A e verapamil (POULIOT et al., 1997). Korystov et al (2004) constataram, porém, que a eficácia da inibição a múltiplas drogas depende do tipo de células tumorais e do substrato (quimioterápico) que o carreador transporta. 14 Ainda em um estudo utilizando-se ratos (infectados experimentalmente com Ehrlich carcinoma, P388 linfoleucemia, carcinoma 755 e melanoma B 16) foi observado que nos animais nos quais diferentes avermectinas eram administradas posteriormente ao quimioterápico, houve uma supressão do crescimento tumoral de até 70-80% (DRINYAEV, 2004). Gervazoni et al. (2007) estudaram as alterações clínicas e hematológicas induzidas pelo uso associado de vincristina e ivermectina comparado ao uso isolado da vincristina no tratamento de tumor venéreo transmissível em cães e constataram que no grupo de cães que receberam somente vincristina ocorreram 5,3±2,1 aplicações do protocolo (mínimo de 4 máximo de 9 aplicações), enquanto no grupo que recebeu vincristina associado à ivermectina ocorreram 3,9±2,1 (mínimo de 2 e máximo de 8 aplicações). Segundo os autores, clinicamente o achado foi relevante, pois diminui os custos do tratamento e a probabilidade de resistência à vincristina. Além disso, não houve alterações significativas apesar de não ser estatisticamente significativa a redução do número de nos parâmetros físicos e hematológicos, o que demonstrou uma segurança terapêutica no protocolo combinado (GERVAZONI , E. R et al., 2007). 3 – ALTERAÇÕES HEMATOLÓGICAS Faro et al. (2008) estudaram as alterações hematológicas de cães submetidos ao tratamento quimioterápico com sulfato de vincristina, prednisona e ciclofosfamida. Os achados obtidos no experimento para contagem eritrocitária expressaram diminuição constante do número de hemácias para valores abaixo daqueles de referência (JAIN, 1993). No entanto, resultados diferentes foram encontrados por Camacho & Laus (1987), Camacho & Santana (1992) e Santana (2000) cujos trabalhos não demonstraram a ocorrência de alterações significativas. Em ensaio experimental, 15 Santana (2000) verificou não haver alteração significativa entre os valores médios eritrocitários tanto para seus precursores (medular) quanto para o eritrograma (periférico). Segundo o autor não houve diferença significativa entre os valores médios das características do eritrograma em cães portadores de (T.V.T.) tratados com vincristina (0,025mg/kg de peso corpóreo), semanalmente, durante quatro semanas. Pelo fato dos protocolos do experimento de Faro, A.M et al., (2008) serem associações de fármacos (poliquimioterapia), é possível considerar que a ciclofosfamida, um citostático potente, possa ter acentuado o declínio da curva eritrocitária devido a mielossupressão relatada por CHABNER & LONGO (2001). A trombocitopenia é comumente causada pelos efeitos da maioria dos agentes quimioterápicos, sendo as plaquetas a segunda linha de diminuição hematológica, pois possui vida média de 5 a 7 dias (RODASKI & DE NARDI, 2007). Sobreira (1999) refere indução de trombocitopenia pela vincristina. No experimento de Faro et al., (2008) houve diminuição significativa nas contagens globais de leucócitos, como referido por Camacho & Laus (1987), Daleck (1986), Padilha Filho et al. (1988), O´Keefe & Harrys (1990), Camacho & Santana (1992) e Dinesh (1993), na utilização da vincristina. Uma diminuição foi observada em neutrófilos segmentados, bastonetes, linfócitos e monócitos, semelhante aos encontrados por Daleck et al (1986), Camacho & Laus (1987) e Padilha Filho et al (1988). A possibilidade de ocorrência de leucopenia secundária a administração de quimioterapia antineoplásica representa um fator limitante da terapia antiblástica, em virtude disto, recomenda-se o monitoramento laboratorial semanal de todos os animais que estiverem em tratamento (FARO A. M et al, 2008). 4 – CONCLUSÕES 16 Devido à elevada incidência do (T.V.T.) canino, se faz importante a realização desta revisão, que reúne parte dos aspectos desta patologia, facilitando e auxiliando os interessados a ampliar os conhecimentos sobre o tumor venéreo transmissível canino, visto que seu estudo ainda apresenta muitas interrogações e algumas controvérsias. O Tumor Venéreo Transmissível (T.V.T.), apesar de ser uma neoplasia maligna, possui tratamento e cura. Acomete cães de qualquer raça, que são sexualmente ativos. Sua disseminação se dá através de contato sexual e contato com superfícies contaminadas, manifestando-se pela presença de tumor em forma de couve-flor na região vaginal ou peniana, e às vezes, em regiões extra-genitais, sendo o tratamento mais eficaz até o momento, a quimioterapia com o uso de sulfato de vincristina e associações. REFERÊNCIAS BILBIOGRÁFICAS ADAMS, H. R. Farmacologia e terapêutica em veterinária. 8 ed. Rio de Janeiro: Guanabara Koogan, 2003. AMARAL, A.S., GASPAR L.F.J., SILVA S.B. & ROCHA N.S. 2004. Diagnóstico citológico do tumor venéreo transmissível na região de Botucatu, Brasil (estudo descritivo: 1994-2003). Revista Portuguesa de Ciências Veterinárias. 99 (551): 167-171. AMBER, E. I., ISITOR, G.N., ADEYANJU, J.B1985. Viral-like particles associated with naturally occurring transmissible veneral tumor in two dogs: preliminary report. American Journal of Veterinary Research 46, 2613-2615. 17 ANDRADE, S. M. F. Terapêutica Antineoplásica. In: ANDRADE, S. M. F. Manual de terapêutica veterinária. 2. ed. São Paulo: Roca, 2002. ANDRADE, S. M. F. Antineoplásicos. In: ANDRADE, S. M. F. Manual de terapêutica veterinária. 3. ed. São Paulo: Roca, 2008. BARRAGRY, T. B. A review of the pharmacology and clinical uses of ivermectin. Canadian Veterinary Journal, Ghelp, v. 28, n. 8, p. 512-517, ago. 1987. BASSANI-SILVA, S. 2005. Efeito da própolis sobre a agressividade do tumor venéreo transmissível canino: ensaios in vitro. (Masters dissertation, Faculdade de Medicina Veterinária e Zootecnia, Universidade Estadual Paulista, Botucatu, Brasil). BOSCOS, C. Transmissible venereal tumours in the dog – clinical observations and treatment. Animalis Familiaris, v.2, n.3, p.10-5, 1988. CALVERT, C. A; LEIFER, C . E.; MAC EWEN E. G. Vincristine for treatment of canine transmissible veneral tumor in the dog. Journal of the American Veterinary Medical Association, Ithaca, v. 181, n. 2, p. 163-164, jul. 1982. CAMACHO, A. A., LAUS, J. L. Estudo sobre a eficiência da vincristina no tratamento de cães com tumor venéreo transmissível. Ars Veterinária, v.3,n.1, p.37-42, 1987. CAMACHO, A. A., SANTANA, A. E. Alterações da medula óssea e do sangue periférico de cães induzidas pela vincristina. Ciência Veterinária, v.6, n.2, p.1-11, 1992. CAMPBELL, W. C. et al. Ivermectin: a potent new antiparasitic agent. Science, Washington, v. 221, n. 4613, p. 823-828, ago.1983. CHABNER, B. A., LONGO, D. L. Principles of Chomotherapy. In: ___. Cancer chemotherapy & biotherapy: principles & practices. 3rh ed. Philadelphia: Lippincott Williams & Wilkins, 2001. p. 58-82. 18 CHUN, R., GARRET, L., MACEWEN, E. G. Cancer Chemotherapy. In: WITHROW, S. J., MACEWEN, E. G. Small animal clinical oncology. 3rd ed. Philadelphia: W. B. Saunders, 2001. p.92-113. DALECK, C. L. M. Emprego do sulfato de vincristina no tratamento do tumor venéreo transmissível canino. Belo Horizonte. 1986. 53p. Dissertação (Mestrado). Universidade Federal de Minas Gerais, Belo Horizonte. DAS, U., DAS, A.K. 2000. Rewiew of canine transmissible veneral sarcoma. Veterinary Research Communications 24, 545-556. DIDIER, A.; LOOF, F. The abamectin derivative ivermectin is a potent Pglycoprotein inhibitor. Anticancer drugs, Londres, v. 7, n. 7, p. 745-751, set. 1996. DINESH, N. M. Effect of vincristina sulphate on canine transmissible veneral tumors – haematological and biochemical studies. Indian Veterinary Journal, v.70, n.8, p.741-44, 1993. DRINYAEV, V. A. et al. Antitumor effect of avermectins. European Journal of Pharmacology, Amsterdã, v. 501, n. 1-3, p. 19-23, out. 2004. EDWARDS, G. Ivermectin: does P-glycoprotein play a role in neurotoxicity? Filaria Journal, Londres, v. 2, (Suppl. 1), p. S8, 2003. ENEROTH, A. et al. Evaluation of a vincristine resistant Caco-2 cell line for use in a calcein AM extrusion screening assay for P-glycoprotein interaction. European Journal of Pharmacology Science, Amsterdã, v. 12, n. 3, p. 205214, jan. 2001. 19 ETTINGER, S.J.; FELDMAN, E.C. Tratado de medicina interna veterinária. 4ed. São Paulo: Manole, 1997, cap. 131, p.2347. FARO, A. M. ET al. Avaliação hematológica em cães submetidos ao tratamento quimioterápico com sulfato de vincristina, prednisona e ciclofosfamida – estudo experimental, 1., 2008, Jaboticabal. Ars Veterinária, v. 24, n. 1, 001008, 2008. FLORES, P.E.; DIEZ, Y.X.; DIAZ, R.A.M.;URCELAY, V.S.; CATTANEO, U.G. Comparison of the neoplasms recorded in two periods (1981-1985 and 1986- 1988) at the surgery section of the Faculty of Veterinary Medicine, Chile Avances-en-Ciencias-Veterinarias University of , v.8, n.1, p.61-65, 1993. GASPAR, L. F. J. 2005. Caracterização citomorfológica do tumor venéreo transmissível canino correlacionada com danos citogenéticos, taxa de proliferação e resposta clínica à quimioterapia. (PhD thesis, Faculdade de Medicina Veterinária e Zootecnia, Universidade Estadual Paulista, Botucatu, Brasil). GERVAZONI, E. R. et al. Estudo de um novo protocolo de tratamento do tumor venéreo transmissível em cães. In: ENCONTRO ANUAL DE PESQUISA INSTITUCIONAL E INICIAÇÃO CIENTÍFICA, 12., 2007, Presidente Prudente. Anais... Presidente Prudente, Unoeste, 2007. p. 81. GINEL, P. J., MOLLEDA, J. M., NOVALES, M., MARTIN, E., MARGARITO,J.M., LÓPEZ, R. 1995. Primary transmissible venereal tumor in the nasal cavity of a dog. The Veterinary Record 136, 222-223. GOMEZ, N.; DUCHENE, A.; DAY, R. B.; VARTABEDIAN, A. Tumor venéreo transmissible. Selecciones Veterinarias, v.2, n.6, p.374-9, 1994. GRIFFIN, J. et al. Selamectin is a potente substrate and inhibitor of human and canine P-glycoprotein. Journal of Veterinary Pharmacology, Oxford, v. 28, n. 3, p. 257-265, jun. 2005. HARMELIN, A.; ZUCKERMAN, A.; NYSKA, A. Correlation of Ag-NOR protein measurements with prognosis in canine transmissible venereal tumors. Journal of Comparative Pathology, Liverpool, v. 112, n. 4, p. 429-433, maio 1995. 20 HERNANDEZ-JAUREGUI. Effect of a combination of cyclofosdamide and prednisolone on canine transmissible veneral tumor in dog. Veterinaria, Madrid, v. 5, n. 1, p. 3-9, jan. 1974. HIGGINS, D.A. Observations on the canine transmissible venereal tumors as see in the Bahamas. Veterinary Rec., v. 79, p. 67-71, 1996 JAIN, N. C. Essentrals of veterinary hematology. Philadelphia: Lea & Febiger, 1993. 417p. KORYSTOV, Y. N. et al. Avermectins inhibit multidrug resistance of tumor cells. European Journal of Pharmacology, Amsterdã, v. 493, n. 1-3, p. 57 - 64, jun. 2004. LIPPONEN, P. Image analysis of Ag-NOR proteins in transitional cell bladder cancer. Journal of Pathology, Londres, v. 171, n. 4, p. 279-283, dez. 1993. MAC EWEN, E. G. Transmissible veneral tumor. In: WITHROW S. J.; MAC EWEN, E. G. Small Animal Clinical Oncology. Phyladelphia: saunders, 2001. P. 651-655. MEALEY, K. L. Therapeutic implications of the MDR-1 gene. Journal of Veterinary Pharmacology and Therapeutics, Oxford, v. 27, n. 5, p. 257-264, out. 2004. MOUTINHO, F. Q. ET AL. Tumor venéreo transmissível com metástases cutâneas em um cão. Ciência Rural, Santa Maria, v. 25, n.3, p. 469-471, jul. 1995. MOZOZ, E., MENDEZ, A., GOMEZ-VILLAMANDOS, J.C., MARTIN DE LAS MULAS, J.,PÉREZ, J. 1996. Immunohistochemical characterization of canine transmissible veneral tumor. Veterinary Pathology 33, 133-147. 21 O’KEEFE, D. A., HARRIS, C. L. Toxicology of oncologic drugs. veterinary clinics of north america: small animal practice. v. 20, n.2, p. 483-504, 1990. PADILHA FILHO, J. G. et al. Estudos das alterações reprodutivas e outros efeitos colaterais após o tratamento com sulfato de vincristina em cães. Ars Veterinária, v.4, n.1, p.25-31, 1988. PETERSON, J. L.; COUTO, C. G. Tumores cutâneos e subcutâneos. In: BIRCHARD, S. J.; SHERDING, R. G. Manual saunders clínica de pequenis animais. 2 ed. São Paulo: Roca, 2003, cap. 28, p.224. POULIOT, J. F. et al. Reversal of P-glycoprotein associated multidrug resistance by ivermectin. Biochemical Pharmacology, Oxford, v. 53, n. 1, p. 17-25, jan. 1997. RODASKI, S., DE NARDI, A. B. Modalidades de quimioterapia. IN: RODASKI, S.; NARDI, A. B. D. Quimioterapia antineoplásica em cães e gatos, São Paulo: Medvet Livros, 2007. 307p. SANTANA, A. E. Efeitos hematotóxicos de dois diferentes níveis de dosagens de sulfato de vincristina (oncovin®) em cães (Canis familiaris, Linnaeus, 1758). 2000. f. 106. Tese (Livre-Docência em Patologia Clínica Veterinária25) – Faculdade de Ciências Agrárias e Veterinárias, Universidade Estadual Paulista, Jaboticabal, 2000. SANTOS, F. G. A. et al. O tumor venéreo transmissível canino – aspectos gerais e abordagens moleculares (revisão de literatura). Journal of Bioscience, Uberlândia, v. 21, n. 3, p. 41-53, set/dez. 2005. SILVA, M. C. V., BARBOSA, R. R., SANTOS, R. C., CHAGAS, S. N., COSTA, W. P. 2007. Avaliação epidemiológica, diagnóstica e terapêutica do tumor venéreo transmissível (TVT) na população canina atendida no hospital veterinário da UFERSA 1, Acta Veterinaria Brasílica, 28-32. SOBREIRA, M. F. R. Estudo das alterações hematológicas e das provas funcionais hepática e renal em cães (Cannis familiaris) sadios expostos ao sulfato de vincristina (Oncovin®). 1999, f.113. Dissertação (Mestrado em Patologia Animal) – Faculdade de Ciências Agrárias e Veterinárias, Universidade Estadual Paulista, Jaboticabal. 22 THAMM D. H., MAULDIN E. A., VAIL D. M. Prednisone and vinblastine chemotherapy for canine mast cell tumor – 41 cases (1992-1997). Journal of Veterinary Internal Medicine, v.13, n.5, p. 491-497, 1999. THEILEN, G. H.; MADEWELL, B. R. Veterinary cancer medicine. 2. Ed. Philadelphia: Lea e Febiger, 1987. VARACHIN, S. V.; WOUTERS, F. BERNIS, V. M. O. SOARES, T. M. P.; TOKURA, V. N.; DIA M. P. L. L. Clínica Veterinária, n° 32, p.32-37, 2001. WHITE, R. A. Manual of Small Animal Oncology. Cheltenahm: British small animal Veterinary Association, 1991. WILLARD, M.D.; TVEDTEN,H.; TURNWALD, G.H. Small Animal Clinical Diagnosis by Laboratory Methods, Philadelphia, W.B. Saunders, 1989, 380 p.
Baixar