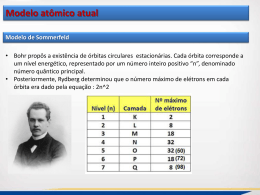
21/11/2012 Modelo Atômico DEMÓCRITO Modelo Atômico Aula de Física Moderna Modelo Atômico O universo tem uma constituição elementar única que é o átomo, partícula invisível, indivisível, impenetrável e animada de movimento próprio. As vibrações dos átomos provocam todas as nossas sensações. Modelo Atômico DALTON (Século XIX) O átomo é como uma pequena esfera, com massa definida e propriedades características. São as menores partículas que constituem a matéria; são indivisíveis e indestrutíveis, e não podem ser transformados em outros. As transformações químicas ocorrem por separação e união de átomos. . THOMPSON (1897) Descobriu a existência dos elétrons e propôs o modelo conhecido como pudim de passas, onde os elétrons ficam distribuídos dentro de uma massa com carga positiva, tornando-a neutra. Modelo Atômico Modelo Atômico RUTHERFORD BOHR Estudando o espalhamento de partículas em uma placa metálica, verificou a existência de um núcleo com carga positiva e partículas negativas no seu entorno (eletrosfera). Por que os elétrons não colapsam, já que são atraídos pela carga positiva do núcleo? O espalhamento por cargas positivas verificava um diâmetro menor que o dar carga positivas. Os átomos só podem ocupar níveis de energia bem definidos (quantizados), cada órbita possui um nível de energia diferente. Ao trocar de órbita o elétron precisa absorver ou emitir energia para trocar de órbita. Por que os elétrons não colapsam, já que são atraídos pela carga positiva do núcleo? 1 21/11/2012 Princípio de Incerteza de Heisenberg Pelo principio da incerteza, não é possível considerarmos órbitas para os elétrons, dando início ao conceito de orbitais, que são os locais com maior probabilidade de se encontrar um elétron. px . x ≥ h/2 onde h=h/2π A razão dessa incerteza não é um problema do aparato utilizado nas medidas das grandezas físicas, mas sim a própria natureza da matéria e da luz. 2 21/11/2012 Modelo Atômico Modelo Atômico Pela mecânica Quântica, podemos calcular a probabilidade de encontrar um elétron em um determinado local. número quântico principal Referente a distância do elétron ao núcleo Para descrever os níveis de energia de um átomo utilizamos 4 números quânticos: •número quântico principal •número quântico de momento angular ou azimutal ou secundário •número quântico magnético •número quântico de spin Modelo Atômico número quântico de momento angular ou secundário Modelo Atômico número quântico magnético Representa a orientação permitida para a nuvem de elétrons Modelo Atômico número quântico de spin Spin é o movimento de rotação do elétron em torno do seu eixo. Comprimento de Onda de De Broglie 1924 - Louis de Broglie em sua tese de doutorado levantou a hipótese de que se uma onda eletromagnética pode se comportar como partícula, uma partícula também pode apresentar comportamento ondulatório. Equação de de Broglie para o comprimento de onda relativo ao elétron: λ = h/p, onde λ é o comprimento de onda do elétron , h é aconstante de Planck e p o momento do elétron. 3 21/11/2012 Comprimento de Onda de De Broglie Comprimento de Onda de De Broglie Equação de de Broglie para o comprimento de onda relativo ao elétron: λ = h/p, onde λ é o comprimento de onda do elétron , h a constante de Planck e p o momento do elétron. Vamos calcular o comprimento de onda de de Broglie relativo a uma partícula de poeira, com10-6 g se deslocando com uma velocidade de 10-6 m/s. Usando h= 6.63 X 10-34 J.s (joule vezes segundo), então: Equação de de Broglie para o comprimento de onda relativo ao elétron: λ = h/p, onde λ é o comprimento de onda do elétron , h a constante de Planck e p o momento do elétron. Vamos calcular o comprimento de onda de de Broglie relativo a uma partícula de poeira, com10-6 g se deslocando com uma velocidade de 10-6 m/s. Usando h= 6.63 X 10-34 J.s (joule vezes segundo), então: 6.63 X 10-34 J.s/(10-9 kg)( 10-6 m/s)= λ= 6,63 X 10-19m. O diâmetro de um núcleo é da ordem de 10-15m 4
Baixar