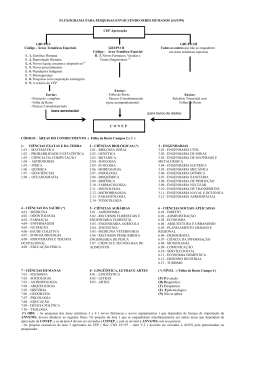
CORINA BONTEMPO DUCA DE FREITAS Número de Projetos apreciados na CONEP 600 500 400 300 200 100 0 nº projetos % aumento em relação ao ano anterior 1997 1998 1999 Fluxograma para Pesquisas Envolvendo Seres Humanos CEP APROVAÇÃO Grupo I Código - Áreas Temáticas Especiais I.1. Genética Humana I.2. Reprodução Humana I.4. Novos Equi., insumos e dispositivos I.5. Novos procedimentos I.6. Populações Indígenas I.7. Biossegurança I.8. Pesquisas com cooperação estrangeira I.9. A critério do CEP Enviar : - Protocolo completo - Folha de Rosto - Parecer Consubstanciado (para apreciação) Grupo II Código - Área Temática Especial II.3. Novos Fármacos, Vacinas e Testes Diagnósticos Grupo III Todos os outros que não se enquadrem em áreas temáticas especiais Enviar: - Folha de Rosto - Parecer Consubstanciado (para acompanhamento) Enviar: Relatório Trimestral com Folhas de Rosto (para banco de dados) CONEP Tabela III Percentual de Projetos (grupo I) em relação ao total apreciados no CEP - 1999 INSTITUIÇÃO TOTAL DOS GRUPO I % PROJETOS UNIFESP 676 37 5,5 UCFMRP/USP 268 23 8,6 HUCFF/UFRJ 184 45 24,5 ISCMPA/RS 85 24 28,2 FIOCRUZ 51 9 17,6 PUC/RS ( * ) 187 21 11,2 HCPA 413 23 5,6 UNESP/Botucatu 204 7 3,4 Tabela V Classificação dos projetos por área temática ( * ) - 1999 Área Temática Nº de Projetos na área % Genética humana 40 7,8 Reprodução humana 25 4,9 Novos equipamentos/dispositivos 10 2,0 Novos procedimentos 17 3,3 População indígena 8 1,6 Biossegurança 7 1,4 400 78,3 4 0,8 Cooperação estrangeira Critério do CEP (*) Menos os devolvidos, juntados e incompletos. Incluídos os projetos classificados em mais de uma área ( 39 ). As áreas não são mutuamente exclusivas. FONTE : CONEP Classificação dos projetos no 1º Parecer - 1999 1º parecer aprovado c/recomendação 13% 1º parecer não aprovado 1% 1º parecer aprovado 27% 1º parecer pendente 59% Total dos projetos com Parecer - 463 Total dos Projetos no Período - 559 Fonte: CONEP Tabela VII Pareceres pendentes – nº de motivos por parecer – 1999 Nº MOTIVOS % 1 7 2-5 131 60,9% 6-9 68 31,6% 9 4,2% 10 ou + TOTAL FONTE : CONEP PARECERES PENDENTES Número 215 3,3% 100,0% Tabela VIII Projetos de cooperação estrangeira Pareceres pendentes segundo os motivos e referências da Res. CNS 196/96 – 1999 MOTIVOS Número % - Protocolo incompleto ( VI,1 a 5 ) 184 88,9% - TCLE inadequado ( IV, 1 a 3 ) 36 65,7% - Falta intervenção para melhor cuidado do sujeito (III.1.b e c, III.3.p ) 60 29,0% - Nº de sujeitos não definido ( VI.3.a ) 43 20,8% - Falta relação de centros envolvidos ( VI.2.h ) 26 12,6% - Acesso à continuidade do tratamento não assegurado ( III.3.p ) 20 9,7% - Informação incompleta de fases anteriores ( pré-clínica ou clínica ) ( VI.2.b ) 24 11,6% - Cláusula restritiva de publicação ( VI.2.m e IX.2.f ) 13 6,3% - Período de wash-out ou uso de placebo sem análise crítica de risco ( III.3.f) 11 5,3% - Orçamento inadequado ( VI.2.j ) 10 4,8% - Falta análise de risco / benefício ( III.1.b) 11 5,3% - Uso de material biológico para outros fins ( III.3.t ) 10 4,8% - Outros motivos 95 Total de Protocolos c/ 1º parecer pendente ( Os motivos não são mutuamente excludentes FONTE : CONEP ) 207 45,9% Tabela IX Projetos de cooperação estrangeira Pareceres pendentes por documentação incompleta, segundo o tipo de documento – 1999 MOTIVOS Número % - Aprovação no país de origem 128 70,0% - Orçamento 101 54,9% - Folha de rosto ausente ou incompleta 81 44,0% - Declaração uso exclusivo do material 58 31,5% - Currículo do pesquisador 51 27,7% - Declaração de tornar públicos os resultados 38 20,6% - Brochura do pesquisador 19 10,3% - Termo de Consentimento 5 2,7% - Documento de aprovação do CEP 4 2,2% - Outros 3 1,6% 184 100,0% Total de projetos com documentação incompleta FONTE : CONEP Deficiência nos TCLE Deficiências Número % Ausência de nome/endereço do pesquisador 70 51,5 Linguagem pouco acessível 35 25,7 Informações de risco incompletas 26 19,1 Indenização por danos inadequada 20 14.7 Versão final não apresentada 19 14,0 Incompleto 11 8.1 Tabela XI Projeto por Tempo de Tramitação Entre 01/01/1999 e 31/12/1999 Faixas Até 30 dias Período de Aprovação no CEP Nº % Período entre CEP e CONEP Nº % Período p/1º Período de Período de Resposta Parecer CONEP Aprovação CONEP à pendência Nº % Nº % Nº % 182 47,5 191 46,0 321 66,7 136 41,9 24 14,6 89 23,2 111 26,8 131 27,1 58 17,8 54 36,4 Mais de 60dias 112 29,3 113 27,2 29 6,2 126 40,3 72 49,0 Sub Total 383 100,0 415 100,0 483 100,0 325 100,0 151 100,0 Período Inválido 177 31,6 145 25,8 79 14,1 240 42,8 141 48,4 Entre 31 e 60 dias FONTE : CONEP Verifica-se que o processo necessita ser aprimorado em todos os níveis, especialmente quanto a: os pesquisadores e patrocinadores devem preparar o protocolo de acordo com os requisitos das resoluções; os CEP não podem receber projetos incompletos, cumprindo e fazendo cumprir as normas; as instituições devem investir nos CEP, viabilizando sua funcionalidade: recursos humanos e materiais. A CONEP deve concentrar esforços no desenvolvimento de sistema como um todo, mediante: 1. Criação de uma rede de informação via internet, com as vantagens de: universalizar o registro de pesquisas em seres humanos; diminuir o tempo de tramitação e controlar o cumprimento de prazos; disponibilizar os dados básicos das pesquisas de áreas temáticas especiais para escolha (por critérios de risco ou aleatoriamente) de alguns protocolos a serem apreciados; disponibilizar informações imediatas sobre situação e andamento de projetos para os interessados; 2. Desenvolvimento de sistemas de supervisão e auditoria dos CEP, com critérios de validação ou suspensão de registro; 3. Incremento de atividades de capacitação dos CEP; 4. Continuidade na elaboração e divulgação de normas específicas e diretrizes para melhor julgamento dos CEP. A ANVS acompanha o envio e recebimento de produtos para e do exterior (medicamentos, vacinas e testes diagnósticos e equipamentos e dispositivos para a saúde), emitindo autorização - LI e RE, além de autorização de envio e recebimento de materiais biológicos de pesquisas. A ANVS deve dar suporte de órgão fiscalizador em caso de risco à saúde do cidadão, por meio de acompanhamento de eventos adversos e iatrogenias, além de intervenções eventuais para apreensão de produtos sob pesquisa em situações irregulares ou outras ações necessárias.
Baixar