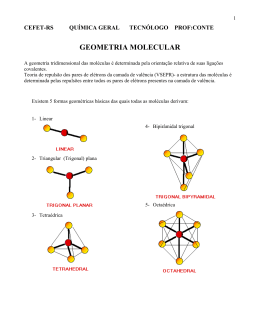
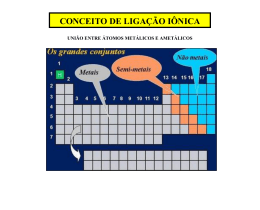
Capítulo 4 – Exercícios adicionais Compostos iônicos 1. Qual é a fórmula do composto formado entre o magnésio (Z = 12) e o iodo (Z = 53)? 2. Sabendo-se que a fórmula do sulfeto de alumínio é Aℓ2S3, quantos elétrons são previstos para as camadas de valência dos átomos de alumínio e de enxofre? 3. Por que certos compostos iônicos não têm o mesmo número de coordenação? 4. Explique por que o LiF possui a ligação iônica mais forte dentre os haletos alcalinos (Li, Na, K, Rb, Cs). Considere fatores tais como os raios iônicos e a energia de dissociação do composto produzindo átomos, e não íons. 5. Considere as propriedades: brilho metálico; elevado ponto de fusão; boa condutividade elétrica no estado sólido; e boa condutividade elétrica em solução aquosa. Quais dessas propriedades são características de compostos iônicos? 6. Qual é a influência da constante dielétrica de um solvente na solubilidade de um composto iônico? Compostos covalentes 7. Observe as seguintes fórmulas eletrônicas (estruturas de Lewis): Consulte a classificação periódica dos elementos e escreva as fórmulas eletrônicas das moléculas formadas pelos seguintes elementos: a) Fósforo e hidrogênio. b) Enxofre e hidrogênio. c) Flúor e carbono. 8. O radical NO2 tem 17 elétrons de valência e é angular, enquanto o CO2 tem 16 elétrons de valência e é linear. Qual é a diferença de suas ligações? Desenhe uma estrutura de Lewis para o NO2+ com as mesmas ligações que o CO2. 9. Escreva as estruturas de Lewis para as seguintes moléculas ou íons e dê o número de elétrons em torno do átomo central: a) IF7. b) CℓF3. c) BrF2+. 10. Escreva as estruturas de Lewis que contribuem para o híbrido de ressonância do SO2. 2007 Pearson Education do Brasil — Química geral 11. Qual é a forma geométrica da molécula PF5? Quantos ângulos diferentes F-P-F existem nessa molécula? Quais são os valores esperados para os ângulos F-P-F? 12. Utilizando as estruturas de Lewis e a teoria VSEPR, preveja a forma geométrica de cada uma das seguintes espécies: a) Tetracloreto de enxofre. b) Tricloreto de iodo. c) IF4-. d) Trióxido de xenônio. 13. Qual das moléculas a seguir deve possuir maior momento de dipolo elétrico permanente no estado gasoso? a) CCℓ4. b) C6Br6. c) CO2. d) H2O. 14. Considere os momentos de dipolo elétrico (µ) das seguintes espécies no estado gasoso: O3, CO2, Cℓ2 e Br2O. Pensando na geometria dessas moléculas e na eletronegatividade dos átomos envolvidos, coloque em ordem crescente os dipolos de cada molécula. 15. Dentre as moléculas H2S, CO2, PCℓ3, BCℓ3, Br2 e CF4, quais são polares? 16. Considerando as espécies químicas a seguir, qual o tipo de ligação e de interação intermolecular mais importante (quando for covalente) existente em cada uma? a) LiF. b) HF. c) F2. d) CF4. e) CH4. 17. Sobre a temperatura de ebulição de um líquido, verifique se as afirmações a seguir são verdadeiras (V) ou falsas (F): I. Aumenta com o aumento da força da ligação química intramolecular. II. Aumenta com o aumento da força da ligação química intermolecular. III. Aumenta com o aumento da pressão exercida sobre o líquido. IV. Aumenta com o aumento da quantidade de líquido. 18. Explique os pontos de ebulição (em ºC) dos fluoretos dos elementos do terceiro período: NaF 988 MgF2 1.266 AℓF3 1.291 SiF4 -90 PF5 -94 SF6 -50 19. Considere uma amostra de um sólido branco. Descreva algumas experiências simples que poderiam ser utilizadas a fim de ajudar a decidir se o tipo de ligação existente na amostra é fundamentalmente iônica, covalente ou devido a forças de van der Waals. 2007 Pearson Education do Brasil — Química geral Ligações metálicas 20. Identifique os tipos de ligações esperadas nos compostos abaixo: a) Água. b) Gás carbônico. c) Alumínio. d) Sal de cozinha. e) Aço. 21. Qual o tipo de ligação mais provável que poderia acontecer entre os elementos A (número atômico 12) e B (número atômico 20)? Justifique o tipo de material que eles formariam. 22. No quadro a seguir, indique a ligação química (metálica, covalente ou iônica) de cada substância: Propriedades Solubilidade em água Solubilidade em gasolina Ponto de fusão (oC) Condutividade elétrica no estado sólido Condutividade da solução quando dissolvida A Solúvel Insolúvel 880 Não conduz Conduz Substância B Insolúvel Solúvel 114 Não conduz Não conduz C Insolúvel Insolúvel 600 Conduz -- 23. Denomina-se ‘liga metálica’ uma mistura de elementos cujo componente principal é um metal. Numa liga metálica, os elementos se distribuem ‘ao acaso’, formando células unitárias cristalinas que ficam envolvidas por elétrons parcialmente livres. Uma liga metálica importante é o aço comum. O aço inoxidável pode ser obtido misturando-se 74% de aço comum, 18% de crômio e 8% de níquel. Indique três vantagens do aço inoxidável. 24. Na tabela abaixo, temos os pontos de fusão (PF) e de ebulição (PE) de vários metais. Qual(is) deles poderia(m) ser fundido(s) utilizando banho-maria? Justifique sua resposta. Metal PF (oC) PE (oC) Mercúrio -39 357 Césio 29 670 Lítio 179 1.336 Magnésio 651 1.107 Ferro 1.540 3.000 Ouro 1.063 2.600 Tungstênio 3.370 5.930 25. Explique a condução do calor pelo cobre (um metal) e pelo vidro (um sólido de cadeia) em função da ocupação dos orbitais de valência e da mobilidade dos elétrons. 2007 Pearson Education do Brasil — Química geral
Baixar