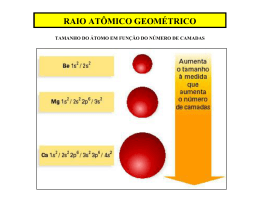
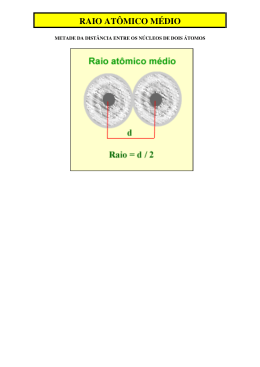
Propriedades Periódicas Propriedades periódicas e a Tabela Periódica dos Elementos Bruno Ramos Junho de 2007 1. Introdução As primeiras versões da tabela periódica foram construídas por Mendeleev e Meyer Sabemos que as propriedades periódicas se devem à estrutura eletrônica dos átomos A estrutura eletrônica explica as periodicidades de: – Tamanho atômico – Energia de Ionização – Afinidade Eletrônica Al Zn Ga Cd In Sn 2. Níveis Eletrônicos Elétrons em níveis sucessivos (n = 1,2,3...) produzem os máximos da densidade eletrônica a distâncias crescentes do núcleo. As camadas completas são denominadas camadas internas. A camada mais externa é chama de camada de valência. Pode incluir subníveis de camadas internas. Exemplo: A camada de valência do os subníveis 4s, 3d, e 4p. 33As inclui 3. Raio Atômico O raio de um átomo é encontrado a partir da distância entre os núcleos de dois átomos. 4. Tendências Acerca do Raio Atômico O tamanho do raio atômico aumenta conforme se desce em um mesmo grupo (coluna). O tamanho diminui no sentido da esquerda para a direita num período (linha). Em um grupo (coluna), o tamanho aumenta devido à constante adição de níveis eletrônicos. 6s Examplo: os metais alcalinos 5s 4s 2s 3s Na Li Cs K Rb 5. Carga Nuclear Efetiva O tamanho de um orbital diminui, conforme se aumenta Zeff sobre os elétrons de valência, o que explica a diminuição dos átomos dos elementos ao longo de um período (linha) 6. Energia de Ionização É a energia necessária para remover um elétron de um átomo no estado fundamental. Exemplo: Hidrogênio H(g) H+(g) + e I = E 0 E = 1312 kJ/mol -RH 1s Pode-se definir energias de várias ionizações. Para o Mg: Mg(g) Mg+(g) + e I1 = 738 kJ Mg+(g) Mg+2(g) + e I2 = 1450 kJ Mg+2(g) Mg+3(g) + e I3 = 7730 kJ 7. Tendências da E.I. A Energia de Ionização aumenta com o aumento de Zeff sobre os elétrons de valência. I1 diminui descendo num grupo da tabela; I1 aumenta da esquerda para a direita num período Os metais alcalinos têm as menores energias de ionização de um período; os gases nobres, as maiores. Arrange os seguintes elementos em ordem crescente de E.I.: C, K, Mg, Na, Ne, Si K < Na < Mg < Si < C < Ne Por que a energia de ionização do N é maior que a do O? O subnível 2p do nitrogênio tem uma energia levemente maior, devido à repulsão eletrônica. 8. Afinidade Eletrônica É a mudança de energia sofrida pelo átomo no estado gasoso ao receber um elétron. Cl(g) + e Cl(g) E = -349 kJ/mol Um E grande e negativo indica forte atração entre o átomo e o elétron adicionado. Um E positivo indica que a adição do elétron é desfavorável. Ne(g) + e Ne(g) E = 40 kJ/mol 9. Metais e Não-Metais Os metais são caracterizados por sua baixa energia de ionização. Os não-metais são caracterizados por sua alta afinidade eletrônica.
Baixar