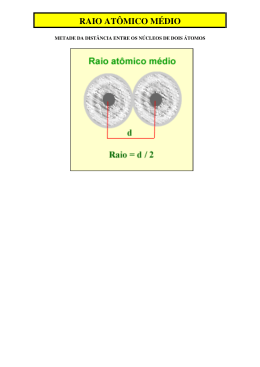
● São características ou tendências que certos elementos químicos podem revelar segundo a sua posição na tabela periódica e ocorrem à medida que o número atômico de um elemento químico aumenta, ou seja, assume valores que crescem e decrescem em cada período da Tabela Periódica. ● Entre elas destacam-se: raio atômico, potencial de ionização, eletronegatividade e afinidade eletrônica. ● É uma característica difícil de ser determinada, pois a eletrosfera de um átomo não tem fronteira definida. ● Devemos levar em conta dois fatores 1) Número de níveis (camadas):quanto maior o número de níveis, maior será o tamanho do átomo. 2) Número de prótons: o átomo que apresenta maior número de prótons exerce uma maior atração sobre seus elétrons ,o que ocasiona uma redução no seu tamanho. ● Nas famílias (coluna vertical): os raios atômicos aumentam de cima para baixo, pois, nesse sentido, aumenta o número de níveis de energia dos átomos ● Nos períodos (linha horizontal): o raio atômico cresce da direita para a esquerda nos períodos. VARIAÇÃO DO RAIO ATÔMICO NA TABELA PERIÓDICA ● É a energia necessária para retirar um elétron de um átomo (ou íon) isolado no estado gasoso. + X e X(g) + energia → (g) + ● Quando retiramos um elétron de um átomo eletricamente neutro (1ª energia de ionização), gasta-se uma certa quantidade de energia, a qual, geralmente, é expressa em elétrons-volt (eV). ● Se formos retirar um segundo elétron (2ª energia de ionização), gasta-se uma quantidade maior de energia, pois, à medida que cada e- é retirado, o raio atômico diminui. ● Variação do raio atômico na tabela periódica. Potencial de Ionização Nas famílias e nos períodos, a energia de ionização aumenta conforme diminui o raio atômico, pois, quanto menor o tamanho do átomo, maior a atração do núcleo pela eletrosfera e, portanto, mais difícil retirar o elétron. + Al(g) + E1 (6,0 e V) → Al (g) + e Al(g) + E2 (18,8 e V) → Al2+(g) + eAl(g) + E3 (28,4 e V) → Al3+(g) + e- ● É a quantidade de energia liberada quando um átomo neutro, isolado no estado gasoso, recebe um elétron. e X X(g) + → (g) + energia ● A eletroafinidade pode ser entendida como a medida da intensidade com que o átomo captura o elétron. ● Nas famílias e nos períodos, a eletroafinidade aumenta com a diminuição do raio atômico, pois, quanto menor o raio, maior a atração exercida pelo núcleo. Eletroafinidade ● É a capacidade que um átomo possui de atrair para si o par de elétrons, compartilhado com outro átomo. ● Nas famílias e nos períodos, a eletronegatividade cresce conforme o elemento apresenta o menor raio atômico, com exceção dos gases nobres, pois a atração do núcleo pela camada de valência será maior. ● Variação do raio atômico na tabela periódica. Eletronegatividade 1) Coloque em ordem crescente de tamanho dos átomos os seguintes elementos pertencentes ao quarto período; Se (Z=34); Br (Z=35);Ca (Z=20);K (Z=19); 1) Coloque em ordem crescente de tamanho dos átomos os seguintes elementos pertencentes ao quarto período; Se (Z=34); Br (Z=35);Ca (Z=20);K (Z=19); Resposta: Br, Se, Ca, Be. 1) (La Salle) A única afirmação correta a respeito da variação de propriedades periódicas considerada sempre no sentido do crescimento do número atômico é: a) a eletronegatividade diminui no período. b) a energia de ionização aumenta no período. c) o raio atômico aumenta no período. d) a afinidade eletrônica aumenta no grupo. e) a eletronegatividade aumenta no grupo. 2) Por que o oxigênio (O) tem maior afinidade eletrônica que o enxofre(S)? 1) (Unesp-SP) A energia liberada quando um elétron é adicionado a um átomo neutro gasoso é chamada de: a) entalpia de formação. b) afinidade eletrônica. c) eletronegatividade. d) energia de ionização. e) energia de ligação. 2) (Ufla-MG) Considere os elementos químicos A, B, C, D e E com a seguinte posição na tabela periódica: A E B C D O elemento que apresenta a primeira energia de ionização mais baixa é: a) A b) B c) C d) D e) E
Download






![Aula 2 Alunos[3] - Webgiz](http://s1.livrozilla.com/store/data/000027982_1-ad9af7faea7b13d548438c95f03a93ee-260x520.png)