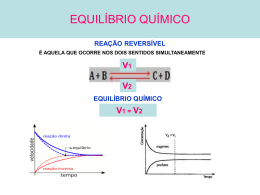
Forças relativas de ácidos e bases A força de um ácido é a medida da facilidade com que este ácido doa prótons. Os ácidos fortes doam prótons com facilidade. Já para as bases, a maior força é relacionada àquela que atrair mais facilmente o próton. Sendo que: Ligação mais fraca à mais fácil sair o próton à ácido forte à base conjugada fraca Também podemos determinar a força de um ácido/base por meio de sua constante de acidez/basicidade, ou seja, quanto maior Ka ou Kb, maior é a concentração de H+ ou OH-, maior é a força. (OBS: o fator P inverte essa relação, ou seja, quanto maior pKa ou pKb, menor é a força do ácido ou base). Principais ácidos fracos: HCN, HNO2, CH3COOH, HCOOC, H2S, H2CO3, HClO e HF. Principais bases fracas: hidróxidos dos metais de transição, aminas e o NH3. • Ácidos polipróticos: são aqueles que possuem mais de um hidrogênio ionizável, sendo que o primeiro próton sai mais facilmente que o segundo. (Quando calculamos o pH, só consideramos a [H+] da 1ª ionização). • Os ametais tem caráter ácido e os metais tem caráter básico. A força deles crescem de acordo com: Você encontra esse resumo no site: http://www.webnotes.com.br/ Estrutura e acidez Ácidos binários: são HX. A ionização depende principalmente de dois fatores: • A entalpia de ligação, ou seja, quanto mais forte a ligação, maior será a entalpia e mais difícil será para quebrar a ligação. • Depende da polarização do H: quanto mais polarizado estiver, maior é a força de atração e mais fácil fica retirar o elétron. Na tabela, podemos relacionar a polarização da molécula com a eletronegatividade: quanto mais eletronegativo, mais polarizado o H estará. Além disso, precisamos perceber o tamanho da molécula: quanto maior a molécula, maior é a distância, menor é a força de atração e é mais fácil retirar o elétron. Obs.: primeiro olhar o tamanho da molécula, se for mais ou menos o mesmo (estão da mesma linha) olhar a eletronegatividade. Ácidos ternários: são HOZ. A ionização está relacionada com o átomo central (Z): Se Z for alcalino ou alcalino-terroso eletropositivo, o composto irá se comportar como base. Se Z for eletronegativo ou estiver num estado de oxidação elevado, o composto irá se comportar como ácido. Para comparar forças desses oxiácidos dividir em dois grupos: • Com átomo central diferente, pertencentes ao mesmo grupo da tabela periódica e com mesmo número de oxidação: quanto mais eletronegativo, mais forte será o ácido. • Com mesmo átomo central: quanto maior a oxidação (número de oxigênios ligado a ele), maior é a força do ácido. Aqui entra aquela regra de subtração. Você encontra esse resumo no site: http://www.webnotes.com.br/ Hidroxicompostos (possui OH na estrutura): Se tiver metal na estrutura, comporta como base, liberando o íon OH-. Se tiver ametal na estrutura, comporta como ácido, liberando o íon H+. Se for um elemento que está na transição, no meio da tabela, será anfótero, ou seja, comporta tanto como base quanto como ácido. Autoionização/autoprotólise da água É uma substância anfótera. É um eletrólito muito fraco, por isso sofre pouca ionização. H2O + H2O à H30+ + OHH2O à H+ + OHProduto iônico da água à Kw = [H+].[OH-] = 10 (-14) (a 25ºC). Quando maior a temperatura, mais Kw, ou seja, se trata de uma reação endotérmica. Escalas de acidez e basicidade pH = - log [H+] pH 0-7 = ácido pH 7 = neutro pH 7-14 = básico pOH = - log [OH-] pOH 0-7 = básico pOH 7 = neutro pOH 7-14 = ácido Ao calcular o pH ou o pOH de soluções muito diluídas, temos que levar em consideração a autoionização da água ([H+] = [OH-] = 10 -7) Indicadores ácido-base Geralmente são ácidos ou bases fracas que são corantes. A cor varia de acordo com o deslocamento do equilíbrio. Usa-se muito a combinação de vários indicadores, pois a zona de viragem deles é diferente, possibilitando uma maior aproximação do pH. Você encontra esse resumo no site: http://www.webnotes.com.br/ Solução tampão São usadas para manter o pH quase constante mesmo com a adição de pequenas quantidades de ácidos ou bases, baseado no princípio de Le Chatelier. São soluções formadas por um ácido/base fraca e um sal derivado desse ácido ou dessa base. São usadas no sangue, em alimentos enlatados e em aquários. [H+] = Ka . Ca / Cs pH = pKa + log Cs/Ca [OH-] = Kb . Cb / Cs pOH = pKb + log Cs/Cb Ca = concentração do ácido Cb = concentração da base Cs = concentração do sal A capacidade de tampão de uma solução é definida como a quantidade de matéria de um ácido forte ou uma base forte necessária para que 1L de solução tampão apresente uma mudança de uma unidade no pH. Hidrólise salina Hidrólise é uma reação com a água. HA + BOH à AB + H2O Direta: neutralização Inversa: hidrólise Somente íons fracos reagem com a água: Ácido fraco à base conjugada forte HA (fraco) à A- (forte) + H+ A- + H2O -> HA + OH- (meio básico) Base fraco à ácido conjugada forte BOH (fraco) à OH - + B+ (forte) B+ + H2O à BOH + H+ (meio ácido) Você encontra esse resumo no site: http://www.webnotes.com.br/ a) Hidrólise do ânion Sal derivado de um ácido fraco e de base forte. Meio básico: pH> 7. b) Hidrólise do cátion Sal derivado de um ácido forte e de base fraca. Meio ácido: pH< 7. c) Hidrólise do ânion e do cátion Sal derivado de um ácido fraca e de base fraca. Ka= Kb (pH = 7) Ka < Kb (pH > 7) Ka > Kb (pH < 7) Titulação e curvas de titulação Usado para determinar a concentração de um soluto. Na bureta fica o titulante e no erlenmeyer fica o titulado. Ponto estequiométrico: quando a quantidade da base neutraliza o ácido ou vice-versa. Fica na mediana da linha de variação brusca do gráfico. Cálculo estequiométrico: Na = Nb à cb . Vb = ca. Va Ácido forte + base forte: não hidrolisa a água. Ponto estequiométrico: pH = 7. Ácido fraco + base forte: estequiométrico: pH > 7. hidrólise do ânion. Ponto Ácido forte + base fraco: estequiométrico: pH < 7. hidrólise do cátion. Ponto A zona de viragem do indicador tem que estar dentro da zona de viragem brusca. Você encontra esse resumo no site: http://www.webnotes.com.br/
Baixar