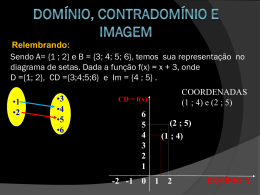
Potencial hidrogeniônico (pH) e Potencial hidroxiliônico (pOH) PRODUTO IÔNICO DA ÁGUA CARÁTER DAS SOLUÇÕES AQUOSAS pH e pOH pH e pOH das soluções aquosas solução ácida: pH<7 e pOH>7 solução básica: pH>7 e pOH<7 solução neutra: pH=7 e pOH=7 Exercícios resolvidos 1. Qual o pH de uma solução cuja concentração hidrogeniônica ([H+] é 10-8 ? 2. Calcular o pH de um meio cuja concentração hidrogeniônica é 0,01 mol/L. 3. Qual é o pH de uma solução cuja concentração hidroxiliônica é de 0,1 mol/L? 4. Calcular o pH de uma solução de ácido clorídrico – HCl – 0,1M 5. Determine o pH de uma solução 0,005M de ácido sulfúrico? 6. Uma solução apresenta concentração hidrogeniônica igual a 10-11 mol/L. Qual é o seu pOH? 7. Foi preparada uma solução 0,04M de ácido clorídrico (HCl). Descobrir o seu pOH. 8. Foi preparada uma solução 0,8M de hidróxido de sódio (NaOH). Qual o seu pH? 9. Qual o pH de uma solução 0,2M de ácido acético (HAc), sabendo que, nessa diluição, o grau de ionização é igual a 0,5%? 10. Em uma solução aquosa 0,1M, o ácido acético (HAc) está 1% ionizado. Calcular a concentração hidrogeniônica e o pH da solução. 11. Qual é a concentração de íons H+ de uma cerveja cujo pH é 4,5 12. Em uma solução de pH=4, um mol de H+ está contido em quantos litros de solução? 13. O pH de uma solução de ácido clorídrico é 2. Adicionando-se um litro de água a um litro de solução de ácido clorídrico , qual o novo pH? 14. Dissolveu-se 5x10-4 mol do eletrólito forte Ca(OH)2 em água para obterem-se 100 mL de uma solução saturada desse hidróxido. Qual será o pH dessa solução? 15. A 3g de ácido acético (HAc – Massa molar 60g/mol) foi adicionada água suficiente para completar 500 mL de solução. Sabendo que nessa concentração o grau de ionização do ácido é de 1%, calcule, para essa solução: a)concentração hidrogeniônica b)potencial hidrogeniônico c)concentração hidroxiliônica d)potencial hidroxiliônico - pOH – – [H+] pH [OH-] 16. Temos uma solução 0,05M de hidróxido de amônio (NH4OH). Calcular o pH e o pOH dessa solução, sabendo que a constante de ionização da base é 2x10-5. 17. Qual o pH e o pOH de uma solução cuja concentração hidrogeniônica é 5x10-5M? Dado: log 5 = 0,7 18. Qual a variação de pH de uma solução de ácido acético, quando se adiciona acetato de sódio? 19. (FESP-UPE) Preparou-se uma solução de hidróxido de sódio , dissolvendose convenientemente 4,0x10-7g dessa base em um litro de água destilada. Admitindo-se que não houve variação de volume, após a adição da base, podese afirmar que o pH do meio é aproximadamente: Dados: Na=23u, H=1u, O=16u, log 1,1=0,04 a)6,00 b)8,00 c)7,04 d)6,96 e)12,95 ou então podemos ir em um caminho totalmente matemático 20. Dissolveu-se 37mg de hidróxido de cálcio (a=100%) em água para obterem-se 100 mL de uma solução saturada dessa base. Qual será o pH dessa solução? 21. Determinada variedade de suco de limão tem pH=2 e determinada variedade de suco de laranja tem pH=4. Determine a relação de concentração hidrogeniônica entre o suco de limão e o suco de laranja. Exercícios propostos 1. Considere que a solução de H2SO4 da bateria de carro tenha pH=1 e que o suco de limão tenha pH=2.Qual a solução mais ácida? Justifique. 2. Um xampu tem pH=8. Qual o valor de [H+] para o xampu? 3. Qual é o pH de uma solução 0,1M de um ácido HX com grau de ionização igual a 1%? 4. A análise de uma amostra de sabão revelou [H+]=10-10M. Determine o pOH da amostra 5. Um volume V de solução de ácido nítrico (HNO3), de pH=2,3, foi diluído com água até 10V. Determine o pH da solução diluída. 6. Sabendo que, a 25OC, um guaraná em lata apresenta [H+]=10-3M, determine [OH-] nesse refrigerante. 7. A clara de ovo tem [OH-]=10-6M. Qual o valor do seu pH? 8. O vinagre é uma solução de ácido acético que pode ser obtida pela oxidação do álcool etílico do vinho. Sabendo que a análise de uma amostra revelou [H+]=10-4M, determine o pH da amostra. 9. Um alvejante de roupas, do tipo "água de lavadeira", apresenta [OH-] aproximadamente igual a 10-4M. Nessas condições, qual será o [H+]? 10. A bile, segregada pelo fígado, é um líquido amargo, esverdeado e muito importante na digestão. Sabendo que a concentração de H+ na bile é de 10-8M, determine o pH da bile. 11. (PUC-MG) Ao analisar um determinado suco de tomate, um técnico determinou que sua concentração hidrogeniônica (H+) era igual a 0,001 mol/L. Qual o pH desse suco de tomate? 12. (Famig-MG) Suponha que 0,28g de hidróxido de potássio (KOH) foram dissolvidos em água suficiente para completar 0,5 L da solução. Qual o pH da solução resultante? 13. (Fatec-SP) O ácido cítrico é utilizado como acidulante nos refrigerantes. Determinou-se experimentalmente que, em 5 mL de suco de limão encontram-se 5x10-5 mols de íons H+ provenientes da ionização do ácido cítrico. Qual o valor do pH do suco de limão? 14. (UFOP-MG) Mostre que a adição de 0,010 mols de hidróxido de sódio (NaOH) sólido a 1,0 litro de água reduz a concentração hidrogeniônica para 1x10-12 M. 15. (UFGO) Em uma solução de ácido acético 0,1M, esse ácido está 1% ionizado. Calcule a concentração hidroxiliônica. 16. (EFOA-MG) Uma amostra de suco de laranja tem pH=4. Calcule a concentração hidroxiliônica. 17. (EEM-SP) Determine o pH e a concentração hidrogeniônica de uma solução 0,001 M de KOH. 18. (FEI-SP) A análise de uma determinada amostra de refrigerante detectou pH=2. Qual a concentração hidrogeniônica nesse refrigerante? 19. A análise de uma amostra de um determinado sabão revelou [H+]= 10-10M. Qual o pOH da amostra? 20. Sabendo que a água do mar apresenta concentração hidroxiliônica igual a 10-6 M, a 25O C, determine o valor da concentração hidrogeniônica e o pH nessa solução. 21. (Cesgranrio-RJ) Entre os antiácidos caseiros, destacam-se o leite de magnésia e o bicarbonato de sódio. Quantas vezes o leite de magnésia (pH=11) é mais básico do que uma solução de bicarbonato de sódio (pH=8)?
Baixar