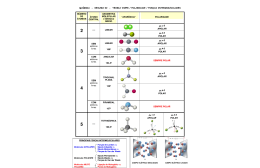
LIGAÇÃO COVALENTE APOLAR ELEMENTOS COM MESMA ELETRONEGATIVIDADE LIGAÇÃO COVALENTE POLAR ELEMENTOS COM ELETRONEGATIVIDADES DIFERENTES MOLÉCULA APOLAR VETORES SE ANULAM ///// µR = 0 MOLÉCULA APOLAR VETORES SE ANULAM ///// µR = 0 MOLÉCULA POLAR VETORES NÃO SE ANULAM ///// µR ≠ 0 MOLÉCULA POLAR VETORES NÃO SE ANULAM ///// µR ≠ 0 MÉTODO DA COMPARAÇÃO ANÁLISE ENTRE O NÚMERO DE NUVENS E O NÚMERO DE LIGANTES EXEMPLO DIÓXIDO DE CARBONO ///// FLUORETO DE BORO MÉTODO DA COMPARAÇÃO ANÁLISE ENTRE O NÚMERO DE NUVENS E O NÚMERO DE LIGANTES EXEMPLO DIÓXIDO DE ENXOFRE ///// FLUORETO DE OXIGÊNIO QUESTÃO EXTRA POLARIDADE DAS MOLÉCULAS ( Ufpe ) Existem três diferentes diclorobenzenos, C6H4Cl2 dependendo da localização dos átomos de cloro. Sobre estes compostos pode-se dizer: 01. Todos têm o mesmo momento de dipolo, pois sua composição química é a mesma. 02. O mais polar é o composto (2) . 03. O composto (1) é mais solúvel em solventes apolares. 04. Os compostos (2) e (3) são polares. 05. Nenhum deles é polar porque o anel benzênico é perfeitamente simétrico nos três casos. F–V–V–V–F QUESTÃO EXTRA POLARIDADE DAS MOLÉCULAS ( Ufc ) Não obstante os cientistas terem grande capacidade de planejar suas pesquisas para fins de obtenção de produtos específicos, muitos materiais de nobres utilidades para o homem foram descobertos de maneira absolutamente acidental. O teflon, por exemplo, foi descoberto em 1938 por Roy Plunkett, quando pesquisava as propriedades do gás tetrafluoretileno ( C2F4 ) , o qual originou um polímero sólido, de cor branca, bastante resistente ao calor. Com relação ao tetrafluoretileno, é correto afirmar que sua molécula e as ligações químicas nela existentes são, respectivamente: a) polar / todas covalentes apolares do tipo pi. b) polar / iônicas ( C-F ) e eletrovalentes ( C-C ) . c) apolar / todas covalentes apolares do tipo sigma. d) apolar / covalentes polares ( C-F ) e apolares ( C-C ) . e) iônica / covalentes apolares ( F-F ) e polares ( C-F ) . Alternativa [ D ] QUESTÃO EXTRA POLARIDADE DAS MOLÉCULAS ( Ufsc ) Considere a tabela a seguir e selecione a ( s ) proposição ( ões ) que relaciona ( m ) corretamente a forma geométrica e a polaridade das substâncias citadas: 01. H2O / angular e polar. 02. CO2 / linear e apolar. 04. CCl4 / trigonal e polar. 08. NH3 / piramidal e polar. 16. CCl4 / tetraédrica e apolar. Soma = 27 QUESTÃO EXTRA POLARIDADE DAS MOLÉCULAS ( Unesp ) Os fornos de microondas são aparelhos que emitem radiações eletromagnéticas que aquecem a água e, conseqüentemente, os alimentos que a contêm. Isso ocorre porque as moléculas de água são polares, condição necessária para que a interação com esse tipo de radiação seja significativa. As eletronegatividades para alguns elementos são apresentadas na tabela a seguir. a) Com base nessas informações, forneça a fórmula estrutural e indique o momento dipolar resultante para a molécula de água. b) Sabendo que praticamente não se observam variações na temperatura do dióxido de carbono quando este é exposto à ação das radiações denominadas microondas, forneça a estrutura da molécula de CO2 e indique o momento dipolar resultante. a) Polar b) Apolar QUESTÃO EXTRA POLARIDADE DAS MOLÉCULAS ( Ita ) Assinale a opção que contém a afirmação falsa. a) NH3 tem três momentos de dipolo elétrico cujo somatório não é nulo. b) CH4 tem quatro momentos de dipolo elétrico cujo somatório é nulo. c) CO2 tem dois momentos de dipolo elétrico cujo somatório é nulo. d) O momento de dipolo elétrico total do acetileno é zero. e) A ligação dupla entre carbonos tem momento dipolar menor que a tripla entre carbonos. Alternativa [ E ] QUESTÃO EXTRA POLARIDADE DAS MOLÉCULAS ( Uepg ) Sobre as seguintes geometrias moleculares, assinale o que for correto. 01. O composto CO2 é apolar, porque o vetor µ = 0 . 02. Os compostos NH3 e H2O são polares. 04. Os compostos BF3 e CO2 são apolares. 08. Os compostos H2O e BF3 são polares, pois o vetor µ ≠ 0 . 16. Os compostos NH3 e BF3 são apolares. Soma = 07 QUESTÃO EXTRA POLARIDADE DAS MOLÉCULAS ( Ufg ) Quando uma pessoa inala benzeno, seu organismo dispara um mecanismo de defesa que o transforma no catecol, uma substância hidrossolúvel, como representado abaixo. Porque o catecol é mais solúvel em água que o benzeno ? O catecol é polar QUESTÃO EXTRA POLARIDADE DAS MOLÉCULAS ( Fuvest - 2012 ) Em cadeias carbônicas, dois átomos de carbono podem formar ligação simples ( C–C ) , dupla ( C=C ) ou tripla ( C ≡ C ) . Considere que, para uma ligação simples, a distância média de ligação entre os dois átomos de carbono é de 0,154 nm , e a energia média de ligação é de 348 kJ/mol . Assim sendo, a distância média de ligação ( d ) e a energia média de ligação ( E ) , associadas à ligação dupla ( C=C ) , devem ser, respectivamente: a) d < 0,154 nm e E > 348 kJ/mol b) d < 0,154 nm e E < 348 kJ/mol c) d = 0,154 nm e E = 348 kJ/mol d) d > 0,154 nm e E < 348 kJ/mol e) d > 0,154 nm e E > 348 kJ/mol Alternativa [ A ] QUESTÃO EXTRA POLARIDADE DAS MOLÉCULAS ( Fuvest - 2011 ) A figura abaixo traz um modelo da estrutura microscópica de determinada substância no estado sólido, estendendo-se pelas três dimensões do espaço. Nesse modelo, cada esfera representa um átomo e cada bastão, uma ligação química entre dois átomos. A substância representada por esse modelo tridimensional pode ser: a) sílica ( SiO2 )n b) diamante ( C ) c) cloreto de sódio ( NaCl ) d) zinco metálico ( Zn ) e) celulose ( C6H10O5 )n Alternativa [ A ] QUESTÃO EXTRA POLARIDADE DAS MOLÉCULAS ( Ufrgs-2010 ) A Via Láctea tem gosto de framboesa: astrônomos alemães descobriram metanoato de etila, substância química que dá à framboesa seu sabor característico, em uma nuvem de poeira próximo ao centro da Via Láctea. Mas, se astronautas fossem até lá, não poderiam deliciar-se com ela, pois a nuvem também é formada por cianeto de propila, um veneno letal. Observe as fórmulas das substâncias referidas no texto e os carbonos nelas assinalados. Os carbonos assinalados com os números 1, 2, 3 apresentam, respectivamente, geometria molecular do tipo: a) trigonal plana, tetraédrica e linear. b) linear, trigonal plana e tetraédrica. c) linear, tetraédrica e linear. d) trigonal plana, trigonal plana e tetraédrica. e) tetraédrica, linear e trigonal plana. Alternativa [ A ]
Baixar