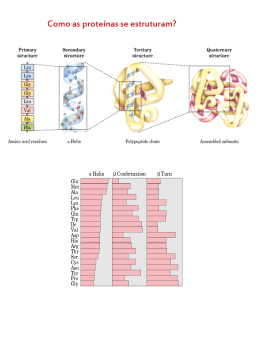
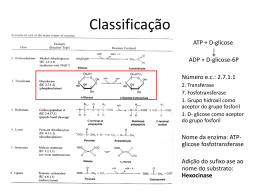
ENZIMAS FUNCIONAIS & NUTRACÊUTICOS ENZIMAS CATALIZADORAS DE REAÇÕES BIOLÓGICAS Enzimas são um grupo de substâncias orgânicas de natureza geralmente protéica, com atividade intra ou extracelular, que têm funções catalisadoras, ou seja, catalisam reações químicas que, sem a sua presença, aconteceriam a uma velocidade demasiado baixa. A capacidade catalítica das enzimas torna-as adequadas para uso na indústria de alimentos, entre outras. História A descoberta das enzimas data do século XVIII, quando se iniciaram os estudos sobre digestão dos alimentos. Em 1831, o famoso químico sueco Jöns Jacob Berzelius (1779-1848) constatou que certas substâncias continham uma “força catalítica” que lhes permitia acelerar determinadas reações. Dois anos mais tarde, os químicos franceses Anselme Payen (1795-1871) e Jean-François Persoz (1805-1868) encontraram uma substância termolábil no precipitado do álcool, extrato de malte, que convertia amido em açúcar, primeiramente, chamada de diastase e, mais tarde, denominada amilase. A primeira teoria sobre enzimas foi publicada em 1835 por Berzelius. O 20 enzimas.indd 20 25/8/2008 14:03:59 ENZIMAS químico francês Louis Pasteur (18221895) concluiu que a fermentação do açúcar em álcool pela levedura era catalisada por fermentos, postulando que esses fermentos (as enzimas) eram inseparáveis da estrutura das células vivas do levedo e estabeleceu o conceito de que as enzimas eram células vivas. Na mesma época, o químico alemão Justus von Liebig (1803-1873) afirmou que a fermentação era provocada por substâncias químicas. A denominação enzima [do grego énsimo (ενζυµο), formado de én = em e simo = fermento ou levedura] foi dada, em 1878, pelo fisiologista alemão Alexander Friedrich Khune. Em 1897, outro químico alemão, Eduard Buchner (1860-1917), que ganharia o prêmio Nobel de Química em 1907, acabou com a controvérsia entre Liebig e Pasteur, ao mostrar a possibilidade da fermentação na ausência de células vivas. Descobriu que os extratos de levedo podiam fermentar o açúcar até álcool e provou que as enzimas envolvidas na fermentação continua vam funcionando, mesmo quando removidas das células vivas. Em 1898, Pierre Émile Duclaux (1840-1904), diretor do Institute Pasteur, estabeleceu a convenção de designar as enzimas pelo nome do substrato no qual sua ação foi primeiramente observada, seguida pelo sufixo - ase. Em 1900, o químico alemão Hermann Emil Fischer (1852-1919) descobriu a estéreo especificidade Justus von Liebig (1803-1873) das enzimas. Fischer ganhou, dois anos mais tarde, o prêmio Nobel de Química em reconhecimento ao seu extraordinário trabalho no campo da síntese dos açúcares e da purina. Os trabalhos de purificação de enzimas começaram depois de 1920. Em 1926, o bioquímico James Batcheller Sumner (18871955), da Cornell University, isolou e cristalizou a urease e demonstrou que os cristais de urease consistiam inteiramente de proteína, postulando que todas as enzimas são proteínas, mas esta idéia permaneceu controversa por algum tempo. James Sumner ganhou o prêmio Nobel de Química, em 1946, junto com John Howard Northrop (1891-1987) e Wendell Meredith Stanley (1904-1971), ambos norteamericanos e professores/pesquisadores no Rockefeller Institute for Medical Research Princeton, NJ. Entre 1930 e 1936, John Northrop e seus colegas cristalizaram a pepsi na, a quimotripsina e a tripsina bovinas e descobriram que essas moléculas também eram proteínas. Era assim confirmado que os cristais eram proteinas, ou seja, a natureza protéica das enzimas era definitivamente estabelecida. O biologista e geneticista inglês John Burdon Sanderson Haldane (1892-1964) escreveu, em 1930, um tratado intitulado Enzymes, o qual continha a notável sugestão de que as interações por ligações fracas, entre a enzima e seu substrato, poderiam ser usadas para distorcer a molécula do substrato e catalisar a reação. A cristalização de enzimas purificadas permitiu que as suas estruturas moleculares pudessem ser examinadas por cristalografia de r aios X , o que aconteceu primeiro, em 1965, com a lisozima, uma enzima que existe na saliva, lágrimas e na clara de ovo e destrói a parede celular das bactérias. Começaram assim a bioquímica e biologia estruturais, que se esforçam por compreender o funcionamento das enzimas a nível atômico. Definição Enzimas são proteínas, polímeros de cadeia longa com aminoácidos sucessivamente ligados uns aos outros através de ligações peptídicas em uma seqüência determinada geneticamente, que apresentam atividade catalítica. As enzimas são catalisadores das reações bioquímicas, isto é, atuam tornando possível uma nova reação com energia de ativação menor. Isso significa que simplesmente com a sua presença e sem serem consumidas durante o processo, as enzimas conseguem acelerar os processos bioquímicos. A eficiência das enzimas como catalisadores é medida pelo número de transformações moleculares, que é explicada pelo número de moléculas de substrato que uma enzima converte por unidade de tempo. FUNCIONAIS & NUTRACÊUTICOS Jöns Jacob Berzelius (1779-1848) Louis Pasteur (1822-1895) A descoberta das enzimas data do século XVIII, quando se iniciaram os estudos sobre digestão dos alimentos. 21 enzimas.indd 21 25/8/2008 14:04:00 FUNCIONAIS & NUTRACÊUTICOS ENZIMAS As enzimas são sintetizadas por células vivas e atuam em quase todas as reações químicas do metabolismo dos organismos vivos e, portanto, também estão presentes nos vários alimentos, atuando na hidrólise do material alimentício em compostos mais simples, por exemplo, as lipases que hidrolisam as gorduras sem glicerol e ácidos graxos, e as amilases que hidrolisam amido em açúcares mais simples. As enzimas convertem uma substância, chamada de substrato, em outra denominada produto, e são extremamente específicas para a reação que catalisam. Isso signi fica que, em geral, uma enzima catalisa um e só um tipo de reação química. Conseqüentemente, o tipo de enzima encontrado em uma célula determina o tipo de metabolismo que a célula efetua. A velocidade da reação catalisada por uma enzima é aumentada devido ao abaixamento da energia de ativação necessária para converter o substrato no produto. O aceleramento da reação pode ser da ordem de milhões de vezes; por exemplo, a enzima orotidina-5’fosfato descarboxilase diminui o tempo da reação por ela catalisada de 78 milhões de anos para 25 milissegundos. Como são catalisadoras, as enzimas não são consumidas na reação e não alteram seu equilíbrio químico. A atividade enzimática pode depender da presença de determinadas moléculas, genericamente chamadas cofatores. A natureza química dos cofatores é muito variável, podendo ser, por exemplo, um ou mais íons metálicos (como o ferro), ou uma molécula orgânica (como a vitamina B 12). Estes cofatores podem participar ou não diretamente na reação enzimática.Os cofatores podem ser inorgânicos (íons metálicos e complexos ferro-enxofre) ou compostos orgânicos (flavina ou heme). Os cofatores orgânicos (coenzimas) são normalmente grupos prostéticos, que estão intimamente ligados às enzimas a que eles prestam assistência. Os cofatores que possuem ligação forte às enzimas são distintos de outras coenzimas, visto que não são liberados do sítio ativo durante a reação catalisada. Um exemplo de enzima que contém um cofator é a anidrase carbônica. Estas moléculas que possuem uma ligação estreita com as enzimas são normalmente encontradas no sítio ativo e estão envolvidas na reação catalítica. Por exemplo, a flavina e grupos heme estão muitas vezes envolvidos em reações de oxidaçãoredução. A parte da enzima que se liga ao cofator é denominada apoenzima. Uma apoenzima juntamente com os seus cofatores são denominadas holoenzimas. A maioria dos cofatores não se ligam por covalência a uma enzima, mas estabelecem ligações fortes. No entanto, os grupos prostéticos orgânicos podem ligar-se de maneira covalente. Um exemplo disso é a ligação da tiamina pirofosfato à enzima piruvato desidrogenase. Determinadas substâncias podem inibir a atividade de algumas enzimas, diminuindo-a ou eliminando-a totalmente; são os chamados inibidores enzimáticos. A inibição enzimática pode ser reversível ou irreversível. Existem dois tipos de inibição enzimática reversível: a competitiva e a nãocompetitiva. A inibição enzimática reversível competitiva ocorre quando o inibidor se liga reversivelmente ao mesmo sítio de ligação do substrato. O efeito é revertido aumentando-se a concentração de substrato. Este tipo de inibição depende das concentrações de substrato e de inibidor. A inibição enzimática reversível não-competitiva ocorre quando o inibidor liga-se reversivelmente à enzima em um sítio próprio de ligação, podendo estar ligado à mesma ao mesmo tempo em que o substrato. Este tipo de inibição depende apenas da concentração do inibidor. Na inibição enzimática irreversível, há modificação covalente e definitiva no sítio de ligação ou no sítio catalítico da enzima. Classificação e estrutura As enzimas podem ser classificadas de acordo com vários critérios. O mais importante foi estabelecido pela União Internacional de Bioquímica (IUB), e estabelece seis classes. As oxidorredutases são enzimas que catalisam reações de transferência de elétrons, ou seja, reações de oxiredução. São as desidrogenases e as oxidases. Se uma molécula se reduz, tem que haver outra que se oxide. As transferases são enzimas que catalisam reações de transferência de grupamentos funcionais, como grupos amina, fosfato, acil, car boxil, etc. Como exemplo, temos as quinases e as transaminases. As hidrolases catalisam reações de hidrólise de ligação covalente. Um exemplo são as peptidases. As liases catalisam a quebra de ligações covalentes e a remoção de moléculas de água, amônia e gás carbônico. As dehidratases e as descarboxilases são bons exemplos. As isomerases catalisam reações de interconversão entre isômeros ópticos ou geométricos. As epimerases são exemplos. 22 enzimas.indd 22 25/8/2008 14:04:01 ENZIMAS CLASSES DE ENZIMAS Classe 1 Oxirredutases Catalisam reações de oxiredução, transferindo elétrons, hidretos (H-) ou protões (H+). Classe 2 Transferases Transferem grupos químicos entre moléculas. Classe 3 Hidrolases Utilizam a água como receptor de grupos funcionais de outras moléculas. Classe 4 Liases Formam ou destroem ligações duplas, respectivamente, retirando ou adicionando grupos funcionais. Classe 5 Isomerases Transformam uma molécula em seu isômero. Classe 6 Ligases Formam ligações químicas por reações de condensação, consumindo energia sob a forma de ATP. tais como especificidade de substrato, dependência da temperatura e dependência do pH. Especificidade As enzimas são específicas, isto é, hidrolisam e sintetizam um composto em particular. Em alguns casos, sua ação está limitada a ligações específicas dentro dos compostos com os quais exercem reação. Esta especificidade é devido ao sítio ativo, parte da enzima que a difere da proteína, que é capaz de se ligar a moléculas denominadas substrato formando o complexo enzima-substrato, como o explicado pela teoria da chave-fechadura, demonstrada por Emil Fischer, onde a chave, neste caso o substrato, deve-se ajustar à fechadura, no caso a enzima, de modo que cada enzima aja sobre um número muito limitado de compostos. Segundo a cinética da reação, modelos proposto pelas pesquisadores Michaelis e Menten, a enzima E reage com o substrato S formando um composto intermediário conhecido como complexo ativado instável enzima-substrato ES, o qual se decompõe em enzima E e o produto de reação P. E + S ↔ ES → E + P A quantidade de enzima exigida no processo é pequena e não influi na variação energética da reação. A cinética da reação é influenciada pela concentração do substrato e da enzima. A velocidade da reação aumenta com o aumento da concentração de enzima para uma mesma concentração de substrato. Se a concentração do substrato é baixa, temos uma subutilização do sítio ativo da enzima e, conseqüentemente, pouco produto é formado. Com o aumento da concentração do substrato, a reação tende a atingir sua velocidade máxima, isto é, produzir a máxima quantidade de produto para uma quantidade de enzima pré-determinada - temos assim, uma reação saturada. A partir deste momento, a quantidade de substrato adicionado não altera mais a velocidade da reação. Temperatura A maioria das enzimas apresenta melhor desempenho em temperaturas que variam de 30°C a 70°C e com valores de pH próximos à neutralidade (pH ≅ 7). Em geral, pode-se dizer que nenhuma enzima resiste por muito tempo à temperaturas superiores a 100°C. A velocidade das reações enzimáticas aumenta com o aumento da temperatura de modo semelhante ao das reações químicas, isto é, a velocidade da reação duplica com o aumento de 10°C na temperatura da reação. Nas reações enzimáticas, porém, a velocidade aumenta com a temperatura, até atingir uma velocidade máxima, a partir da qual começa a decrescer. Sob condições específicas, a temperatura ótima para cada reação pode ser determinada. O efeito da temperatura é muito complexo e pode ser devido a várias causas. Inicialmente, com o aumento da temperatura, a atividade molecular é aumentada, o que FUNCIONAIS & NUTRACÊUTICOS E, as ligases, que catalisam reações de formação e novas moléculas a partir da ligação entre duas já existentes, sempre à custa de energia (ATP). Um exemplo são as sintetases. As enzimas, sendo proteínas globulares de diversos tamanhos, têm sua estrutura definida pelas estruturas primária, secundária, terciária e quaternária. A estrutura primária refere-se ao tipo de seqüência dos aminoácidos na molécula protéica. A estrutura secundária representa a estrutura espacial, tridimensional, que a molécula assume. É formada pela associação dos membros próximos da cadeia polipeptídica e é mantida, principalmente, através de pontes de hidrogênio. É também chamada de estrutura helicoidal. A estrutura terciária é a forma segundo a qual a estrutura secundária se arranja, se dobra e se enovela, formando estruturas globulares rígidas. Essa estrutura é estabilizada por ligações de diversos tipos, como pontes de hidrogênio, hidrofóbicas, iônicas, eletrostáticas e covalentes. Estas últimas são representadas pelas pontes de dissulfito ente os resíduos de cisteína. A estrutura quaternária é a forma como as diversas estruturas terciárias ou subunidades se associam. Uma enzima é uma proteína que catalisa ou acelera uma reação biológica. Pode, portanto, ser definida como um biocatalisador, cuja natureza protéica determina a presença de certas propriedades, 23 enzimas.indd 23 25/8/2008 14:04:01 ENZIMAS amplia a formação do complexo enzimático; no entanto, com o aumento contínuo da temperatura, pode ocorrer uma inativação gradativa da enzima, até a inativação total, causada pela desnaturação protéica pelo calor. Em geral, as enzimas reagem muito lentamente nas temperaturas de subcongelamento e sua atividade aumenta com o aumento da temperatura até atingir uma atividade ótima em temperaturas ao redor de 45°C, além das quais começa a sua inativação. TABELA I - PH ÓTIMO DE ALGUMAS ENZIMAS Enzima Origem Substrato pH ótimo Pepsina estômago proteínas 2 Quimotripsina pâncreas proteínas 7,8 Papaína planta tropical proteínas 7-8 Lipase microrganismo azeite de oliva 5-8 α-glucosidase microrganismo maltose 6,6 β-amilase malte amido 5,2 Lipoxigenase I soja ácido linoléico 9,0 Lipoxigenase II soja ácido linoléico 6,5 pH A ação catalítica de uma reação enzimática é alcançada dentro de limites muito estreitos de pH. Cada reação tem um pH ótimo, que para a maioria das enzimas se situa entre 4,5 e 8,0, e no qual a enzima apresenta sua atividade máxima. O valor do pH ótimo varia de acordo com as várias enzimas e os diferentes substratos sobre os quais atuam (veja Tabela I). Valores baixos ou altos de pH podem causar desnaturação protéica considerável e conseqüente inativação enzimática. Por isso, é muito útil saber em que faixa de pH a enzima é mais estável, já que o pH de máxima estabilidade nem sempre coincide com o de máxima atividade. As enzimas podem ser inativadas, isto é, desnaturadas por diversos fatores, como calor, ponto isoelétrico, seqüestro de sais de cálcio e agitação mecânica. FUNCIONAIS & NUTRACÊUTICOS Mecanismos de ação As enzimas atuam de diversas formas: - Baixando a energia de ativação, através da criação de um ambiente no qual o estado de transição é estabilizado (por exemplo, distorcendo a forma da molécula do substrato) - a enzima distorce o substrato, gastando energia, de modo a baixar a energia do estado de transição da reação catalisada, resultando em uma diminuição global da energia requerida para completar a reação. - Providenciando uma via alternativa, por exemplo, reagindo com o substrato para formar um complexo enzima-substrato, de existência impossível sem a presença da enzima. - Reduzindo a variação da entropia da reação ao orientar os substratos de forma correta para facilitar a reação. Na ausência da enzima, as moléculas colidem em todas as direções possíveis de forma aleatória, um processo menos eficiente do que na presença da enzima. Pesquisas recentes apresentaram novos conhecimentos sobre a ligação entre a dinâmica interna de uma enzima e o seu mecanismo de catálise. A dinâmica interna de uma enzima é descrita como o movimento de partes internas (como aminoácidos individuais, grupos de aminoácidos, um laço da cadeia, uma hélice alfa, folhas beta vizinhas ou até domínios protéicos inteiros) destas biomoléculas, que podem ocorrer a diversas escalas de tempo, desde femtossegundos a segundos. Redes de resíduos de aminoácidos de uma estrutura podem contribuir para a catálise através de movimentos dinâmicos. Os movimentos em proteínas são importantes para diversas enzimas, mas o tipo de reação que elas catalisam é que determina que tipos de movimento são mais importantes: pequenas e rápidas vibrações ou lentas e significativas alterações conformacionais. Estes estudos têm conseqüências na compreensão dos efeitos alostéricos, na produção industrial de enzimas e no desenvolvimento de novos fármacos. Mecanismo geral de catálise As enzimas aceleram a velocidade de uma reação por diminuir a energia livre de ativação da mesma, sem alterar a termodinâmica da reação, ou seja, a energia dos reagentes e produtos da reação enzimática e de sua equivalente não enzimática são idênticas. Para se superar a energia de ativação de uma reação, passase pela formação de um estado intermediário chamado “Estado de Transição”, sempre um composto instável e de alta energia, representado por “Ts”, ligado com altíssima afinidade ao sítio catalítico. Nas reações enzimáticas, este composto de transição “Ts” não pode ser isolado ou mesmo considerado um intermediário, uma vez que não é liberado para o meio de reação; sua formação ocorre no sítio catalítico da enzima. Como a afinidade do “Ts” ao sítio catalítico é muito maior que a afinidade do substrato com o mesmo, a pequena quantidade de moléculas em “Ts” será rapidamente convertida em produto. Assim, todo o fator que leva a um aumento do número de moléculas em “Ts” aumenta a velocidade da reação. 24 enzimas.indd 24 25/8/2008 14:04:01 ENZIMAS Funções biológicas As enzimas exercem uma grande variedade de funções nos organismos vivos. São indispensáveis para a transdução de sinais, na regulação celular, muitas vezes por ação de cinases e fosfatases. Através da sua ação, podem gerar movimento, como no caso da miosina que hidroliza ATP, gerando contrações musculares. Também movimentam carga através da célula, pela ação do citoesqueleto. Algumas enzimas são ATPases (funcionam como bombas iônicas), que se localizam na membrana celular, estando envolvidas do processo de transporte ativo. Algumas funçõe s mais oxóticas são operadas por enzimas, como é o caso da luciferase que gera luz nos pirilampos. Os vírus podem conter enzimas que auxiliam na infecção de células (HIV - integrase e transcriptase reversa) ou na libertação celular de vírus (neuraminidase no vírus influenza). Uma importante função das enzimas tem lugar no sistema digestivo dos animais. Enzimas como as amilases e proteases quebram grandes moléculas, como o amido e proteínas, respectivamente, em moléculas de menores dimensões, de maneira que estas possam ser absorvidas no intestino. O amido não é absorvível no intestino, mas as enzimas hidrolizam as cadeias de amido em moléculas menores, tais como a maltose e a glucose, podendo desta maneira serem absorvidas. Diferentes enzimas atuam sobre diferentes tipos de alimentos. Nos ruminantes, que possuem uma dieta herbívora, bactérias no sistema digestivo produzem uma enzima denominada celulase, que quebra as paredes celulares das células vegetais. As enzimas podem trabalhar em conjunto, seguindo uma ordem de atuação específica. Desta maneira podem formar vias metabólicas. Nestas vias, uma enzima processa o produto da ação de outra enzima, como o seu substrato. Após a reação catalítica, o produto é entregue a outra enzima. Por vezes, mais do que uma enzima pode catalisar a mesma reação, em paralelo. As enzimas determinam os passos que ocorrem nessas vias metabólicas. Sem a presença de enzimas, o metabolismo não progride através dos mesmos passos, nem é suficientemente rápido para que sirva as necessidades da célula. De fato, uma via metabólica tão importante como a glicólise não poderia existir sem a presença de enzimas. A glucose, por exemplo, pode reagir diretamente com o ATP para dar origem a um produto fosforilado em um ou mais carbonos. Na ausência de enzimas, este processo é tão lento que se torna insignificante. No entanto, se a enzima hexocinase for adicionada, estas reações lentas continuam a ser efetuadas, mas a fosforilação do carbono número 6 ocorre de maneira tão rápida que, se a mistura for testada pouco tempo depois, a glicose-6-fosfato é o único produto significativo. Conseqüentemente, pode-se dizer que a rede de vias metabólicas existentes dentro de cada célula depende do conjunto de enzimas funcionais que estão presentes. As enzimas e a indústria de alimentos A indústria alimentícia é hoje uma das principais beneficiárias das enzimas, que podem tornar os alimentos mais saborosos, nutritivos, digestivos e até mais bonitos (veja tabela II). A enzima amilase maltogênica, por exemplo, permite a fabricação de pães mais macios e volumosos com sabor e aroma mais agradáveis e que permanecem frescos por muito mais tempo. A enzima quimosina permite a coagulação do leite para a produção dos mais variados tipos de queijo, e a enzima beta-glicanase dá um tom mais atrativo à cerveja, deixando-a mais clara, com um tom dourado. Em geral, as enzimas são consideradas como auxiliares no processamento de alimentos. Embora possam permanecer no produto final, não exercem uma função tecnológica neste. Portanto, não são consideradas como aditivos alimentares, ao contrário de adoçantes, espessantes, antioxidantes, etc. O interesse no uso de enzimas para o processamento de alimentos se deve a diversos fatores, entre eles a especificidade de ação, ação rápida e eficiente em baixas concentrações, atividade em condições brandas de pH, temperatura e pressão, fácil controle da reação e pequena toxicidade. De acordo com a sua origem, as enzimas podem ser classificadas em enzimas microbianas, enzimas de origem animal e enzimas de origem vegetal. Com o desenvolvimento da tecnologia do DNA recombinante, o uso de células microbianas como fonte de enzimas foi largamente implemen- FUNCIONAIS & NUTRACÊUTICOS São quatro os mecanismos principais através dos quais as enzimas aceleram uma reação, aumentando a formação de moléculas de substrato em “Ts” e incluem a catálise ácido-base, que ocorre com a participação de aminoácidos com cadeias laterais ionizáveis, capazes de doar ou liberar prótons durante a catálise; a torção de substrato, que depende da torção do substrato induzida pela ligação do mesmo com o sítio de ligação da enzima, alcançando o estado de transição e estimulando sua conversão em produto; a catálise covalente, que resulta do ataque nucleofílico ou eletrofílico de um radical do sítio catalítico sobre o substrato, ligando-o covalentemente à enzima e induzindo a sua transformação em produto, envolvendo com freqüência a participação de coenzimas; e o efeito de diminuição da entropia, onde as enzimas ajudam no posicionamento e na definição da estequiometria correta da reação, facilitando os mecanismos anteriores. 25 enzimas.indd 25 25/8/2008 14:04:01 ENZIMAS FUNCIONAIS & NUTRACÊUTICOS TABELA II - PRODUÇÃO DE ENZIMAS: ORIGEM E APLICAÇÃO Enzimas Origem Indústria Aplicação Amilase Aspergillus niger, A. oryzae, Bacillus subtilis, Rhizophus spp, Mucor rouxii Panificação Suplemento de farinha, preparação de massa, alimentos pré-cozidos, elaboração de xaropes. Celulase Aspergillus niger,Trichoderma viride Cerveja Preparação de concentrados líquidos de café, clarificação de sucos. Dextrano-sacarose Leuconostoc mens. Alimentar Dextrano para diversos usos. Glucosioxidase Aspergillus niger Alimentar Eliminação da glicose dos sólidos do ovo. Invertase Sacharomyces cereviase Alimentar Mel artificial. Lactase Sacharomyces fragilis Láctea Hidrólise da lactose. Lipase Aspergillus niger, Rhizophus spp, Mucor spp Láctea Sabor ao queijo. Pectinase Aspergillus niger, Rhizophus spp, Penicillium Alimentar Clarificação de vinho e de sucos de frutas. Protease Aspergillus oryzae, Bacillus subtilis Cerveja, Panificação, Alimentar Impede que a cerveja se enturve ao esfriar, abranda as carnes. Enzimas parecidas à renina Mucor Alimentar Coalhada do leite para fabricação de queijo. tado em escala industrial, permitindo não só o aumento na produção de enzimas já obtidas por outros processos, mas também a produção de novas enzimas de interesse comercial. Como resultado, o mercado global de enzimas industriais saltou de US$ 300 milhões na década de 80 para a impressionante cifra de US$ 1,6 bilhões no final da década de 90. As principais vantagens de se utilizar células microbianas como fontes de enzimas são a obtenção de elevadas concentrações de enzimas através de manipulação genética e ajuste das condições de cultivo, fácil e rápida triagem de microrganismos super produtores, ciclos de fermentação curtos, uso de meios de fermentação de baixo custo, e diversidade de enzimas que catalisam a mesma reação, possibilitando flexibilidade nas condições de uso. Principais enzimas envolvidas no processamento de alimentos As principais enzimas envolvidas no processamento de ali- mentos são as oxidoredutases e as hidrolases. As oxidoredutases são enzimas relacionadas com as reações de óxido-redução em sistemas biológicos e, portanto, com os processos de respiração e fermentação. Dentro desta classe de enzimas pode-se destacar a glucoseoxidase, catalase e lipoxigenase. As hidrolases são enzimas de baixa especificidade, como esterase e tioesterases, que hidrolisam um número muito grande de ésteres e tioésteres, embora com velocidades diferentes, e enzimas de especificidade muito alta, como as glicosilfosfatases (enzimas glicosílicas) e as peptidases (enzimas proteolíticas). Pertencem também à classe das hidrolases, as fosfatases e as pirofosfatases. Dentro dessa classe destacam-se as proteases, amilases (alfa e betaamilase, glucoamilase, isoamilase ou pululanase), alfa-D -galactosidase, beta-D -galactosidase ou lactase, invertase, enzimas pectinolíticas, celulases, hemicelulases e dextranase. Veja as propriedades gerais das amilases industriais na Tabela III. As oxidoredutases • Glucoseoxidase Esta enzima é produzida por diversas cepas de fungos, como Aspergillus niger e Penicillium notatum. A glucoseoxidase catalisa a oxidação de glicose a partir do consumo de oxigênio, como descrito a seguir: glucose β-D-glucose + O2 ↔ δ-D-glucanolactona + H2O2 oxidase O peróxido de hidrogênio formado pode servir com agente oxidante, mas normalmente é destruído pela adição de catalase. Possíveis aplicações: eliminação de glicose na preparação de produtos à base de ovo em pó, evitando-se assim a reação de Maillard. Usos similares podem ser encontrados em produtos a base de carne e/ou batatas. • Catalase Esta enzima pode ser obtida a partir de microrganismos e/ou do fígado, tem importância como enzima auxiliar na destruição de H2O2 : 2 H2O2 ↔ 2 H2O + O2 26 enzimas.indd 26 25/8/2008 14:04:01 ENZIMAS TABELA III – PROPRIEDADES GERAIS DAS AMILASES INDUSTRIAIS Fonte Fúngica (A. oryzae) Bacteriana (B. subtilis) Malte Malte Fúngica (A. niger) bacteriana (E. aerogenes) tipo de amilase α-amilase α-amilase α-amilase β-amilase gluco amilase pululanase pH ótimo 4,8-5,8 5,0-7,0 4,0-5,8 5,0-5,5 4,0-4,5 5-5 pH estabilidade 5,5-8,5 4,8-8,5 4,9-9,1 4,5-8,0 3,5-5,0 5-7 T ótima 45-55°C 60-70°C 50-65°C 40-50°C 55-60°C 45-55°C T inativação > 60°C > 90°C > 70°C > 55°C > 70°C > 60°C As hidrolases • Proteases As proteases hidrolisam as ligações peptídicas das proteínas levando à formação de grupos amina (NH2) e carboxila (COOH), originando polipeptídeos de menor peso molecular e/ou aminoácidos livres. As proteases são específicas, ou seja, não hidrolisam moléculas de proteína em qualquer ligação peptídica, mas apenas em ligações entre certos aminoácidos específicos. Se tais ligações existirem abundantemente na proteína, pode-se esperar uma considerável degradação protéica. Por outro lado, existem proteases que não são específicas quanto à composição dos aminoácidos e podem, portanto, hidrolisar a proteína em vários fragmentos menores. As proteases podem ser classificadas de acordo com a sua origem (animal, vegetal e microbiana) e a natureza do seu sítio catalítico. Do ponto de vista tecnológico, considera-se satisfatório classificar proteases em exopeptidases e endopeptidases, sendo que as endopeptidases são as mais utilizadas nos processamentos de alimentos, e em alguns casos sua ação é complementada com exopeptidases. As exopeptidases atuam nos extremos da cadeia protéica liberando aminoácidos finais. Sua eficácia na transformação das características reológicas das proteínas é limitada, devido à mudanças relativamente pequenas no comprimento da cadeia. As endopeptidases atuam em vários sítios ao longo da cadeia protéica, liberando grandes fragmetos moleculares. As quatro maiores classes de endopeptidases são a serina protease, cisteína protease, aspártico protease e metaloprotease. As serinas protease têm máximo de atividade em pH alcalino, a cisteína protease geralmente apresenta máxima atividade em pH próximo do neutro, e a aspártico protease tem uma atividade catalítica máxima a pH ácido. As metaloproteases contêm um metal essencial, usualmente zinco, e têm ótima atividade em pH próximo do neutro. Íons de cálcio estabilizam estas enzimas, e agentes quelantes, como EDTA, as inibem. A Tabela IV apresenta as proteases utilizadas na tecnologia de alimentos. Principais aplicações: Biscoitaria: como possível substituinte de agentes redutores. Panificação: a partir de farinha dura, isto é, com alto teor de proteína de glúten. Laticínios: hidrólise da caseína para a fabricação de queijos, pro- dução de queijos enzimaticamente modificados (sabores). Cervejaria: hidrólise da proteína do malte (complementação e/ou substituição do malte de cevada), solubilização das proteínas para o lêvedo, prevenção da turbidez da cerveja. Carnes e rações: amaciamento da carne e ração. • Alfa-amilase A alfa-amilase é uma endoenzima que hidrolisa ligações α-1,4-glicosídicas de moléculas de amido, glicogênio e outros α-1,4-glucanos, liberando, primeiramente, oligossacarídeos de 6-7 unidades de glicose e, posteriormente, açúcares redutores (principalmente, maltose). Esta enzima pode ser de origem cereal, bacteriana e fúngica; sendo que apresenta algumas características em comum, como relativa estabilidade térmica (70°C - 15 minutos), labilidade ácida (todas são inativadas a pH 3,6 por curto tempo), e aumento da estabilidade na presença de íons de cálcio. A viscosidade de uma solução de amido diminui rapidamente com a hidrólise pela alfa-amilase – liquefação do amido. A atividade da enzima decresce rapidamente com o menor grau de polimerização do substrato. O processo de catálise é acelerado quando se tem amido gelatinizado. Principais aplicações: Produção de xaropes de amido e açúcares. Panificação: complementação da farinha; alfa-amilase fúngica FUNCIONAIS & NUTRACÊUTICOS • Lipoxigenase A lipoxigenase é uma enzima encontrada em diversas plantas e também nos eritrócitos e leucócitos. Ela catalisa a adição de uma molécula de oxigênio à ácidos graxos insaturados formando peróxidos. Apresenta aplicação em produtos de panificação, como no branquea mento de farinhas e melhora das propriedades reológicas da massa do pão (oferecendo resultados semelhantes aos obtidos pelos reforçadores de massa). 27 enzimas.indd 27 25/8/2008 14:04:01 ENZIMAS quando combinada com amiloglucosidase assegura a quantidade suficiente de açúcares fermentáveis para o lêvedo, auxiliando dessa maneira na produção de massas refrigeradas e congeladas; alfa-amilase bacteriana ou, ainda, uma alfa-amilase com estabilidade térmica intermediária promove retardamento do processso de envelhecimento dos pães e produtos similares. Cervejaria: substituição e/ou complementação das enzimas do malte, auxilia na liquefação dos agregados. Produção de sucos de frutas com alto teor de amido: por exemplo, maçã, maracujá. FUNCIONAIS & NUTRACÊUTICOS • Beta-amilase A beta-amilase é uma exoenzima que catalisa a hidrólise alternada de ligações α-1,4-glicosídicas de polissacarídeos (como o amido), liberando moléculas de maltose a partir da extremidade não redutora. A ação da enzima é interrompida nas regiões com ligações α-1,6-glicosídicas. Uma das mais importantes propriedades das beta-amilases é a sua relativa labilidade térmica quando comparada à alfa-amilase. Principal aplicação Sacarificação do amido. • Gluco-amilase ou exo-α-1,4D-glucosidade É uma exoenzima que hidrolisa ligações α-1,4-glicosídicas e também, embora mais lentamente, ligações α-1,6-glicosídicas de moléculas de amido, liberando unidades de β-D-glucose, uma a uma, a partir da extremidade não redutora. Pode ser de origem bacteriana e/ou fúngica. Principais aplicações: Panificação: assegura a produção de açúcares fermentáveis em quantidades suficientes para o lêvedo. Sacarificação e liquefação do amido. • Iso-amilase ou pululanase A pululanase hidrolisa ligações α-1,6-D-glicosídicas de polissacarí deos ramificados (amilopectina, glicogênio e pululano) A partir da amilopectina se produz cadeias mais ou menos curtas de amilose. Esta enzima é produzida pelo Aerobacter aerogenes. Principais aplicações: Cervejaria: produção de cervejas com baixo teor de calorias, a partir da hidrólise de açúcares não fermentáveis. Hidrólise de amido. • α-D-galacrosidade Esta enzima hidrolisa di-, oligo-, e polissacarídeos a partir de suas extremidades não redutoras. Seus preparados enzimáticos podem ser obtidos pela Mortiella vinacea. Principais aplicações: Durante a refinação do açúcar de beterraba, a α-D-galactosidase hidrolisa a rafinose em sacarose e galactose. Também pode ser usada no processamento de produtos de legumes, especialmente produtos de soja, os quais são ricos em galacto-oligossacarídeos. Estes compostos causam flatulência e distúrbios gástricos quando ingeridos e podem ser degradados por suplementos de α-D-galactosidase. • β-D-galactosidade ou lactase A lactase hidrolisa moléculas de lactose formando glicose e galactose, que são dois monossacarídeos mais doces, mais digestivos e mais solúveis do que a lactose. A lactase quando produzida por fungos (Aspergillus niger) e leveduras, tem grande importância para a indústria de laticínios. Lactases comerciais são usadas na indústria no desenvolvimento de novos produtos derivados de leite. Transformam soro de queijo em xarope doce usado em alimentos como um componente de baixa fermentação, podendo servir para reposição dos xaropes de milho ou sacarose da cevada. Quando adicionadas em iogurte, coalhadas e manteiga de leite, as lactases melhoram o sabor sem aumentar o conteúdo calórico. Também são usadas para reduzir a cristalização da lactose em produtos de leite. Na fabricação de iogurte, a adição de lactase acelera o aumento da acidez, aumenta a doçura, a viscosidade e a vida de prateleira. O tratamento enzimático promove maior firmeza e maior elasticidade no requeijão e reduz o seu tempo de ajuste. No caso de queijos maturados, a suplementação com lactase envolve a redução do tempo de maturação e consequente redução dos custos. • Invertase A invertase converte a sacarose em frutose e glicose. Principais aplicações: Fabricação de xaropes, sobremesas e mel artificial. Na produção industrial, a invertase é importante para a produção de fondants, cobertura de chocolate e balas cobertas de chocolate com o centro macio • Enzimas pectinolíticas As enzimas pectinolíticas, mais freqüentemente chamadas de pectinases, correspondem a uma mistura de enziams que atuam nas substâncias pécticas (polissacarídeos vegetais que mantém a integridade da parede celular ou lamela média). Principais aplicações: Misturas de pectinases fúngicas são usadas para remover as substâncias péticas, ajudando desta forma no processo de extração de suco de frutas e clarificação. • Celulase e hemicelulases Estas enzimas são responsáveis pela decomposição dos polissacarídeos não amido - compostos fibrosos insolúveis, como celulose e hemiceluloses. As celulases fúngicas são usadas sozinhas ou em conjunto com pectinase, beta-glucanase e enzimas que degradam amido na cervejaria, processamento de suco de frutas, fermentação de alimentos, 28 enzimas.indd 28 25/8/2008 14:04:01 ENZIMAS TABELA IV - PROTEASES UTILIZADAS NA TECNOLOGIA DE ALIMENTOS Nome Procedência pH ótimo Faixa de pH de estabilidade ótima proteases animais protease pancreática a b pâncreas 9,0 3-5 pepsina mucosa estomacal 2 5,5 - 6,0 quimosina mucosa estomacal 6-7 5,5 - 6,0 4,5 - 6,5 proteases vegetais papaína Carica papaya 7-8 bromelina Ananas comosus 7-8 ficina Ficus carica 7-8 proteases bacterianas protease alcalina lisina Bacillus subtilis 7 - 11 7,5 - 9,5 protease neutra termolisina Bacillus thermoproteolyticus 6-9 6-8 c pronasa Sterptom. griseus proteases fúngicas protease neutra protease alcalina Aspergillus oryzae Aspergillus oryzae Aspergillus oryzae d 3,0 - 4,0 d 5,5 - 7,5 d 6,0 - 9,5 protease Mucor pusillus 3,5 - 4,5 protease Rhi. chinensis 5 produção de vinho e fermentação de álcool. Também têm sido usadas para melhorar a palatabilidade de vegetais de baixa qualidade, aumentar o flavor de cogumelos e alterar a textura de alimentos. As hemicelulases fúngicas (glucanase, pentosanase, xilanase, galactanase e manase) são as mais em processamento de alimentos em geral; enquanto as bacterianas são empregadas para reduzir o nível de glucanos na cevada, composto indesejável no processamento da cerveja (possibilita melhor filtração, além de complementar e/ou substituir o malte de cevada). Em panificação, encontra-se uma pequena porcentagem de pentosanas nas farinhas de trigo e centeio. As pentosanas impedem o desenvol- d vimento do glúten, que é de importância vital na formação da estrutura do pão. Hidrolisando as pentosanas, através de uma pentosanase, a massa fica mais fácil de manusear e o pão fica mais volumoso, com melhor estrutura de miolo. • Dextranase Durante a produção de açúcar, espécies de Leuconostoc podem contaminar o suco de açúcar de cana ou suco de beterraba, resultando no aparecimento de dextranas. Este polissacarídeo interfere na refinação do açúcar de beterraba e reduz a eficiência da fabricação. O aumento da viscosidade do suco contaminado é associada com o lento aquecimento, a redução da taxa de cristalização da 5 7 7-8 3-6 3,8 - 6,5 sacarose, alta turbidez, filtração lenta e presença de longos cristais de açúcar. A aplicação de dextranase fúngica durante a refinação de açúcar reduz sensivelmente estas dificuldades. * Este artigo foi desenvolvido com a rica colaboração da Prozyn Indústria e Comércio, empresa especializada na tecnologia de enzimas e outros ingredientes naturais para o desenvolvimento de soluções para a indústria de alimentos, atuando nos segmentos de panificação, moinhos de trigo, melhoradores, biscoitarias, indústrias de massas, cervejarias, produtos cárneos, laticínios, entre outros. FUNCIONAIS & NUTRACÊUTICOS protease ácida 29 enzimas.indd 29 25/8/2008 14:04:01
Download




![Bruno Albuquerque da Silva [Modo de Compatibilidade]](http://s1.livrozilla.com/store/data/000260332_1-fa0796033fc627370db0cc3b94225b99-260x520.png)