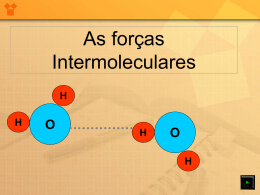
Forças intermoleculares, líquidos e sólidos As propriedades físicas das substâncias entendidas em termos de teoria cinética molecular : - Os gases são altamente compressíveis, assumem a forma e o volume do recipiente: *As moléculas de gás estão separadas e não interagem muito entre si. - Os líquidos são quase incompressíveis, assumem a forma, mas não o volume do recipiente: *As moléculas de líquidos são mantidas mais próximas do que as moléculas de gases, mas não de maneira tão rígida de tal forma que as moléculas não possam deslizar umas sobre as outras. Forças intermoleculares, líquidos e sólidos -Os sólidos são incompressíveis e têm forma e volume definidos: * As moléculas de sólidos estão mais próximas. As moléculas estão unidas de forma tão rígida que não conseguem deslizar facilmente umas sobre as outras. Forças intermoleculares, líquidos e sólidos Forças intermoleculares, líquidos e sólidos • A conversão de um gás em um líquido ou sólido requer que as moléculas se aproximem: – resfriamento ou compressão. • A conversão de um sólido em um líquido ou gás requer que as moléculas se distanciem: – aquecimento ou redução da pressão. • As forças que mantêm os sólidos e líquidos unidos são denominadas forças intermoleculares. Forças intermoleculares • A ligação covalente que mantém uma molécula unida é uma força intramolecular. • A atração entre moléculas é uma força intermolecular. • Forças intermoleculares são muito mais fracas do que as forças intramoleculares (por exemplo, 16 kJ mol-1 versus 431 kJ mol-1 para o HCl). • Quando uma substância funde ou entra em ebulição, forças intermoleculares são quebradas (não as ligações covalentes). Forças intermoleculares Forças intermoleculares Forças íon-dipolo • A interação entre um íon e um dipolo (por exemplo, água). • A mais forte de todas as forças intermoleculares. Forças intermoleculares Forças dipolo-dipolo • As forças dipolo-dipolo existem entre moléculas polares neutras. • As moléculas polares necessitam ficar muito unidas. • Mais fracas do que as forças íon-dipolo. • Há uma mistura de forças dipolo-dipolo atrativas e repulsivas quando as moléculas se viram. • Se duas moléculas têm aproximadamente a mesma massa e o mesmo tamanho, as forças dipolo-dipolo aumentam com o aumento da polaridade. Forças intermoleculares Forças dipolo-dipolo Forças intermoleculares Forças de dispersão de London • A mais fraça de todas as forças intermoleculares. • É possível que duas moléculas adjacentes neutras se afetem. • O núcleo de uma molécula (ou átomo) atrai os elétrons da molécula adjacente (ou átomo). • Por um instante, as nuvens eletrônicas ficam distorcidas. Nesse instante, forma-se um dipolo (denominado dipolo instantâneo). Forças intermoleculares Forças de dispersão de London Um dipolo instantâneo pode induzir outro dipolo instantâneo em uma molécula (ou átomo) adjacente. As forças entre dipolos instantâneos são chamadas forças de dispersão de London. Forças intermoleculares Forças de dispersão de London • Polarizabilidade é a facilidade com que a distribuição de cargas em uma molécula pode ser distorcida por um campo elétrico externo. • Quanto maior é a molécula (quanto maior o número de elétrons) mais polarizável ela é. • As forças de dispersão de London aumentam à medida que a massa molecular aumenta. • Existem forças de dispersão de London entre todas as moléculas. Forças intermoleculares Forças de dispersão de London • As forças de dispersão de London dependem da forma da molécula. • Quanto maior for a área de superfície disponível para contato, maiores são as forças de dispersão. • As forças de dispersão de London entre moléculas esféricas são menores do que entre as moléculas com formato de bastão. Forças intermoleculares Forças de dispersão de London Forças intermoleculares Forças de dispersão de London Ref. Tabela: Livro Brown Forças intermoleculares Ligação de hidrogênio • Caso especial de forças dipolo-dipolo. • A partir de experimentos: os pontos de ebulição de compostos com ligações H-F, H-O e H-N são anomalamente altos. • Forças intermoleculares são anomalamente fortes. Forças intermoleculares Ligação de hidrogênio • A ligação de hidrogênio necessita do H ligado a um elemento eletronegativo. – Os elétrons na H-X (X = elemento eletronegativo) encontram-se muito mais próximos do X do que do H. – O H tem apenas um elétron, dessa forma, na ligação HX, o H + apresenta um próton quase descoberto. – Conseqüentemente, as ligações de H são fortes. Forças intermoleculares Ligação de hidrogênio Forças intermoleculares Ligação de hidrogênio As ligações de hidrogênio são responsáveis pela: – Flutuação do gelo Os sólidos são normalmente mais unidos do que os líquidos; Portanto, os sólidos são mais densos do que os líquidos. O gelo é ordenado com uma estrutura aberta para otimizar a ligação H. Conseqüentemente, o gelo é menos denso do que a água. Na água, o comprimento da ligaçao H-O é 1,0 Å. O comprimento da ligação de hidrogênio O…H é 1,8 Å. Forças intermoleculares Líquidos: mudanças de fase Líquidos: mudanças de fase Variações de energia acompanhado as mudanças de fase Sublimação: Hsub > 0 (endotérmica). Vaporização: Hvap > 0 (endotérmica). Derretimento ou Fusão: Hfus > 0 (endotérmica). Deposição: Hdep < 0 (exotérmica). Condensação: Hcond < 0 (exotérmica). Congelamento: Hcong < 0 (exotérmica). Líquidos: mudanças de fase Variações de energia acompanhando as mudanças de fase Geralmente o calor de fusão (entalpia de fusão) é menor do que o calor de vaporização : – mais energia é gasta para separar completamente as moléculas do que para separá-las parcialmente. Líquidos: mudanças de fase Variações de energia acompanhando as mudanças de fase A sequência: aquecer sólido derreter aquecer líquido ferver aquecer gás é endotérmica. A sequência resfriar gás condensar resfriar líquido congelar resfriar sólido é exotérmica. Líquidos: mudanças de fase Durante a mudança de fase, a adição de calor não provoca nenhuma variação na temperatura. Pressão do Vapor À medida que aumenta o número de moléculas na fase gasosa, algumas das moléculas atingem a superfície e retornam ao líquido. Após algum tempo, a pressão do gás será constante à pressão de vapor. Pressão do Vapor Explicando a pressão de vapor no nível molecular Equilíbrio termodinâmico: o ponto em que tantas moléculas escapam da superfície quanto as que atingem. A pressão de vapor é a pressão exercida quando o líquido e o vapor estão em equilíbrio dinâmico. Volatilidade, pressão de vapor e temperatura Se o equilíbrio nunca é estabelecido, então o líquido evapora. As substâncias voláteis evaporam rapidamente. Pressão do Vapor Pressão do Vapor Pressão de vapor e ponto de ebulição • Os líquidos entram em ebulição quando a pressão externa se iguala à pressão de vapor. • A temperatura do ponto de ebulição aumenta à medida que a pressão aumenta. • Duas maneiras de levar um líquido à ebulição: aumentar a temperatura ou diminuir a pressão. • O ponto de ebulição normal é o ponto de ebulição a 760 mmHg (1 atm). Diagrama de Fases • Diagrama de fases: gráfico da pressão versus temperatura. Características de um diagrama de fases: – Ponto triplo: as três fases estão em equilíbrio. – Ponto crítico: temperatura e pressão críticas para o gás. Diagrama de Fases Diagrama de Fases Diagramas de fases de H2O e CO2
Baixar