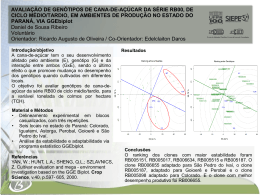
1 Universidade Federal do Tocantins Campus Universitário de Gurupi Programa de Pós-Graduação em Produção Vegetal KLEYCIANNE RIBEIRO MARQUES REAÇÃO DE GENÓTIPOS DE BATATA-DOCE À ISOLADOS LOCAIS DE Plenodomus destruens Harter, AGENTE CAUSAL DO MAL-DO-PÉ GURUPI - TO 2015 2 Universidade Federal do Tocantins Campus Universitário de Gurupi Programa de Pós-Graduação em Produção Vegetal KLEYCIANNE RIBEIRO MARQUES REAÇÃO DE GENÓTIPOS DE BATATA-DOCE À ISOLADOS LOCAIS DE Plenodomus destruens Harter, AGENTE CAUSAL DO MAL-DO-PÉ Dissertação apresentada ao Programa de Pósgraduação em Produção Vegetal da Universidade Federal do Tocantins como parte dos requisitos para a obtenção do título de Mestre em Produção Vegetal. Orientador: Prof. Dr. Ildon Rodrigues do Nascimento Co-orientador: Prof. Dr. Gil Rodrigues dos Santos GURUPI - TO 2015 3 Dados Internacionais de Catalogação na Publicação (CIP) Biblioteca da Universidade Federal do Tocantins Campus Universitário de Gurupi M342r Marques, Kleycianne Ribeiro Reação genótipos de batata-doce à isolados locais de Plenodomus destruens Harter, agente causal do mal-do-pé. / Kleycianne Ribeiro Marques. – Gurupi-TO, 2015. 54 f. Dissertação de Mestrado – Universidade Federal do Tocantins, Programa de Pós-Graduação em Produção Vegetal, 2015. Linha de pesquisa: Fitotecnia. Orientador: Prof. Dr. Ildon Rodrigues do Nascimento. 1. Ipomoea batatas. 2. Plenodomus destruens. 3. Resistência. I. Nascimento, Ildon Rodrigues do. II. Universidade Federal do Tocantins. III. Título. CDD 576.53 Bibliotecária: Glória Maria Soares Lopes CRB-2 / 592 TODOS OS DIREITOS RESERVADOS – A reprodução total ou parcial, de qualquer forma ou por qualquer meio deste documento é autorizado desde que citada a fonte. A violação dos direitos do autor (Lei nº 9.610/98) é crime estabelecido pelo artigo 184 do Código Penal. 4 Universidade Federal do Tocantins Campus Universitário de Gurupi Programa de Pós Graduação em Produção Vegetal Defesa nº 022015 ATA DA DEFESA PÚBLICA DA DISSERTAÇÃO DE MESTRADO DE KLEYCIANNE RIBEIRO MARQUES, DISCENTE DO PROGRAMA DE PÓS-GRADUAÇÃO EM PRODUÇÃO VEGETAL DA UNIVERSIDADE FEDERAL DO TOCANTINS Aos 05 dias do mês de fevereiro do ano de 2015, às 8:30 horas, no(a) Sala 15 do BALA II, reuniu-se a Comissão Examinadora da Defesa Pública, composta pelos seguintes membros: Prof. Orientador Dr. Ildon Rodrigues do Nascimento do Campus Universitário de Gurupi/ Universidade Federal do Tocantins, Prof. Dr. Gil Rodrigues dos Santos do Campus Universitário de Gurupi/ Universidade Federal do Tocantins, Prof. Dr. José Magno Queiroz Luz do Campus Universitário de Umuarama/ Universidade Federal de Uberlândia, Profa. Dra. Valéria Gomes Momenté do Campus Universitário de Palmas/ Universidade Federal do Tocantins, sob presidência do primeiro, a fim de proceder a arguição pública da DISSERTAÇÃO DE MESTRADO de Kleycianne Ribeiro Marques, intitulada "Reação de genótipos de batata-doce a isolados locais de Plenodomus destruens Harter, agente causal do mal-do-pé”. Após a exposição, a discente foi arguida oralmente pelos membros da Comissão Examinadora, tendo parecer favorável à aprovação, habilitando-a ao título de Mestre em Produção Vegetal. Nada mais havendo, foi lavrada a presente ata, que, após lida e aprovada, foi assinada pelos membros da Comissão Examinadora. Dr. Gil Rodrigues dos Santos Primeiro examinador Dr. José Magno Queiroz Luz Segundo examinador Dra. Valéria Gomes Momenté Terceiro examinador Dr. Ildon Rodrigues do Nascimento Universidade Federal do Tocantins Orientador e presidente da banca examinadora Gurupi, 05 de fevereiro de 2015. Dr. Rodrigo Ribeiro Fidelis Coordenador do Programa de Pós-graduação em Produção Vegetal 5 A meu pai, João de Deus de Souza Marques (in memorian). Sem a lembrança, sem o exemplo, sem a saudade, sem esse amor tão grande que sinto, sem essa admiração tão grande que nutro, não seria possível seguir em frente. DEDICO 6 AGRADECIMENTOS Agradeço primeiramente á Deus por me permitir chegar até aqui com proteção e saúde. A minha mãe, irmãos, sobrinhos, familiares e amigos por terem sido o motivo pelo qual tenho batalhado. Ao professor Dr. Ildon Rodrigues do Nascimento pela oportunidade, confiança, orientação, incentivo e apoio durante estes dois anos de convivência e principalmente, pelos ensinamentos transmitidos dos quais permitiram aumentar a minha admiração e respeito pelo seu trabalho. Ao professor Dr. Gil Rodrigues dos Santos, pela valiosa co-orientação, pelo incentivo, confiança, companheirismo e pelas palavras que sempre me faziam acreditar que eu poderia ir mais além. Aos professores membros da banca: Dr José Magno Queiroz Luz e Dra Valéria Gomes Momenté pela valiosa contribuição neste trabalho. A toda equipe do Núcleo de Estudos em Olericultura (NEO), por terem dividido este momento comigo, por sonharem juntos, por acreditarem. Sem vocês esta missão seria bem mais difícil e bem menos divertida. Não há palavras que possam expressar a gratidão que sinto. Fizemos um grande trabalho!!! Obrigada: Tiago, Kerolayne, Valdilene, Aline, Samara, Laíla, Danilo, Filipe, Edilson, Prinscilla, Lôla, Luís, Kellen, João, Daniela, Gabriel, Gerceu, Jânio, Lucas, Eduardo e Edgard. A equipe do Laboratório de Fitopatologia pela valiosa e generosa contribuição nas avaliações. Obrigada por tudo: Dalmárcia, Ronice, Jaíza, Emerson, Jhonatan, Rosângela e Solange. A Gislaia Amorim (Gi), pela amizade sincera e por sempre se fazer presente em minha vida. Obrigada por me aturar, por me ouvir, por me permitir ser eu. Obrigada por tudo! A companheira e parceira de todas as horas Leila Paula Tonello, por ter compartilhado os melhores e os piores momentos dessa trajetória. Pelas alegrias, pelas decepções... Enfim, não há como descrever a sensação de ter compartilhado isto com você. Essa conquista é nossa! Ao meu grande amigo Ismael, por ter sido minha referência, meu exemplo, meu anjo da guarda, meu conselheiro. 7 A todos os colegas do PPGPV pela amizade e convivência agradável. Em especial: Álida, Márcio Nikkel, Otávio, Sérgio, Mauro, Gaspar, Antônio Carlos, Carlos Augusto, André Gonçalves, Marllos e Junior César. Aos amigos de graduação que ainda se fazem presentes: Gilberto, Evaldo e Gabriela. Aos professores Clóvis Maurílio e Marcela da Silveira pelo incentivo e apoio durante a graduação e pós-graduação. Vocês foram os culpados por eu ter chegado até aqui. Eu não sei o que seria de mim sem vocês. Ao Professor Dr. Rodrigo de Castro Tavares pelo apoio incondicional durante a condução do experimento. A todos os professores da UFT. A Universidade Federal do Tocantins pela oportunidade de concluir o Mestrado em Produção Vegetal e ao CNPq pela concessão da bolsa de estudos. A todos que, direta ou indiretamente, contribuíram para a realização deste trabalho. 8 RESUMO GERAL Com o objetivo de avaliar a reação fenotípica de genótipos de batata-doce foram conduzidos três experimentos que foram divididos em dois capítulos. O primeiro capítulo é composto pelas avaliações realizadas através de experimentos conduzidos em laboratório e casa de vegetação. O primeiro experimento foi conduzido no Laboratório de Fitopatologia da Universidade Federal do Tocantins, onde foram analisados 26 isolados de Plenodomus destruens Harter (Mal-do-pé) e dois genótipos de batata-doce (BDFMI#40 e 2007HSF1405) que após serem inoculados com todos os isolados, foram selecionados os isolados mais agressivos. Nesse ambiente, os isolados mais agressivos foram Gurupi 10, Gurupi 11 e Gurupi 2 para o genótipo BDFMI#40. Os isolados mais agressivos para o genótipo 2007HSF1405 foram Gurupi 8 e Gurupi 2. Após selecionados, os isolados mais agressivos foram inoculados em 36 genótipos de batatadoce (BDFMI#04, BDFMI#10, BDFMI#11, BDFMI#14, BDFMI#16, BDFMI#28, BDFMI#31, BDFMI#36, BDFMI#38, BDFMI #40, BDFMI#42, BDFMI#51, BDFMI#57, BDFMI#58, BDFMI#59, BDFMI#70, BDFMI#78, BDFMI#88, BDFMI#89, BDFMI#93, BDFMI#94, BDFMI#106, 2007HSF0128, 2007HSF0613, 2007HSF0906, 2007HSF1031, 2007HSF1035, 2007HSF1105, 2007HSF1405, 2007HSF2210, Princesa, Itajuba, Amanda, Duda, Júlia e Marcela) em casa de vegetação. De cada genótipo foram obtidas mudas de mini-estacas com dois nós que foram inoculadas aos 20 dias após plantio utilizando solução com esporos de 1,6x106 conídios mL-1. Quatro dias após a inoculação, a agressividade foi avaliada. A cultivar Júlia foi a que apresentou maior suscetibilidade ao mal-do-pé em casa de vegetação. O isolado Gurupi 11 foi mais agressivo que o isolado Gurupi 10. O segundo capítulo é composto por avaliações realizadas em campo. Foram avaliados 20 genótipos de batatadoce (BDFMI#04, BDFMI#10, BDFMI#16, BDFMI#31, BDFMI#38, BDFMI#40, BDFMI#51, BDFMI#57, BDFMI#70, BDFMI#89, BDFMI#93, BDFMI#94, BDFI#106, 2007HSF0128, 2007HSF1405, Amanda, Duda, Itajuba, Marcela e Princesa). O delineamento experimental foi em blocos casualizados com 20 tratamentos e três repetições. Os dados avaliados foram produtividade total de raízes, massa seca da raiz, severidade e Área Abaixo da Curva de Progresso da Doença (AACPD). Na presença de mal-do-pé, os genótipos mais produtivos foram BDFMI#16, Duda, BDFMI#04, BDFMI#93 e 2007HSF0128. O teor de matéria seca das raízes variou de 20,39 a 51,97%. Os genótipos com maiores níveis de resistência genética foram BDFMI#57, BDFMI#40 e Princesa. Palavras-chave: Ipomoea batatas L. Lam, Patogenicidade, P. destruens, Agressividade, Isolados, Seleção. 9 GENERAL ABSTRACT In order to assess the phenotypic response of sweet potato genotypes were conducted three experiments which were divided into two chapters. The first chapter consists of the evaluations carried out by experiments conducted in the laboratory and greenhouse. The first experiment was conducted in Phytopathology Laboratory of the Universidade Federal do Tocantins, which analyzed 26 isolates Plenodomus destruens Harter (Footrot) and two sweet potato genotypes (BDFMI#40 and 2007HSF1405). which, after being inoculated with all isolates, the most aggressive isolates were selected. In this environment, the most aggressive isolates were Gurupi 10, Gurupi 11 and Gurupi 2 for BDFMI#40 genotype. The most aggressive isolates for 2007HSF1405 genotype were Gurupi 8 and Gurupi 2. After selected, the most aggressive isolates were inoculated in 36 sweet potato genotypes in a greenhouse (BDFMI# 04, BDFMI#10, BDFMI#11, BDFMI#14, BDFMI#16, BDFMI#28, BDFMI#31, BDFMI#36, BDFMI#38, DFMI#40, BDFMI#42, BDFMI#51, BDFMI#57, BDFMI# 58, BDFMI#59, BDFMI#70, BDFMI#78, BDFMI#88, BDFMI#89, BDFMI#93, BDFMI#94, BDFMI#106, 2007HSF0128, 2007HSF0613, 2007HSF0906, 2007HSF1031, 2007HSF1035, 2007HSF1105, 2007HSF1405, 2007HSF2210, Princesa, Itajuba, Amanda, Duda, Julia and Marcela). Each genotype of mini-cuttings seedlings were obtained with two nodes that were inoculated 20 days after planting using solution with 1,6x106 conidies mL-1. Four days after the inoculation, the aggressiveness was evaluated. The cultivar Julia showed the greater susceptibility to foot-rot in greenhouse. The isolated Gurupi 11 was more aggressive than the isolated Gurupi 10. The second chapter consists of evaluations performed in production field. There were 20 sweet potato genotypes (BDFMI#04, BDFMI#10, BDFMI#16, BDFMI#31, BDFMI#38, BDFMI#40, BDFMI#51, BDFMI#57, BDFMI#70, BDFMI#89, BDFMI#93, BDFMI# 94, BDFMI#106, 2007HSF0128, 2007HSF1405, Amanda, Duda, Itajuba, Marcela and Princesa). The experimental design was a randomized block with 20 treatments and three replications. The data included total yield of roots, root dry mass, severity and area under disease progress curve (AUDPC). In the presence of foot-rot the most productive genotypes were BDFMI#16, Duda, BDFMI#04, BDFMI#93 and 2007HSF0128. The dry matter content of the roots ranged from 20,39 to 51,97%. The genotypes with greater genetic resistance levels were BDFMI#57, BDFMI#40 and Princesa. Keywords: Ipomoea batatas L. Lam, Pathogenicity, P. destruens, Aggressiveness, Isolated, Selection. 10 LISTA DE TABELAS Capítulo I: Tabela 1: Médias para tamanho da lesão (em cm) em dois genótipos de batata-doce inoculados com isolados locais de P. destruens. Gurupi, UFT, 2014. ........................... 34 Tabela 2: Comprimento médio da lesão (cm) em genótipos de batata-doce à dois isolados de mal-do-pé. Gurupi, UFT, 2014. ................................................................. 37 Capítulo II: Tabela 1: Características químicas do solo na profundidade de 0-20 cm do local onde foi conduzido o ensaio de avaliação dos genótipos de batata-doce em Gurupi, região sul do estado do Tocantins. UFT, Gurupi-TO, 2014............................................................... 45 Tabela 2: Médias para produtividade e teor de matéria seca (MS) em genótipos de batata-doce. UFT, Gurupi, 2014. ................................................................................. 47 Tabela 3: Severidade e Área Abaixo da Curva de Progresso da Doença (AACPD) em genótipos de batata-doce em condições de campo em Gurupi, região sul do estado do Tocantins. UFT, Gurupi, 2014..................................................................................... 50 11 LISTA DE FIGURAS Figura 1: Estrutura reprodutiva de P. destruens, agente causador do mal-do-pé em batata-doce. UFT, Gurupi. Santos, G.R., 2013. ............................................................ 17 CAPÍTULO I Figura 1: Severidade média de mal-do-pé causado por diferentes isolados de P. destruens em genótipos de batata-doce. UFT. Gurupi, 2014. ....................................... 35 CAPÍTULO II Figura 1: Curvas de progresso do mal-do-pé em genótipos de batata-doce expressas no tamanho do tecido vegetal lesionado em função do tempo. UFT, Gurupi-TO, 2014. .... 49 12 SUMÁRIO 1.INTRODUÇÃO GERAL ....................................................................................... 13 2.REFERENCIAL TEÓRICO ................................................................................. 14 2.1. A cultura da batata-doce ................................................................................... 14 2.2 Mal do pé (Plenodomus destruens)..................................................................... 16 2.3 Melhoramento genético de batata-doce para resistência a doenças ................. 18 3.REFERÊNCIAS BIBLIOGRÁFICAS .................................................................. 20 CAPÍTULO I 1.INTRODUÇÃO ...................................................................................................... 29 2.MATERIAL E MÉTODOS ................................................................................... 30 2.1. Experimento 1: Seleção de isolados de P. destruens quanto a agressividade a batata-doce 30 2.2. Experimento 2: Suscetibilidade de genótipos de batata-doce a isolados locais de mal-do-pé ............................................................................................................. 32 3.RESULTADOS E DISCUSSÃO ............................................................................ 33 4.CONCLUSÕES ...................................................................................................... 38 5.REFERÊNCIAS BIBLIOGRÁFICAS .................................................................. 38 CAPÍTULO II 1.INTRODUÇÃO ..................................................................................................... 43 2.MATERIAL E MÉTODOS ................................................................................... 44 3.RESULTADOS E DISCUSSÃO ............................................................................ 46 4.CONCLUSÕES ...................................................................................................... 51 5.REFERÊNCIAS BIBLIOGRÁFICAS .................................................................. 51 13 INTRODUÇÃO GERAL A batata-doce (Ipomoea batatas L. (Lam)) é uma planta dicotiledônea, autohexaplóide, originária da América do Sul e pertencente à família Convolvulacea. É considerada a espécie economicamente mais importante dessa família (FABRI, 2009). Apresenta fundamental importância social e econômica para diversos países, devido seu elevado teor nutricional. No Brasil, é cultivada em praticamente todos os estados, destacando-se as regiões sul e nordeste, onde se constitui uma importante fonte de alimento. É a sexta olerícola mais produzida no país com produtividade média em torno de 11, 9 Mg ha -1 (CNPh, 2013). É uma espécie perene, resistente a pragas, com custos de produção relativamente baixos, desenvolve-se bem em solos de pouca fertilidade, com sistemas de reprodução e plantio por ramas e adaptada às condições tropicais e subtropicais. ocorrendo a morte natural da planta somente na ocorrência de condições climáticas severas, como geada e seca prolongada. De acordo com Peixoto et al. (1999), é uma das plantas de raiz tuberosa mais cultivada pelo homem, e seu cultivo se destina as mais diversas formas de utilização. É largamente utilizada na alimentação humana, animal (MASSAROTO, 2008; VIANA et al, 2011) e como matéria prima nas indústrias de alimento, tecido, papel, cosméticos, preparação de adesivos (CEREDA et al., 2001) e etanol (ARAÚJO,1978; MENEZES, 1980; CEREDA et al., 1987, MOMENTÉ et al., 2004; CARDOSO et al, 2005; SILVEIRA, et al., 2007; ZISKA et al.,2009; TIAN et al., 2009). Mesmo apresentando elevado potencial produtivo, demonstrado por produtividades experimentais relatadas até 98 Mg ha -1 (GONÇALVES-NETO, 2010), são comuns no Brasil relatos de baixas produtividades, devidas em parte à utilização de material genético contaminado com patógenos e/ou obsoleto, na maioria dos casos suscetível as pragas e doenças, o que é potencializado pelo fato de a cultura ser propagada através de estacas das ramas, perpetuando a degenerescência (KROTH et al., 2004). O uso de baixo nível tecnológico por parte dos agricultores, também leva a produtividades aquém da mínima desejável (SILVA et al., 2004). Outro fator que também contribui para a baixa produtividade da cultura são as doenças. Dentre estas, o mal-do-pé, causada pelo fungo Plenodomus destruens Harter é 14 considerada uma das mais importantes, devido a gravidade dos danos causados (COELHO et al., 2005). Infecções graves causadas pelo patógeno em cultivares suscetíveis podem reduzir em até 80% do rendimento da cultura, especialmente em áreas onde o cultivo da batata-doce é intenso e sucessivo (CLARK et al., 2009). As alternativas de controle destas doenças envolvem a adoção de tratos culturais como o plantio de ramas sadias. Entretanto, a medida mais eficiente de controle das doenças é a resistência genética das variedades. Para isso, programas de melhoramento genético devem ser preconizados com o objetivo de obter genótipos produtivos e resistentes. O uso de variedades resistentes é a forma mais econômica e eficiente de controle de doenças, além de não onerar o custo de produção e serem de fácil adoção por parte dos produtores. Desta forma, o objetivo do trabalho foi avaliar a reação de genótipos de batatadoce a isolados locais de mal-do-pé em condições de laboratório, casa de vegetação e campo. REFERENCIAL TEÓRICO 2.1. A cultura da batata-doce A batata-doce (Ipomoea batatas L. (Lam)) é originária das Américas Central e do Sul. É uma espécie dicotiledônea pertencente à família Convolvulacea, que agrupa aproximadamente 50 gêneros e mais de 1000 espécies, sendo que, somente a batatadoce tem cultivo de expressão econômica. Segundo dados da Food and Agriculture Organization – FAO (2008), esta espécie é cultivada em 111 países, sendo que aproximadamente 90% da produção é obtida na Ásia, apenas 5% na África e 5% no restante do mundo. É considerada a sétima cultura de maior produção mundial, sendo a China o país que mais produz batata-doce, representando 82,8% da produção mundial, com produtividade média de 21,3 Mg ha -1 de raízes. O Brasil é o principal país produtor da América Latina com uma produção anual de 544.820 Megagramas, obtidas em uma área plantada estimada em 43.879 hectares (IBGE, 2012). Os estados de maiores produções são Rio Grande do Sul, Santa Catarina, Bahia e Paraná. Devido à redução da área plantada e ao êxodo rural, têm se notado uma significativa redução no cultivo desta cultura nas últimas décadas (SILVA 15 et al., 2004). Apesar desse cenário a cultura ocupa sexto lugar entre as hortaliças mais plantadas no Brasil. Apresenta elevado valor nutritivo, sendo fonte de vitaminas A, B, e C e amido. É uma planta de usos múltiplos, da qual todas as partes são aproveitáveis e, além de seu uso na alimentação humana in natura ou processada industrialmente, nas formas de amido, macarrão e farinha. Pode ainda ser utilizada na alimentação animal (MASSAROTO, 2008; VIANA et al, 2011), contém nutrientes com potencial terapêutico (GUEDES, 2004) e constitui-se como uma importante alternativa para a produção de biocombustíveis (MOMENTÉ et al., 2004). Possui caule herbáceo, sendo de hábito de crescimento rasteiro, com ramificações que podem variar em tamanho, cor e pilosidade. Apresenta folhas largas, com formato, cor e recortes variáveis. A parte aérea é constituída por uma vegetação agressiva, com grande massa foliar, forma boa cobertura do solo e compete vantajosamente com plantas invasoras. Possui flores com cinco pétalas e cinco sépalas, são hermafroditas, porém de fecundação cruzada devido ao mecanismo de autoincompatibilidade, que reforça a alogamia e aumenta a heterozigosidade genética (THOMPSON et al., 1997; DAROS et al., 2002). Esta incompatibilidade aparentemente está relacionada a falhas de germinação e penetração do grão de pólen no estigma, e também a um determinado grau de esterilidade, provavelmente provocado pelo alto nível de ploidia (2n=2x=90) (MARTIN, 1970). O gineceu apresenta dois lóculos, com dois ovários em cada um, e o androceu apresenta cinco estames desiguais. Os frutos são do tipo cápsula globosa, seca e bilocular medindo cerca de 6 mm de diâmetro e de cor castanho-claro. São deiscentes e apresentam até 4 sementes. As sementes são pequenas, arredondadas e de coloração escura. Apresentam tegumento bastante duro que dificulta a germinação, não apresenta período de dormência, mas mantém-se viável por até 20 anos (RISTCHEL et al, 1999). O sistema radicular é formado por raízes fibrosas, responsáveis pela absorção de água e nutrientes, e as raízes tuberosas, que acumulam reservas e constituem a parte comercial da planta. Estas raízes podem apresentar formatos, cores da película externa e cores de polpa distintas (HUAMÁN, 1992). É por causa desse tipo de sistema radicular que a batata-doce é uma cultura olerácea altamente resistente à seca (FILGUEIRA, 2008). 16 A propagação desta planta pode ser feita através de mudas, estacas, sementes botânicas e cultura de tecidos. Porém, as ramas constituem o meio de propagação mais recomendado para cultivo comercial por ser mais econômico e manter as características genéticas do material vegetal. Os espaçamentos mais utilizados variam de 80 a 100 cm dentre leiras e de 25 a 40 cm entre plantas. As ramas ou as mudas são plantadas sobre leiras ou camalhões, de 20 a 30 cm de altura para facilitar a drenagem e aeração do solo, tratos culturais e colheita. As necessidades de adubação mineral na cultura da batata-doce são em ordem decrescente: Potássio, Nitrogênio, Fósforo Cálcio e Magnésio. Vários experimentos realizados no Brasil e no exterior, indicam que para a produção de 13 a 15 Mg ha -1 de raízes, a batata-doce extrai do solo cerca de 60 a 113 kg de Nitrogênio; 20 a 45,7 kg de Fósforo (P2O5); 100 a 236 kg de Potássio (K2O); 31 a 35 kg de Cálcio (CaO) e 11 kg de Magnésio. Para a produção de 30 Mg ha-1 de raízes, a cultura extrai 129 kg de Nitrogênio; 50 kg de (P2O5) e 25 kg de (K2O) (MIRANDA et al., 1995; SILVA, 2013). Contudo deve-se considerar que a extração de nutrientes depende da cultivar, das características químicas e físicas do solo, do clima e do ciclo da cultura. Para um bom desenvolvimento vegetativo a planta exige temperatura média superior a 24 ºC, alta luminosidade e fotoperíodo longo. É uma cultura que não tolera geada. Quanto ao regime pluvial, a cultura deve ser implantada em locais com precipitação média de 750 a 1.000 mm anuais ou 500 a 600 mm durante o ciclo. Os principais tratos culturais são capinas e amontoas. Os plantios devem ficar livre de plantas daninhas para produzir bem, principalmente até os 45 dias após o plantio, que é o período em que ocorre maior competição (OLIVEIRA et al., 2005). 2.2 Mal do pé (Plenodomus destruens Harter) A primeira associação patogênica de Plenodomus destruens Harter em batata- doce foi relatada por Harter, em 1913 nos Estados Unidos, a partir de observações em lavouras de batata-doce que apresentavam plantas doentes, onde foi constatada uma nova doença denominada de Podridão-do-pé ou Mal-do-Pé (Foot rot). Este nome foi aplicado a esta doença, uma vez que apenas a base ou pé da planta era a parte comumente atacada. A partir de então, vários relatos desta doença foram feitos. 17 No Brasil, é considerada uma das mais importantes devido a gravidade dos danos causados (COELHO et al., 2005), chegando a reduzir em até 80% o rendimento da cultura (CLARK et a.l, 2009). Ocorre em praticamente todas as regiões de cultivo, principalmente, nas áreas de cultivo intensivo (MENDES et al., 2012). Temperaturas superiores a 20º C e alta umidade favorecem a disseminação deste patógeno. Os sintomas nas mudas e plantas no campo caracterizam-se por cancros marrons escuros na região do colo e o anelamento da haste próxima à linha do solo, além do amarelecimento e murcha das folhas da base. Em infecções severas ocorre destruição do sistema radicular, impedindo a formação de raízes tuberosas. Nas regiões do caule afetadas, verifica-se o surgimento de várias pontuações escuras, correspondentes a estruturas de reprodução do patógeno (picnídios). As lesões na haste podem se desenvolver abaixo do nível do solo e o fungo penetrar na raiz tuberosa, causando, na extremidade proximal, uma podridão seca e escura de desenvolvimento lento. Este sintoma tende a evoluir durante o armazenamento, danificando parcialmente as raízes tuberosas e tornando-as imprestáveis para utilização na produção de mudas. Figura 1: Cirros conidiais de Plenodomus destruens, agente causador do mal-do-pé em batata-doce. UFT, Gurupi. Santos, G.R., 2013. O mal-do-pé tem como agente etiológico o fungo Plenodomus destruens Harter, que é muito confundido com Phomopsis, estádio sexual do fungo Diaporthe, agente causal da podridão seca em batata-doce (PEREIRA, 2011). A diferenciação deste 18 gênero em relação a Phomopsis é feita com base na forma e número de paredes do picnídio. Picnídios de Plenodomus possuem duas paredes, uma parede externa escura e uma parede interna transparente, enquanto picnídios de Phomopsis possuem quatro paredes. A fase teleomórfica não foi ainda descrita para o gênero Plenodomus. P. destruens pertence à classe dos Deuteromycetes (Fungos Mitospóricos), ordem Sphaeropsidales, família Sphaeropsidaceae, têm como características morfológicas picnídios escuros, produzidos de forma isolada ou agrupada, com rostro alongado. Os conídios são unicelulares, oblongos, medindo 6-10 x 3-4 µm. Ocasionalmente, pode produzir clamidósporos pigmentados isolados ou agregados. A disseminação ocorre através de ramas e raízes tuberosas infectadas, ventos acompanhados de chuva, insetos e outras formas de disseminação passiva indireta. A sobrevivência do patógeno ocorre em restos de cultura e raízes infectadas durante o período do armazenamento. A adubação orgânica, promovida pelo esterco de gado, composto de lixo e, principalmente, cama de frango, pode acentuar a severidade da doença. Nas infecções do caule, o período entre inoculação e expressão dos sintomas varia entre 30 e 35 dias. Este fungo tem sido relatado como patogênico somente em espécies da família Convolvulaceae. As medidas de controle dessa doença consistem na utilização de cultivares resistentes e no uso do material de propagação proveniente de plantas sadias. A escolha do local de plantio (solos não infestados e bem drenados), o arranquio e queima de plantas doentes e a rotação de culturas por dois ou três anos consecutivos são medidas de caráter preventivo. Ramas retiradas das partes mais novas das plantas resultam em menor incidência de doença. É importante também evitar adubação orgânica em campos onde se verifica a incidência da doença. A adubação nitrogenada em excesso também predispõe as plantas à infecção pelo patógeno. Atualmente não existem fungicidas registrados no Ministério da Agricultura, Pecuária e Abastecimento (MAPA) para o controle do mal-do-pé. 2.3 Melhoramento genético de batata-doce para resistência a doenças As doenças constituem os principais fatores limitantes do rendimento e da qualidade da produção e, também, são as que exigem maior conhecimento técnico para controle. A estratégia mais eficaz e econômica de controle de doenças é a utilização de cultivares resistente, que só é permitida graças ao melhoramento genético. 19 A batata-doce foi uma das hortaliças mais cultivadas em períodos que não se utilizavam agrotóxicos, fato que comprova sua resistência natural a pragas e doenças. Essa característica foi comprovada por Muller e Borger (1940) e Woolfe (1992), que descobriram a presença de fitoalexinas, que funcionavam como antibióticos naturais quando a planta era atacada por algum fungo patogênico ou por alguma praga. A partir de então, foi constatado que a planta reagia ao ataque produzindo sesquiterpeno, tornando o tecido vegetal amargo e com odor forte (SCHNEIDER et al, 1984). Devido sua grande variabilidade genética, a batata-doce permite a seleção para vários propósitos, como obtenção de materiais resistentes a pragas e doenças (AZEVEDO et al, 2002), maior teor de matéria seca e produção de biomassa, que podem proporcionar maior rendimento para a produção de etanol e maior produção de ramas para alimentação animal. De acordo com Hersey e Amaya (1982), a utilização eficiente da variabilidade genética dessa cultura depende, entre outros fatores, de uma coleção de germoplasma bem mantida e com a caracterização de cada acesso, além disso, são necessários ensaios para avaliar os melhores materiais que serão conduzidos em condições representativas de cultivo. Devido a sua ampla disseminação nas diversas regiões do Brasil, inclusive em comunidades indígenas mais isoladas, há um grande número de genótipos espalhados por todo o território nacional. Muitas vezes, uma mesma cultivar recebe nomes diferentes de região para região ou cultivares diferentes recebendo o mesmo nome, encobrindo materiais de diferentes constituições genéticas (CARDOSO et al, 2005). Nos últimos anos, diversas pesquisas têm sido realizadas no Brasil com o intuito de se obter cultivares de batata-doce resistente a doenças. Várias cultivares e clones foram selecionados para resistência a nematoides. As cultivares Palmas e Canuanã, que foram lançadas a partir de estudos realizados por Silveira (1993) e Azevedo (1995), apresentaram resistência varietal ao ataque de nematoides e apresentaram resistência moderada aos insetos de solo. Porém, Charchar & Ritschel (2004), já descreveram novas espécies de nematoides de galhas com a habilidade de quebrar a resistência dessas cultivares. Em 1989, a Empresa Brasileira de Pesquisas Agropecuárias (EMBRAPA), lançou a cultivar „Princesa‟ como fonte de resistência a P. destruens (Lopes e Silva, 1993; Truta et al., 2000). Mas, estudos desenvolvidos por Cavalcanti et al, (2002) e 20 Mendes et al., (2012), mostraram resultados contrários, sendo constatada influência do método de inoculação na reação de resistência desta cultivar. Para os programas de melhoramento de batata-doce os principais objetivos são aumentar a produtividade, aumento do teor de amido, resistência a insetos de solo (SILVEIRA et al., 2009) e resistência a doenças. Sendo assim, busca-se selecionar genótipos resistentes a P. destruens para o Estado do Tocantins, tendo em vista a observação de significativas perdas que esse patógeno tem causado nos plantios da região. REFERÊNCIAS BIBLIOGRÁFICAS ARAÚJO, N. Q. “Batata-doce: parâmetros preliminares na tecnologia de produção de etanol”. (S.L.), 1978. 11 p. AZEVEDO, S. M. Avaliação de famílias de meio-irmãos de batata-doce (Ipomoea batatas L.) quanto a resistência aos nematóides do gênero Meloidogyne e insetos de solo. Dissertação (tese em Crop Science) – Universidade Federal de Lavras, Lavras, MG, 1995. AZEVEDO, S.M. MALUF, W.R.; SILVEIRA, M.A., FREITAS, J.A. Reação de clones de batata-doce aos insetos de solo. Ciência e Agrotecnologia, v. 26, n.3, p. 545-549, 2002. CAVALCANTI, L.S.; COÊLHO, R.S.B; PEREZ, J.O. Reação de cultivares de batatadoce à podridão-do-pé, em condições de campo. Ciência Rural, Santa Maria, v. 32, n. 4, p. 699-701, 2002. CARDOSO, A.D.; VIANA, A. E. S.; RAMOS, PAS.; MATSUMOTO, S.N.; AMARAL, CLF.; SEDIYAAMA, T.; MORAIS, O. M. Avaliação de clones de batatadoce em Vitória da Conquista. Horticultura Brasileira, v. 23, n. 4, p. 911-914, 2005. CEREDA, M. P.; FRANÇA, F.H.; LOPES, C.A.; JABUONSKI, R.E. Potencialidade e qualidade da batata-doce para industrialização. 2 ed. Seminário sobre a cultura da 21 batata-doce. Brasília: EMBRAPA-CNPH, 1987. p. 24-36. CEREDA, M.P.; FRANCO, C.M.L.; DAIUTO, E.R.; DEMIATE, J.M.; CARVALHO, LJCB.; LEONEL, M. VILPOUX, D.F.; SARMENTO, S.B.S. Propriedades gerais do amido. Campinas: Fundação Cargill, 2001. CENTRO NACIONAL DE PESQUISAS EM HORTALIÇAS, CNPH. 2013. Produção de hortaliças no Brasil. Disponível em: http://www.cnph.embrapa.br/paginas/hortalicas_em_numeros/producao_hortalicas.pdf. Acesso em 22/10/2014. CHARCHAR, JM.; RITSCHEL, PS. Avaliação do banco de germoplasma de Batatadoce da Embrapa hortaliças para resistência a Meloidogyne spp. Brasília: EMBRAPA/CNPH, 2004. 28p. (Boletim de Pesquisa e Desenvolvimento). CLARK, C. A.; HOLMES, G. L.; FERRIN, D. M. Major fungal and bacterial diseases. In: LOEBENSTEIN, G.; TROTTAPPILLY, G. (Ed.). The sweetpotato. Springer: Netherlands, 2009. p. 81-103. COELHO, R. S. B.; PIO-RIBEIRO, G.; MARIANO, R. L. R. Doenças da batata-doce (Ipomoea batatas) In: KIMATI, H.; AMORIN, L.; REZENDE, J. A. M.; BERGAMIN FILHO, A.; CAMARGO, L. E. A. Manual de fitopatologia: doenças de plantas cultivadas. 4. ed. São Paulo: Agronômica Ceres, 2005. v. 2, p. 143-149. DAROS, M.; AMARAL JR, AT.; PEREIRA, TNS.; LEAL, NR.; FREITAS, SP.; SEDIYAMA, T. Caracterização morfológica de acessos de batata-doce. Horticultura Brasileira, Brasília, v. 20, n. 1, p. 43-46, 2002. FABRI, E. G. Diversidade genética entre acessos de batata-doce (Ipomoea batatas L. Lam) avaliada através de marcadores microssatélites e descritores morfoagronômicos. Piracicaba, 2009. 172p. Tese (Doutorado em Agronomia) – Escola Superior de Agricultura “Luiz de Queiroz”, Universidade de São Paulo. 22 FILGUEIRA, F. A. R. Novo Manual de Olericultura. Agrotecnologia moderna na produção e comercialização de hortaliças. 3ª Ed. Viçosa. UFV. 2008. 371-376p. FOOD AND AGRICULTURE ORGANIZATION OF THE UNITED NATIONS. 2008. Disponível em: http://faostat.fao.org/site/339/default.aspx Acesso em: 03 de SETEMBRO de 2014. GONÇALVES NETO, A.C. Aptidões para consumo humano, produção de etanol e alimentação animal em clones de batata-doce. Tese (Pós Graduação em Agronomia). Universidade Federal de Lavras, Lavras (MG), 2010. GUEDES, M.C. Antocianinas: pigmento natural ou remédio? Revista Científica do IMAPES, p. 71-73. 2004. HERSEY, C.; AMAYA, A. Germoplasma de yuca: evolucion, distribiuicion y colección. In: CENTRO INTERNACIONAL DE AGRICULTURA TROPICAL. Yuca, investigación, producción y utilización. Cali, 1982. P. 77- 89. HUAMÁN, Z. Systematic botany and morfology of the sweetpotato plant. Lima: CIP, 22p. (CIP, Technical Information Bulletin, 25). 1992. IBGE - INSTITUTO BRASILEIRO DE GEOGRAFIA E ESTATÍSTICA, MINISTÉRIO DO PLANEJAMENTO, ORÇAMENTO E GESTÃO - Produção agrícola municipal, culturas temporárias e permanentes, Prod. agric. Munic (2011). Rio de Janeiro, v. 38, p.1-97, 2012. KROTH, L. L.; DANIELS, J.; PIEROBOM, C.R. Degenerescência da batata‑doce no Rio Grande do Sul. Revista Brasileira de Agrociência, v. 10, p. 79-82, 2004. LOPES, C.A.; SILVA, J.B.C. Management measures to control foot roto f sweet potato caused by Plenodomus destruens. Internacional Journal of Pest Management, v. 39, n. 1, p. 72-74, 1993. 23 MARTIN, F.W. Sterility in some species related to the sweetpotato. Euphytica, 19:459-464, 1970. MASSAROTO, JA. Características agronômicas e produção de silagem de clones de batata-doce. Tese. Pós Graduação em Agronomia-Fitotecnia. Lavras, MG. UFLA, 2008. 85p MENDES, L.S.; PEREIRA, R.B., AMARO, G.B., PINHEIRO, J.B. – Reação de Cultivares de Batata-doce ao Mal-do-pé. II Jornada Científica da Embrapa Hortaliças, 31 de julho e 1 de agosto. Embrapa Hortaliças 2012. MENEZES, T. J. B. Etanol, o combustível do Brasil. São Paulo: Ed. Agronômica Ceres, 1980. 95 p. MIRANDA, J.E.C.; FRANÇA, F.H.; CARRIJO, O.A.; SOUZA A.F.; PEREIRA, W.; LOPES, C.A. Batata-doce (Ipomoea batatas (L) Lam). Brasília; EMBRAPA/CNPH, 1989. 20 p. (EMBRAPA. Circular Técnica, 3). Disponível em: <http://www.cnph.embrapa.br/cultivares>. Acesso em 10/10/2014. MIRANDA, J. E. C; FRANÇA, F. H.; CORRIJO O. A.; SOUZA, A. F.; PEREIRA, W.; LOPES,C. A.; SILVA, J. B. C. A cultura da batata doce. Brasília: EMBRAPA. 1995. 94p. (coleção plantar). MULLER, K. O.; BORGER, H. Experimentelle untersuchugen uber die Phytophtoraresistenz der kartoffel. Arbiten der Biologischen Reichsaustalt, Land-und Forstwirschaft, v. 23, p. 189-231, 1940. MOMENTÉ, V.G.; RODRIGUES, S.C.S.; TAVARES, I.B.; SILVEIRA, M.A.; SANTANA, W.R. Desenvolvimento de cultivares de batata-doce no estado do Tocantins, visando à produção de álcool, como fonte alternativa de energia para as condições tropicais. Horticultura Brasileira, Brasília, v. 22, n. 2, p. 340-342, jul. 2004. Suplemento. 24 OLIVEIRA, A. P.; OLIVEIRA, M. R. T; BARBOSA, J. A.; SILVA, G. G; NOGUEIRA, D. H.; MOURA, M. F.; BRAZ, M. S. S. Rendimento de e qualidade de batata-doce adubada com níveis de uréia. Horticultura brasileira, v. 23, n. 4, p. 925928. 2005. PEIXOTO, JR; SANTOS, L.C.; RODRIGUES, F.A.; JULIATTI, F.C.; LYRA, J. R. M. Seleção de clones de batata-doce resistente a insetos de solo. Pesquisa Agropecuária Brasileira, Brasília, v. 34, n. 3, 1999. PEREIRA JÚNIOR, LR.; OLIVEIRA, AP.; GAMA, JSN.; CAMPOS, VB.; PRAZERES, SS. Parcelamento do esterco bovino na produção de batata-doce. Revista Verde. Mossoró, v.3, n.3, p12- 16 julho/setembro de 2008. PEREIRA, RB.; FERNANDES, FR.; PINHEIRO, JB. Recomendações para manejo da podridão-do-pé em batata-doce. Comunicado Técnico. EMBRAPA, 2011. RITSCHEL, OS.; HUAMÁN, Z.; LOPES, C.A.; MENÊZES, J.E.; TORRES, A.C. Catálogo de germoplasma de batata-doce: I. Coleção mantida pela Embrapa Hortaliças. Brasília: Embrapa-CNPH, 1999. 47. P. SCHNEIDER, J.A.; LEE, J.; NAYA, Y,. NAKAMISHI, K.; OBA, K.; URITANI, I. The fate of the phytoalexin ipomeamarone: furanoterpenes and butenolides from Ceratocystis fimbriata infected sweet potatoes. Phytochemistry, v. 23, n. 4, 1984. 759764p. SILVA, J. B. C.; LOPES, C. A.; MAGALHÃES, J. S. Cultura da batata doce. Brasília: Embrapa Hortaliças, (Embrapa Hortaliças. Sistemas de produção, 6, 2004. SILVA, J. C. Performance agronômica de genótipos de batata-doce obtidos de semente botânica com potencial para produção de etanol. Dissertação (Mestrado em Produção Vegetal), UFT, Gurupi (TO). 57 p, 2010. SILVA, G.S.P. Concentração de amido e estimativa de rendimento e álcool em batatadoce cultivada com diferentes fontes e doses de potássio. Dissertação (Mestrado em 25 Bioenergia, área de concentração em Biocombustíveis). UNICENTRO, Guarapuava (PR), 51 f. 2013. SILVEIRA, M. A. Resistência de clones de batata-doce [(Ipomoea batatas L.) Lamarck] quanto aos nematoides do gênero Meloidogyne e aos insetos de solo. Dissertação – Universidade Federal de Lavras, Lavras, MG, 1993. SILVEIRA, M. A.; DIAS, L. E.; ALVIM, T. C.; TAVARES, I. B.; SANTANA, W. R.; SOUZA, F. R. “A cultura da batata-doce como fonte de matéria-prima para produção de Álcool”. Boletim técnico, UFT- Palmas, 2007. P.21-24/43-45. SILVEIRA, M.A.; TAVARES, I.B.; SILVA, J.O.V.; ANDRÉ, C.M.G.; SANTANA, W.R. Seleção de acessos de batata-doce, adaptados a produção de biomassa, visando a produção de etanol, através da análise de cluster. In: BIOCOM, 2009. Associação Brasileira de Química. THOMPSON, P.G.; HONG, L.L.; UKOSKIT, K.; ZHU, Z. Genetic linkage of random amplified polymorphic DNA (RAPD) markers in sweet potato. J. Am. Soc. Hortic. Sci. 122:79-82, 1997. TIAN, Y.; ZHAO, L.; MENG, H.; SUN, L.; YAN, J. “Estimation of un-used land potential for biofuels development in (the) People‟s Republic of China”. Article in press to APPLIED ENERGY, Page 77-85. Sweden, (2009). TRUTA, AAC.; ARAÚJO, E.; SILVA, V.F. Reações de cultivares e controle químico do mal-do-pé da batata-doce na microrregião do Brejo, Paraíba. Agropecuária Técnica, v. 21, n. 1/2, 2000. VIANA, DJS.; ANDRADE JÚNIOR, VC.; RIBEIRO, KG.; PINTO, NAVD., NEIVA, IP.; FIGUEIREDO, JÁ.; LEMOS, VT.; PEDROSA, CE.; AZEVEDO, AM. Potencial de silagens de ramas de batata-doce para alimentação animal. Ciência Rural, Santa Maria, v.41, n.8, p.1466-1471, ago, 2011. 26 ZISKA, L. H.; RUNION, G. B.; TOMECEK, M.; PRIOR, S. A.; TORBET, H. A.; SICHER, R. “An evaluation of cassava, sweet potato and field corn as potential carbohydrate sources for bioethanol production in Alabama and Maryland”. Article in press to BIOMASS & BIOENERGY, page 1-6. Auburn-USA, (2009). WOOLFE, J.A. Sweet potato: na untapped food resource: Cambridge University Press, 1992. 18. 27 CAPÍTULO I AGRESSIVIDADE DE ISOLADOS LOCAIS DE PLENODOMUS DESTRUENS E RESISTÊNCIA DE GENÓTIPOS DE BATATA-DOCE AO MAL-DO-PÉ AGGRESSIVENESS OF ISOLATED LOCATIONS PLENODOMUS DESTRUENS AND GENOTYPES RESISTANCE SWEET POTATO TO FOOTROT RESUMO O objetivo do presente estudo foi selecionar isolados de Plenodomus destruens mais agressivos aos genótipos de batata-doce e avaliar a resistência de genótipos de batatadoce ao mal-do-pé. Foi avaliada a reação fenotípica de dois genótipos experimentais de batata-doce (BDFMI#40 e 2007HSF1405) a 24 isolados locais de P. destruens em Laboratório. A inoculação consistiu na fixação de disco micelial através de alfinete estéril. As avaliações foram feitas a cada dois dias levando-se em consideração o tamanho da lesão no caule. Os isolados mais agressivos foram utilizados nas inoculações realizadas em casa de vegetação no setor de Olericultura da UFT-CAUG. Em casa de vegetação foram avaliados 36 genótipos de batata-doce (Princesa, Itajuba, Amanda, Duda, Júlia, Marcela, BDFMI#04, BDFMI#10, BDFMI#11, BDFMI#14, BDFMI#16, BDFMI#28, BDFMI#31, BDFMI#36, BDFMI#38, BDFMI #40, BDFMI#42, BDFMI#51, BDFMI#57, BDFMI#58, BDFMI#59, BDFMI#70, BDFMI#78, BDFMI#88, BDFMI#89, BDFMI#93, BDFMI#94, BDFMI#106, 2007HSF0128, 2007HSF0613, 2007HSF0906, 2007HSF1031, 2007HSF1035, 2007HSF1105, 2007HSF1405 e 2007HSF2210). Os isolados de P. destruens Gurupi 10 e Gurupi 11 foram utilizados para inoculação em casa de vegetação tomando-se como base a agressividade destes nos ensaios conduzidos em laboratório. O delineamento experimental utilizado foi inteiramente casualizado com 5 repetições, no esquema fatorial 36 x 2. As mudas de mini-estacas foram inoculadas aos 20 DAP. Quatro dias após a inoculação, avaliou-se a agressividade através do comprimento da lesão no caule. Dos 26 isolados avaliados em laboratório, os mais agressivos foram Gurupi 10, Gurupi 11 e Gurupi 2 para o genótipo BDFMI#40. Para o genótipo 2007HSF1405, os isolados mais agressivos foram Gurupi 8 e Gurupi 2. Dos 36 genótipos avaliados em casa de vegetação, a cultivar Júlia foi o que apresentou maior suscetibilidade ao mal-do-pé. Os genótipos que apresentaram maiores reações de resistência foram BDFMI#10, BDFMI#14, BDFMI#58, BDFMI#106, 2007HSF0128, 2007HSF0613, 2007HSF0906, BDFMI#28, BDFMI#88, BDFMI#57, BDFMI#31, BDFMI#36, BDFMI#78, Itajuba, BDFMI#59 e BDFMI#89. O isolado Gurupi 11 foi o mais agressivo em casa de vegetação. Palavras-chaves: Ipomoea batatas, Mal-do-pé, Agressividade, Resistência. 28 ABSTRACT The aim of this study was to select isolates of Plenodomus destruens more aggressive to sweet potatoes genotypes and evaluate the reaction of sweet potato genotypes to foot-rot isolates. Phenotypic reaction of two sweet potato experimental genotypes (BDFMI#40 and 2007HSF1405) the 24 isolates foot-rot in Phytopathology Laboratory of the Universidade Federal of Tocantins was evaluated. Inoculation was done by injury method which consisted of the introduction of mycelial disc through sterile pin. The evaluations were performed every other day. The most aggressive isolates were used in inoculations carried out in a greenhouse at the Horticulture sector of the UFT-CAUG. In greenhouse were evaluated 36 sweet potato genotypes (Princesa, Itajuba, Amanda, Duda, Julia, Marcela, BDFMI#04, BDFMI#10, BDFMI#11, BDFMI#14, BDFMI#16,BDFMI#28, BDFMI#31, BDFMI#36, BDFMI#38, BDFMI# 40, BDFMI#42, BDFMI#51, BDFMI#57, BDFMI#58, BDFMI#59, BDFMI# 70, BDFMI#78, BDFMI#88, BDFMI#89 , BDFMI#93, BDFMI#94, BDFMI#106, 2007HSF0128, 2007HSF0613, 2007HSF0906, 2007HSF1031, 2007HSF1035, 2007HSF1105, 2007HSF1405 and 2007HSF2210) and the isolated Gurupi10 and Gurupi 11 were used for inoculation building on the aggressiveness of these trials conducted in in the laboratory. The experimental design was completely randomized with 5 repetitions, in a factorial 36 x 2. The seedlings of mini-cuttings were inoculated 20 DAP. Four days after the inoculation, the aggressiveness was evaluated through. Of the 26 isolates evaluated in the laboratory, the most aggressive were Gurupi 10, Gurupi 11 and Gurupi 2 for genotype BDFMI#40. For genotype 2007HSF1405, the most aggressive isolates were Gurupi 8 and Gurupi 2. Of the 36 genotypes in a greenhouse to grow Julia showed the greater susceptibility to foot rot. The genotypes that showed greater resistance reactions were BDFMI#10, BDFMI#14, BDFMI#58, BDFMI#106, 2007HSF0128, 2007HSF0613, 2007HSF0906, BDFMI#28, BDFMI#88, BDFMI#57, BDFMI#31, BDFMI#36, BDFMI#78, Itajuba, BDFMI#59 and BDFMI#89. The isolated Gurupi 11 was the most aggressive in the greenhouse. Keywords: Ipomoea batatas, Foot-rot, Aggressiveness, Resistance. 29 INTRODUÇÃO A batata-doce (Ipomoea batatas L. (Lam)) é uma dicotiledônea originária das Américas Central e do Sul, da família Convolvulaceae, que agrupa mais de 1000 espécies, sendo ela a única espécie de valor comercial e o único membro hexaplóide (2n=6x=90). No contexto mundial, 90% da produção concentram-se na Ásia, 5% na áfrica e 5% no restante do mundo (FAO, 2008). No Brasil, a região sul é responsável por 48,2 % da produção, seguida pela região Nordeste com 35% e a região Sudeste com 16, 2%. Esta espécie é considerada rústica, de fácil cultivo, ciclo vegetativo curto e grande capacidade de adaptação as diferentes condições edafoclimáticas (MOMENTÉ et al., 2004) e encontra-se difundida em diversas regiões do Brasil. Entretanto, adapta-se melhor aos locais onde as temperaturas são mais elevadas, pois além de não tolerar geadas, seu desenvolvimento vegetativo e a produtividade são prejudicados em temperaturas inferiores a 10ºC (MIRANDA et al., 1995). A propagação desta espécie pode ser feita através de mudas, ramas, raízes, sementes ou por cultura de tecidos. Entretanto, a propagação por sementes só tem importância em trabalhos de melhoramento genético, não interessando para cultivos comerciais. Trata-se de uma espécie com alta diversidade genética, capaz de atender à demanda para diferentes aplicações: alimentação humana e animal e matéria-prima para a indústria (MASSAROTO, 2008; VIANA et al, 2011; GUEDES, 2004; MOMENTÉ et al. 2004). Há uma grande variabilidade fenotípica e genotípica nessa cultura, que se encontra disseminada em todo o Brasil. Praticamente, quase todos os estados e municípios brasileiros possuem suas próprias cultivares que, em muitos casos, são meras duplicatas, pois é comum a ocorrência de cultivares iguais com nomes diferentes e vice-versa (MURILO, 1990; DAROS, 1999; DAROS, et al., 2002; CARDOSO et al., 2005). Segundo Amorim et al. (2011), no Estado do Tocantins, a cultura da batatadoce é cultivada sob diferentes condições edafoclimáticas, ocorrendo grande variação no rendimento, não só em função dos sistemas de cultivo e níveis de investimento, mas também em consequência das condições climáticas, resultando em uma significativa interação de genótipos por ambientes. Estudos desenvolvidos por Silveira et al., (2002) 30 indicaram resultados promissores no processo de seleção de clones com produtividades entre 28 e 65 Mg ha-1 de raízes nas condições edafoclimáticas do Estado do Tocantins. Apesar do grande potencial produtivo, a planta é atacada por diversos patógenos que são capazes de reduzir significativamente a produção. No Brasil, a principal doença é o mal-do-pé, que tem como agente etiológico o fungo Plenodomus destruens, causando diversos prejuízos em todas as etapas de cultivo, desde a produção de mudas até o armazenamento (LOPES et al., 1994, RUBIN et al., 1994; LOCH et al., 1997; CAVALCANTI et al.; 2002). Infecções severas em cultivares suscetíveis podem reduzir em até 80% a produtividade da cultura. Atualmente esta doença tem sido motivo de preocupação para técnicos e produtores, principalmente em regiões onde o cultivo de batata-doce é intensivo, com uma, duas ou até três safras na mesma área em anos consecutivos (PEREIRA et al., 2011). O objetivo do presente estudo foi selecionar e identificar isolados de P. destruens mais agressivos a batata-doce e avaliar a reação de genótipos de batata-doce ao mal-do-pé. MATERIAL E MÉTODOS 2.1. Experimento 1: Seleção de isolados de P. destruens quanto a agressividade a genótipos de batata-doce O trabalho foi conduzido no Laboratório de Fitopatologia da Universidade Federal do Tocantins - Campus Universitário de Gurupi. Foi avaliada a reação fenotípica em dois genótipos experimentais de batata-doce pertencentes ao Programa de Melhoramento genético de batata-doce da UFT, (BDFMI #40 e 2007HSF1405) a 24 isolados de mal-do-pé coletados nas cidades de Palmas e Gurupi. Como testemunhas foram utilizadas duas ramas, uma recebeu apenas água estéril e outra em que apenas foi inoculado alfinete estéril. Inicialmente em campo, foram identificados os genótipos de batata-doce apresentando incidência de plantas mortas, com ramas secas e folhas murchas ou que apresentaram lesões escuras no coleto da planta foram coletados e encaminhados para o Laboratório de Fitopatologia da UFT para diagnóstico, identificação e isolamento do agente etiológico causador da doença. 31 Foram retirados fragmentos da lesão com lâmina de bisturi. Em seguida, os fragmentos coletados submetidos a assepsia, que consistiu na imersão dos fragmentos em álcool 70%, hipoclorito de sódio a 1% e água destilada e esterilizada. Os fragmentos foram colocados em placas de Petri contendo o meio de cultura Batata Dextrose Ágar (BDA). Após sete dias de incubação foi possível visualizar o crescimento de colônias fúngicas com características do fungo causador do mal-do-pé. Estas colônias foram individualmente repicadas para placas de Petri contendo o meio BDA (Batata-DextroseÁgar) para obtenção das colônias puras do fungo. Estas colônias foram mantidas nas condições do laboratório sendo periodicamente repicadas para manutenção da viabilidade do fungo e também para os trabalhos de confirmação do agente causal e posterior inoculação das plantas para avaliação da resistência. A partir do material infectado trazido diretamente do campo e também das colônias puras obtidas em meio de cultura foram preparadas lâminas de microscopia para observação das características micro-morfológica do fungo em microscopia óptica. A confirmação do patógeno foi baseada nas características específicas do micélio fúngico, formação de picnídios crescidos em meio de cultura e também foram caracterizados morfologicamente de acordo com os conídios formados. Utilizou-se a literatura específica como referência Barnet e Hunter, 1972. Para o teste de patogenicidade plantas sadias de dois genótipos de batata-doce (BDFMI#40 e 2007HSF1405) foram inoculadas com o fungo obtido no meio de cultura. A inoculação consistiu na fixação de disco micelial através de alfinetes estéreis. As plantas testemunhas não foram inoculadas com o fungo. Posteriormente, as plantas inoculadas foram mantidas por 48 horas em câmara úmida no escuro, com temperatura variando de 28 a 33 ºC. As ramas foram segmentadas (12 cm), em seguida colocadas em caixas de acrílico transparente (Gerbox), previamente desinfestadas com álcool e hipoclorito de sódio. Como substrato, foram utilizadas duas folhas de papel-filtro esterilizadas e umedecidas com água destilada. Após este processo, os segmentos ficaram na sala de incubação, com temperatura de 25ºC e fotoperíodo de 12 horas. Após 48 horas de incubação, iniciaram as avaliações. Decorridos quatro dias da inoculação, a agressividade foi avaliada através da medida do comprimento da lesão formada no caule por meio de uma régua graduada. 32 As avaliações (visualização de sintomas) foram feitas a cada dois dias. Os fragmentos de ramas que apresentavam sintomas eram identificados de acordo com o isolado e mensurados os tamanhos da lesão. Os dados avaliados foram submetidos á análise de variância aos níveis de 5% e 1% de probabilidade e a comparação das médias foi feita pelo teste de Skoot-Knott (p=0,05) com a utilização do programa SISVAR (Ferreira, 2010). Os dados originais de severidade foram transformados para (𝑥 + 1) visando obter homogeneidade das variâncias. 2.2. Experimento 2: Resistência de genótipos de batata-doce ao mal-do-pé em casa de vegetação Foram avaliados 36 genótipos de batata-doce em tubetes de polipropileno preto com 6 estrias internas, comprimento de 120 mm, diâmetro superior com 35 mm e volume interno de substrato de 55 cm3, contendo uma mistura de esterco, solo, areia e substrato comercial Bioflora® esterilizado na proporção de 1:2:1:1. O delineamento experimental utilizado foi inteiramente casualizado com 5 repetições, no esquema fatorial 36 x 2, sendo o primeiro fator constituído por 36 genótipos de batata-doce e o segundo fator constituído por dois isolados de P. destruens (Gurupi 10 e Gurupi 11). Os 36 genótipos de batata-doce avaliados foram 6 cultivares (Princesa, Itajuba, Amanda, Duda, Júlia, Marcela) e 26 genótipos experimentais selecionados com base na produtividade e teor de amido (BDFMI#04, BDFMI#10, BDFMI#11, BDFMI#14, BDFMI#16, BDFMI#28, BDFMI#31, BDFMI#36, BDFMI#38, BDFMI #40, BDFMI#42, BDFMI#51, BDFMI#57, BDFMI#78, BDFMI#88, BDFMI#89, 2007HSF0128, 2007HSF0613, BDFMI#58, BDFMI#93, 2007HSF0906, BDFMI#59, BDFMI#94, 2007HSF1031, BDFMI#70, BDFMI#106, 2007HSF1035, 2007HSF1105, 2007HSF1405 e 2007HSF2210). Os isolados 10 e 11 foram utilizados para inoculação tomando como base a agressividade destes nos ensaios conduzidos no em laboratório. De cada genótipo foram obtidos mudas de mini-estacas com dois nós que foram inoculadas aos 20 dias após plantio (DAP) utilizando solução com esporos de 1,6x106 conídios mL-1. A contagem dos esporos foi feita utilizando-se a Câmara de Neubauer. Para inoculação foram feitos ferimentos nas ramas das plantas, através de pequenos cortes transversal e superficial. A parcela consistiu de 5 plantas, sendo que, 4 33 receberam a solução com conídios e uma testemunha (não recebeu a solução de conídios). As plantas foram mantidas por 24 horas em câmara úmida no escuro, com temperatura variando de 28 a 35 ºC. Quatro dias após a inoculação, a agressividade foi avaliada através da medida do comprimento da lesão formada na rama por meio de uma régua graduada. Para atender as pressuposições básicas da análise de variância, os valores médios do comprimento da lesão de cada tratamento foram transformados para (𝑥 + 1) e submetidos à análise de variância. Após esse procedimento as médias de cada genótipo foram comparadas pelo teste de agrupamento de Scott Knott (p=0.05), utilizando-se o programa estatístico SISVAR (FERREIRA, 2008). RESULTADOS E DISCUSSÃO Experimento 1: Seleção de isolados de Plenodomus destruens quanto a agressividade à genótipos de batata-doce Pelo teste de Scott-Knott foram constatadas diferenças significativas ao nível de 5% de probabilidade para agressividade dos isolados (Tabela 1). Os maiores valores de agressividade foram observados nos isolados GURUPI 11, (2,7); GURUPI 10 (2,66), PALMAS 8 (2,64) e GURUPI 2 (2,37) para o genótipo BDFMI#40. Para o genótipo 2007HSF1405 o isolado mais agressivo foi o GURUPI 8 (2,73) (Tabela 1). A maioria dos isolados testados foi patogênica aos genótipos de batata-doce, apresentando os sintomas de mal-do-pé, de modo geral, aos quatro dias após a inoculação, diferindo apenas quanto a severidade dos sintomas causados. Entretanto os isolados GURUPI 11 e GURUPI 10 foram os que apresentaram maiores valores de agressividade. As ramas inoculadas com alfinete estéril e que não foi inoculada alfinete (Testemunhas) não apresentaram sintomas. O isolado GURUPI 10 foi o mais agressivo. Os isolados GURUPI 4 (1cm) e PALMAS 5 (1,05) foram os menos agressivos em ambos genótipos. Lopes et al. (1994) avaliando 23 isolados provenientes de diversas regiões do Brasil, confirmaram a patogenicidade de P. destruens na cultivar de batata-doce Brazlândia Branca mediante a inoculação no solo com a deposição de suspensão de conídios na região do coleto das plantas, seguido de pulverização das hastes. 34 Segundo Michereff (2001), agressividade de um isolado de um determinado patógeno está associada á velocidade no aparecimento dos sintomas da doença. Ou seja, quanto mais agressivo for determinado isolado, mais rápido será o aparecimento dos sintomas. Em estudos de seleção de isolados feitos por Alves (1998), a variação na patogenicidade foi observada com frequência, sendo relacionada à virulência do isolado, à especificidade e à tolerância do hospedeiro, consequência da variabilidade genética de cada isolado. Tabela 1: Médias para tamanho da lesão (em cm) em dois genótipos de batata-doce inoculados com isolados locais de Plenodomus destruens. Gurupi, UFT, 2014. ISOLADOS GURUPI 1 GURUPI 2 GURUPI 3 GURUPI 4 GURUPI 5 GURUPI 6 GURUPI 7 GURUPI 8 GURUPI 9 GURUPI 10 GURUPI 11 GURUPI 12 GURUPI 13 GURUPI 14 PALMAS 1 PALMAS 2 PALMAS 3 PALMAS 4 PALMAS 5 PALMAS 6 PALMAS 7 PALMAS 8 PALMAS 9 PALMAS 10 TEST TEST+ALF MÉDIA GERAL C.V. (%) 1 BDFMI#40 2007HSF1405 MÉDIAS1 1,00 Db 2,37 Aa 2,15 Ba 1,00 Da 2,57 Aa 1,40 Ca 1,99 Ba 1,55 Cb 1,92 Ba 2,66 Aa 2,70 Aa 1,24 Db 2,28 Ba 1,82 Bb 1,55 Ca 1,00 Da 2,05 Ba 1,11 Db 1,00 Da 1,46 Cc 1,64 Ca 2,64 Aa 1,63 Cc 2,13 Bb 1,00 Da 1,00 Da 1,79 a 1,47 Ca 2,07 Ba 1,05 Db 1,00 Da 1,47 Cb 1,50 Ca 1,67 Ca 2,73 Aa 1,32 Cb 2,02 Bb 1,63 Cb 2,16 Ba 1,95 Ba 2,28 Ba 1,53 Ca 1,35 Ca 1,00 Db 1,88 Ba 1,10 Da 1,08 Da 1,04 Db 1,09 Db 1,22 Da 1,95 Ba 1,00 Da 1,00 Da 1,52 b 32,25 1,24 D 2,22 A 1,60 C 1,00 D 2,02 A 1,45 C 1,83 C 2,14 A 1,62 C 2,34 A 2,17 A 1,70 B 2,12 A 2,05 A 1,54 C 1,17 D 1,53 C 1,49 C 1,05 D 1,27 D 1,34 C 1,86 B 1,43 C 2,06 A 1,00 D 1,00 D 1,62 Médias seguidas de mesmas letras maiúsculas na coluna e minúsculas na linha não diferem estatisticamente entre si pelo teste de Scott-Knott (p≤0,05). Valores transformados para (𝑥 + 1,0). 35 Os dados da figura 1 mostram que a severidade foi crescente ao longo dos dias de avaliação para os dois genótipos avaliados, indicando que a lesão da doença cresceu progressivamente e que os genótipos não apresentaram mecanismos de resistência a esses isolados. O genótipo BDFMI#40 apresentou maior valor de severidade média (2,21), porém, esse valor foi estatisticamente igual ao que apresentou o genótipo 2007HSF1405 (2,15). Houve uma evolução da severidade durante o período de avaliação, mostrando a virulência do patógeno e a suscetibilidade do hospedeiro. A virulência de um isolado de determinado patógeno também está associada a quantidade de doença induzida no hospedeiro, ou seja, quanto maior a intensidade da doença, mais virulento o isolado. Figura 1: Severidade média de mal-do-pé causado por diferentes isolados de P. destruens em genótipos de batata-doce. UFT. Gurupi, 2014. A severidade é uma medida que expressa a intensidade da doença e necessária para descrever o progresso da epidemia e sua relação com o clima, medidas de controle e para validar modelos de previsão ou fazer uso no manejo integrado (AMORIM & BERGAMIM FILHO, 2011). É um método quantitativo e qualitativo, que determina a 36 porcentagem da área de tecido doente (sintomas visíveis), através da medição direta ou indireta. Este método é mais preciso, pois expressa o dano real causado pelos patógenos, caracteriza o grau de resistência a um patógeno e expressa com maior fidelidade a intensidade da doença o campo e os danos causados (MORAES, 2007). Experimento 2: Suscetibilidade de genótipos de batata-doce a isolados locais de mal-do-pé Todos os genótipos que apresentaram sintomas da doença tiveram uma lesão menor que 2 centímetros (Tabela 2). Ao contrário do que ocorreu em laboratório, onde alguns isolados causaram lesões superiores a dois centímetros em um menor período de avaliação. Foram constatadas, pelo teste de Skott-Knott diferenças significativas (P≤ 0,05) para avaliação aos quatro dias após a inoculação. Foi possível distinguir que todos os genótipos apresentaram lesões marrons na haste, indicando assim que todos os materiais avaliados foram infectados pelos isolados de P. destruens, diferindo significativamente quanto ao tamanho da lesão (Tabela 2). Nenhum genótipo foi imune a doença, porém foi possível distinguir níveis diferenciados de resistência. Esses dados foram confirmados por Pereira et al, (2013) e Mendes et al, (2012) que identificaram diferentes níveis de resistência nas diferentes cultivares avaliadas. Os genótipos BDFMI#40 e 2007HSF1405 que manifestaram reação de suscetibilidade em laboratório, também manifestaram o mesmo comportamento em casa de vegetação. O genótipo 2007HSF1405 foi o que apresentou maior comprimento da lesão para o isolado 11 (1,33), comprovando sua suscetibilidade ao patógeno. A cultivar Duda foi a que apresentou maior média em relação aos dois isolados (1,34). Analisando o comprimento da lesão com a inoculação dos isolados, verificouse que as lesões foram menores que 2,0 cm, contrário ao que apresentou no laboratório, mostrando que o ambiente influencia na agressividade de P. destruens. Michereff (2001) afirmou que o ambiente pode afetar a disponibilidade, estádio de crescimento e suscetibilidade genética do hospedeiro. Pode também afetar a sobrevivência, a taxa de multiplicação, a esporulação, a distância de disseminação do patógeno, a taxa de germinação dos esporos e a penetração. Adicionalmente, o ambiente pode também afetar o número e a atividade de vetores do patógeno. 37 Tabela 2: Comprimento médio da lesão (cm) em genótipos de batata-doce à dois isolados de mal-do-pé. Gurupi, UFT, 2014. GENÓTIPOS BDFMI#04 BDFMI#10 BDFMI#11 BDFMI#14 BDFMI#16 BDFMI#28 BDFMI#31 BDFMI#36 BDFMI#38 BDFMI#40 BDFMI#42 BDFMI#51 BDFMI#57 BDFMI#58 BDFMI#59 BDFMI#70 BDFMI#78 BDFMI#88 BDFMI#89 BDFMI#93 BDFMI#94 BDFMI#106 2007HSF0128 2007HSF0613 2007HSF0906 2007HSF1031 2007HSF1035 2007HSF1105 2007HSF1405 2007HSF2210 Duda Itajuba Júlia Marcela Princesa Média Geral C.V. (%) Isolados Gurupi 10 Gurupi 11 1,07 Ca 1,15 Ba 1,00 Da 1,00 Da 1,06 Cb 1,32 Aa 1,00 Da 1,00 Da 1,10 Ba 1,09 Ca 1,00 Da 1,02 Da 1,06 Ca 1,00 Da 1,02 Da 1,04 Ca 1,04 Db 1,17 Ba 1,08 Ca 1,09 Ca 1,09 Ca 1,15 Ca 1,08 Ba 1, 07 Ca 1,05 Da 1,00 Da 1,00 Da 1,00 Da 1,09 Ca 1,00 Da 1,30 Ba 1,22 Ba 1,00 Da 1, 08 Ca 1,01 Da 1,01 Da 1,01 Da 1,09 Ca 1,09 Ca 1,04 Ca 1,19 Ba 1,19 Ba 1,00 Da 1,00 Da 1,00 Da 1,00 Da 1,00 Da 1,00 Da 1,00 Da 1,00 Da 1, 07 Ca 1,04 Ca 1,03 Da 1,12 Ba 1,09 Ca 1,16 Ba 1,09 Cb 1,33 Aa 1,04 Da 1, 07 Ca 1,02 Db 1,19 Ba 1,00 Da 1, 07 Ca 1,43 Aa 1,24 Bb 1,22 Ba 1,15 Ba 1,15 Ca 1, 07 Ca 1,07 b 1,09 a Média Geral 1,11 D 1,00 E 1,19 C 1,00 E 1,09 D 1,01 E 1,03 E 1,03 E 1,10 D 1,09 D 1,12 D 1,08 D 1,02 E 1,00 E 1,05 E 1,26 B 1,04 E 1,01 E 1,05 E 1,06 D 1,19 C 1,00 E 1,00 E 1,00 E 1,00 E 1,06 D 1,07 D 1,13 D 1,21 C 1,06 D 1,10 D 1,04 E 1,34 A 1,18 C 1,11 D 1,08 19,57 Médias seguidas de mesmas letras maiúsculas na coluna e minúsculas na linha não diferem estatisticamente entre si pelo teste de Scott-Knott (p≤0,05). 38 CONCLUSÕES Dos 26 isolados avaliados em laboratório, os mais agressivos foram os isolados Gurupi 10, Gurupi 11 e Gurupi 2 para o genótipo BDFMI#40. Para o genótipo 2007HSF1405 os isolados mais agressivos foram os isolados Gurupi 8 e Gurupi 2. Dos 36 genótipos avaliados em casa de vegetação, a cultivar Júlia foi o que apresentou maior reação de suscetibilidade a P. destruens. Os genótipos que apresentaram maiores reações de resistência foram BDFMI#10, BDFMI#14, BDFMI#58, BDFMI#106, 2007HSF0128, 2007HSF0613, 2007HSF0906, BDFMI#28, BDFMI#88, BDFMI#57, BDFMI#31, BDFMI#36, BDFMI#78, Itajuba, BDFMI#59 e BDFMI#89. O isolado Gurupi 11 foi mais agressivo em casa de vegetação. REFERÊNCIAS BIBLIOGRÁFICAS ALVES, S.B. Fungos entomopatogênicos. In: ALVES, S.B. (Ed.). Controle microbiano de insetos. 2.ed. Piracicaba: FEALQ. 1998. p.308-310. AMORIM, L.; REZENDE, J.A.M. & BERGAMIN FILHO, A. eds. Manual de Fitopatologia. Volume 1 - Princípios e Conceitos. 4ª Edição. Editora Agronômica Ceres Ltda. São Paulo. 2011. 704p. AMORIN, B. S. C.; OLIVEIRA, G.I.S.; SILVEIRA, M. A. da; NASCIMENTO, I. R.do; FERREIRA, T. A. Adaptabilidade fenotípica de genótipos de batata-doce oriundos de sementes botânicas na região Sul do Estado do Tocantins. Pesquisa Aplicada & Agrotecnologia, v. 4, n. 3, set/dez. 2011. 39 BARNETT, H. L.; HUNTER, B. B. Division of plant sciences. Illustrated Genera of Imperfect Fungi. West Virginia University Morgantown, West Virginia. Thrird Edition. Burgess Publishing Company, 1972. 241 pages. CARDOSO, A. D.; VIANA, A. E. S.; RAMOS, P. A. S.; MATSUMOTO, S. N.; AMARAL, C. L. F.; SEDIYAMA, T.; MORAIS, O. M. Avaliação de clones de batata doce em Vitória da Conquista. Horticultura Brasileira, Brasília, v.23, n.4, p.911-914, out../dez. 2005. CAVALCANTI, LS.; COÊLHO, RSB.; PEREZ, JO. Reação de cultivares de batatadoce à podridão-do-pé, em condições de campo. Ciência Rural, v. 32, n. 4, 2002. DAROS, M. Caracterização morfológica e estabilidade de produção de Ipomoea batatas em Campos dos Goytacazes, RJ. 1999. 67p. Dissertação (Mestrado em Agronomia) – Universidade Estadual do Norte Fluminense, Campos dos Goytacazes, RJ, 1999. DAROS, M.; AMARAL JÚNIOR, A. T.; PEREIRA, T. N. S.; LEAL, N. R.; FREITAS, S. P.; SEDIYAMA, T. Caracterização morfológica de acessos de batata-doce. Horticultura Brasileira, Brasília, v.20, n.1, p.43-47, mar. 2002. FERREIRA, D.F. SISVAR - Sistema de análise de variância. Versão 5.3. Lavras-MG: UFLA, 2008. FOOD AND AGRICULTURE ORGANIZATION OF THE UNITED NATIONS. 2008. Disponível em: http://faostat.fao.org/site/339/default.aspx Acesso em: 03 de SETEMBRO de 2014 GUEDES, MC. Antocianinas: pigmento natural ou remédio? Revista Científica do IMAPES, p. 71-73. 2004. LOCH, L.C., FONTOURA, M.C., DUARTE, V. Produção de conídios de Plenodomus destruens pelo processo marcescente. Fitopatologia Brasileira, Brasília, v.22, n.1, p.74-76. 1997. 40 LOPES, C.A., BOFF, P., DUARTE, V. Foot rot of sweet potatoin Brazil. Pesquisa Agropecuária Brasileira, v.29, n.9, p.1407-1410, 1994. MASSAROTO, J.A. Características agronômicas e produção de silagem de clones de batata-doce. Tese. Pós Graduação em Agronomia-Fitotecnia. Lavras, MG. UFLA, 2008. 85p MENDES, L.S.; PEREIRA, R.B., AMARO, G.B., PINHEIRO, J.B. – Reação de Cultivares de Batata-doce ao Mal-do-pé. II Jornada Científica da Embrapa Hortaliças, 31 de julho e 1 de agosto. Embrapa Hortaliças 2012. MICHEREFF, R.J. BARROS, R. Proteção de plantas na agricultura sustentável – Recife : UFRPE, Imprensa Universitária, 2001. MIRANDA, J. E. C; FRANÇA, F. H.; CORRIJO O. A.; SOUZA, A. F.; PEREIRA, W.; LOPES,C. A.; SILVA, J. B. C. A cultura da batata doce. Brasília: EMBRAPA. 1995. 94p. (coleção plantar). MOMENTÉ, V.G.; RODRIGUES, S.C.S.; TAVARES, I.B.; SILVEIRA, M.A.; SANTANA, W.R. Desenvolvimento de cultivares de batata-doce no estado do Tocantins, visando à produção de álcool, como fonte alternativa de energia para as condições tropicais. Horticultura Brasileira, Brasília, v. 22, n. 2, p. 340-342, jul. 2004. Suplemento. MORAES, A.S. Quantificação de doenças de plantas. 2007. Artigo em Hypertexto. Disponível em: <http://www.infobibos.com/Artigos/2007_1/doencas/index.htm>. Acesso em:5/10/2014 MURILO, D.V. de; PEDROSA, J.F.; NUNES, G. L.F. ESAM 1, 2 e 3: novas cultivares de batata-doce para a região semi-árida. Horticultura Brasileira, Brasilia, v.8, n.2, p.32-33, 1990. PEREIRA, RB.; FERNANDES, FR.; PINHEIRO, JB. Recomendações para manejo da podridão-do-pé em batata-doce. Comunicado Técnico 79. EMBRAPA, 2011 41 PEREIRA, R.B.; CARVALHO, A.D.F.; PINHEIRO, J.B. Avaliação da resistência de cultivares de batata-doce ao mal-do-pé por meio de diferentes métodos de inoculação. Boletim de Pesquisa e Desenvolvimento 95. EMBRAPA, 2013. RUBIN, R.S., IORIS, A.A.R., DUARTE, V. Controle, severidade a campo e reação de cultivares de batata-doce (Ipomoea batatas) ao mal-do-pé ( Plenodomus destruens). Fitopatologia Brasileira, v.19, n.1, p.39-43, 1994. SILVEIRA, M.; CAMPOS, G.; ANDRÉ, C.; BESSA, G.; NOGUEIRA, S.; SILVA, V.; CARNEIRO, F. Resistência de clones de batata-doce coletados no Estado do Tocantins a insetos de solo e nematóides causadores de galhas. Horticultura Brasileira, Suplemento 2, v. 20, n. 2, 2002. VIANA, DJS.; ANDRADE JÚNIOR, VC.; RIBEIRO, KG.; PINTO, NAVD., NEIVA, IP.; FIGUEIREDO, JÁ.; LEMOS, VT.; PEDROSA, CE.; AZEVEDO, AM. Potencial de silagens de ramas de batata-doce para alimentação animal. Ciência Rural, Santa Maria, v.41, n.8, p.1466-1471, ago, 2011. 42 CAPÍTULO II PRODUTIVIDADE, TEOR DE MATÉRIA SECA E REAÇÃO AO MALDO-PÉ DE GENÓTIPOS DE BATATA-DOCE PRODUCTIVITY, DRY MATTER CONTENT AND THE FOOT ROT REACTION OF SWEET POTATO GENOTYPES RESUMO O objetivo do trabalho foi avaliar a produtividade e a resistência de genótipos de batatadoce a P. destruens em campo de produção. Foram avaliados 15 genótipos de batatadoce (BDFMI#04, BDFMI#10, BDFMI#16, BDFMI#31, BDFMI#38, BDFMI#40, BDFMI#51, BDFMI#57, BDFMI#70, BDFMI#89, BDFMI#93, BDFMI#94, BDFI#106, 2007HSF0128 e 2007HSF1405) e 5 cultivares testemunhas (Amanda, Duda, Itajuba, Marcela e Princesa). O delineamento experimental foi em blocos casualizados com 20 tratamentos e três repetições. Os dados avaliados foram produtividade total de raízes, massa seca da raiz, severidade e AACPD. A produtividade média entre os genótipos variou de 7,98 a 67,45 Mg ha -1. A média do teor de matéria seca entre os genótipos variou de 20,39 a 51,97%. Os primeiros sintomas da doença foram observados aos 120 dias após transplantio (DAT). Na presença de mal-do-pé, os genótipos mais produtivos foram BDFMI#16, Júlia, BDFMI#04, BDFMI#93 e 2007HSF0128. O teor de matéria seca variou de 20,39 a 51,97%, destacando-se o genótipo Marcela com teor médio de 51,97%. Em condição de campo, os genótipos com maiores níveis de resistência genética foram BDFMI#57, BDFMI#40 e Princesa. Palavras-chave: Ipomoea batatas L. Lam., Mal-do-pé, Resistência, Seleção, Produtividade de raízes. ABSTRACT The objective was to evaluate the productivity and the resistance of sweet potato genotypes to P. destruens production field. We evaluated 15 sweet potato genotypes (BDFMI#04, BDFMI#10, BDFMI#16, BDFMI#31, BDFMI#38, BDFMI#40, BDFMI#51, BDFMI#57, BDFMI#70, BDFMI#89, BDFMI#93, BDFMI#94, BDFI#106, 2007HSF0128 and 2007HSF1405) and 5 cultivars (Amanda, Duda, Itajuba, Marcela and Princesa). The experimental design was a randomized block with 20 treatments and three replications. The data included harvest, total productivity roots, root dry mass, severity and AUCPD. The average yield between the genotypes ranged from 7.98 to 67.45 Mg ha -1. The average dry matter content between genotypes ranged from 20.39 to 51.97%. The first symptoms of the disease were observed at 120 DAT. In the presence of foot-rot the most productive genotypes were BDFMI#16, Julia, BDFMI#04, BDFMI#93 and 2007HSF0128. The dry matter content ranged from 20.39 to 51.97%, standing out the Marcela genotype with an average grade of 51.97%. In field 43 conditions, genotypes with greater genetic resistance levels were BDFMI#57, BDFMI#40 and Princesa. Keywords: Ipomoea batatas L. Lam., Foot-rot, Resistance, Selection, Roots productivity. INTRODUÇÃO A batata-doce [Ipomoea batatas (L.) Lam.] é uma hortaliça tuberosa, tropical, rústica, de ampla adaptação, alta tolerância à seca e baixo custo de produção, sendo cultivada em praticamente todos os Estados brasileiros, constituindo-se na sexta hortaliça em área cultivada no país (FAO, 2008). Esta hortaliça pertence a família Convolvulacea, sendo I. batatas o único membro hexaplóide (2n=6x=90). Embora seja perene, a batata-doce é cultivada como cultura anual e apresenta característica de armazenar reservas nutritivas em suas raízes, possuindo imenso potencial alimentício, industrial e na produção de biocombustíveis. Segundo Filgueira (2008), o ciclo da planta inclui uma etapa vegetativa na qual as substâncias fotossintetizadas na parte aérea são translocadas para as raízes tuberosas, que se tornam ricas em amido e açúcares. Na etapa reprodutiva, ocorre o florescimento com produção de sementes utilizadas pelos fitomelhoristas na obtenção de novas cultivares. É uma planta, tradicionalmente, de propagação vegetativa e apresenta grande diversidade genotípica e fenotípica (VILAS BOAS et al., 1999; OLIVEIRA et al., 2000; DAROS et al., 2002). As condições de ambiente de cultivo e a variabilidade genética dos acessos disponíveis na região refletem nos resultados de produtividade da cultura (CARDOSO et al., 2005). De acordo com Mano et al (2007) e Kalkmann (2011), considerando os cultivos que proporcionam alimentos básicos, esta cultura é considerada a 7º mais importante, atrás apenas do trigo (Triticum aestivum), arroz (Oryza sativa), milho (Zea mays), batata (Solanum tuberosum), cevada (Hordeum vulgare) e mandioca (Manihot esculenta). Apesar do elevado potencial produtivo, no Brasil é comum encontrar baixas produtividades desta cultura, decorrentes principalmente da utilização de materiais genéticos obsoletos e degenerados, em sua maioria, suscetíveis a pragas e doenças. Entre 2000 e 2012 houve uma redução de 2% na produção de batata-doce no Brasil, 44 passando de 484.443 toneladas para 479.25, mesmo assim, ainda é a sexta hortaliça mais produzida no país com uma área estimada em 43.789 hectares e uma produção anual de 544.820 toneladas (IBGE-PAM, 2011). Esta hortaliça vem demonstrando outra grande potencialidade, que é a produção de biomassa voltada para a produção de biocombustível, o que pode levar a um fortalecimento da agricultura familiar. Comparada com outras culturas como o arroz, banana, milho e sorgo, a batata-doce é mais eficiente em quantidade de energia líquida produzida por unidade de área e por unidade de tempo. Isso ocorre porque produz grande volume de raízes em um ciclo relativamente curto, a um custo baixo, durante o ano inteiro (Silva, 2002; Moulin, 2010). Na região Norte do Brasil que inclui o Estado do Tocantins, a batata-doce é bastante disseminada e cultivada principalmente pelos pequenos agricultores, como cultura de subsistência. As principais regiões produtoras são: Gurupi, Palmas, Araguatins, Guaraí e Porto Nacional (MAGALHÃES, 2007). Nessa região, esta cultura vem apresentando uma produção de biomassa altamente viável, pelo baixo custo de produção e por apresentar boa produtividade em campo (CAMPOS et al., 2002; SILVA, 2010) o que viabiliza o processo de obtenção de etanol a partir dessa fonte de biomassa. As condições edafoclimáticas do Estado do Tocantins, aliado a facilidade de escoamento de produção, colocam o estado como uma das unidades federativas com interesse estratégico na produção agrícola. Entretanto, neste estado, tem sido comum o relato de uma doença causada por um fungo habitante de solo e favorecido por condições de alta umidade e temperaturas em torno de 21ºC a 32º. O mal-do-pé tem como agente causal o fungo Plenodomus destruens e tem sido considerada a doença mais importante da batata-doce na maioria das regiões produtoras. O objetivo do presente trabalho foi avaliar a produtividade, teor de matéria seca e a resistência de genótipos de batata-doce ao mal-do-pé em Gurupi, região sul do estado do Tocantins. MATERIAL E MÉTODOS O experimento foi conduzido no setor de Olericultura da Universidade Federal do Tocantins, Campus Universitário de Gurupi, localizada na latitude sul 11º43‟45” e 45 longitude oeste 49º04‟07” com altitude média de 280 m. Apresenta precipitação média anual em torno de 1.600 mm ano -1 e temperaturas médias máxima de 26 ºC e mínima de 24 ºC. O clima recebe a classificação de Aw – Tropical de verão úmido e período de estiagem no inverno, de acordo com a classificação de Koppen. O solo escolhido para a condução do experimento foi classificado como um Latossolo Vermelho Amarelo (Tabela 1). Tabela 1: Características químicas do solo na profundidade de 0-20 cm do local onde foi conduzido o ensaio de avaliação dos genótipos de batata-doce em Gurupi, região sul do estado do Tocantins. UFT, Gurupi-TO, 2014. pH CaCl2 P K Ca+2 Mg2+ Al3+ H+Al Mg dm-3 -------------cmolcdm3---------6,2 26,1 107 2,5 1,4 0,0 1,5 V MO % dag kg-1 74 1,8 Foram avaliados 15 genótipos experimentais de batata-doce pertencentes ao Programa de Melhoramento Genético da UFT (BDFMI#04, BDFMI#10, BDFMI#16, BDFMI#31, BDFMI#38, BDFMI#40, BDFMI#51, BDFMI#57, BDFMI#70, BDFMI#89, BDFMI#93, BDFMI#94, BDFI#106, 2007HSF0128 e 2007HSF1405) e 5 cultivares testemunhas (Amanda, Duda, Itajuba, Marcela e Princesa). O experimento foi instalado em junho de 2014, em delineamento em blocos casualizados com três repetições. O plantio foi feito em canteiros espaçados em 1,5 m e aproximadamente 0,40 m de altura. Cada parcela foi formada por seis plantas. Foram utilizadas mudas obtidas em bandejas de 128 células a partir de mini-estacas com duas gemas retiradas de plantas matrizes. Foi utilizado espaçamento de 0,80 m entre linhas por 0,45 m entre plantas dentro das linhas. Na adubação de plantio foram utilizados 40 kg ha-1 de N, 80 Kg ha-1 de potássio e 120 kg ha -1 de fósforo, usando como fontes ureia, cloreto de potássio e super simples, respectivamente. A adubação de cobertura ocorreu aos 20 e 40 DAP. Os tratos culturais (capinas e irrigação) foram feitos sempre que necessários. O local do experimento foi definido em função do histórico de ocorrência de mal-do-pé em experimentos de batata-doce realizados em anos anteriores, existindo, portanto, inóculo natural de mal-do-pé. A colheita foi realizada 180 DAP e as características avaliadas foram: 46 - Produtividade total de raízes (Mg ha-1): obtida pela pesagem das raízes de das plantas da parcela útil e o resultado convertido foi convertido em Mg ha -1. - Severidade (cm): obtida através da medição do comprimento da lesão com régua graduada em centímetros, a cada 5 dias após visualização dos sintomas da doença. - Área Abaixo da Curva de Progresso da Doença (AACPD): com os dados de severidade de cada avaliação foi calculado, para cada genótipo, os valores da Área Abaixo da Curva de Progresso da Doença (AACPD), conforme Shaner & Finney (1977), pela fórmula: 𝑛 𝐴𝐴𝐶𝑃𝐷 = 𝑖=1 𝑌𝑖+1 + 𝑌𝑖 ∗ [ 𝑇𝑖+1 − 𝑇𝑖 ] 2 Em que: n: é o número de observações. Yi: é a severidade da doença na “i”-ésima observação; Ti: é o tempo em dias na “i”-ésima observação; - Matéria Seca (%): Conforme metodologia da AOAC (1985), por meio da fórmula: 𝑃𝑒𝑠𝑜 𝑑𝑎 𝑝𝑙𝑎𝑐𝑎 𝑐𝑜𝑚 𝑎𝑚𝑜𝑠𝑡𝑟𝑎 −𝑃𝑒𝑠𝑜 𝑑𝑎 𝑝𝑙𝑎𝑐𝑎 𝑣𝑎𝑧𝑖𝑎 MS= 𝑃𝑒𝑠𝑜 𝑑𝑎 𝑎𝑚𝑜𝑠𝑡𝑟𝑎 Cada característica avaliada foi submetida a análise de variância e a comparação das médias foi feita pelo teste de agrupamento Scott_Knott (p=0,05%), utilizando o programa estatístico SISVAR (FERREIRA, 2008). RESULTADOS E DISCUSSÃO Nos resultados das médias de produtividade foram observadas diferenças estatísticas entre os genótipos (p≤0,05). A produtividade média entre os genótipos variou de 7,98 a 67,45 Mg ha-1, destacando-se os genótipos BDFMI#16 e Duda com produtividades de 67,45 e 55,42 Mg ha-1, respectivamente. O genótipo que apresentou a menor produtividade foi o BDFMI#70 (7,98 Mg ha-1) (Tabela 2). 47 Tabela 2: Médias para produtividade e teor de matéria seca (MS) em genótipos de batata-doce. UFT, Gurupi, 2014. PROD1 GENÓTIPOS BDFMI#04 BDFMI#10 BDFMI#16 BDFMI#31 BDFMI#38 BDFMI#40 BDFMI#51 BDFMI#57 BDFMI#70 BDFMI#89 BDFMI#93 BDFMI#94 BDFMI#106 2007HSF0128 2007HSF1405 Amanda Duda Itajuba Marcela Princesa C.V. (%) Média Geral Mg ha-1 52,25 A 39,46 B 67,45 A 40,72 B 27,22 C 33,33 C 38,15 B 23,57 C 7,98 C 18,28 C 48,06 B 28,55 C 37,83 B 44,17 B 18,17 C 20,56 C 55,42 A 37,22 B 21,35 B 21,39 C 28,72 34,06 MS (%)1 31,49 B 24,66 C 28,12 C 37,15 A 26,91 C 33,00 B 28,59 C 24,20 C 33,80 B 26,49 C 25,61 C 32,70 B 32,73 B 34,59 B 26,23 C 27,52 C 28,21 C 38,19 A 20,40 C 25,76 C 9,58 29,32 1 Médias seguidas pela mesma letra na coluna não diferem estatisticamente entre si pelo teste de ScottKnott (p≤0,05). Silveira (2008), em ensaios realizados no Tocantins durante dez anos com a cultura da batata-doce, a produtividade média da cultivar Duda foi de 65,50 Mg ha-1. Este resultado foi superior ao encontrado no experimento, mostrando que a severidade da doença no campo acarretou em redução na produtividade desta cultivar. Comportamento semelhante foi verificado para a cv. Marcela, que apresentou produtividade de 21,35 Mg ha -1, mas Silva (2010) e Amorin et al. (2011) relataram produtividades de 33,04 Mg ha-1 e 29,82 Mg ha-1 respectivamente. Em estudo sobre identificação agronômica de genótipos de batata-doce em Palmas-TO, Santana et al. (2013) encontraram valor de produtividade de 55,09 para a cv. Duda, corroborando com o valor encontrado neste experimento. 48 Já Gonçalves et al (2010) estudando o potencial produtivo de clones de batatadoce oriundos de famílias de meio-irmãos, obtiveram produtividade de 82,92 Mg ha -1, valor acima dos encontrados nos genótipos avaliados neste experimento. Nos resultados das médias de matéria seca da raiz foram observadas diferenças estatísticas entre os genótipos (p≤0,05). A média do teor de matéria seca entre os genótipos variou de 20,39 a 51,97%, destacando-se a cultivar Itajuba com 51,97% e o que apresentou menor teor de matéria seca foi a cv. Marcela com 20,39% (Tabela 2). Em estudos conduzidos por Gonçalves Neto et al. (2011), avaliando 36 acessos e 3 cultivares de batata-doce no Estado do Tocantins, o maior valor de matéria seca observado foi de 31,5%. Martins (2010), estudando a variabilidade fenotípica e divergência genética de batata-doce no Estado do Tocantins, encontrou valores que variaram de 24,53 a 39,13%. De acordo com Leonel & Cereda (2002), o teor de matéria seca tem relação direta na produção de carboidratos e conseqüentemente, no rendimento industrial, o que ressalta a importância de selecionar genótipos com alto teor de matéria seca. A percentagem de matéria seca, bem como açúcares, vitaminas e minerais varia de acordo com a variedade, condições climáticas, tratos culturais, épocas de colheita e duração de armazenamento (EMBRAPA, 1995). A severidade da doença foi crescente com o decorrer do tempo após o transplante (Figura 1). A partir da 5º avaliação já se notava a uma constante redução da área foliar e surgimento de plantas mortas. 49 Figura 1: Progresso temporal do mal-do-pé em genótipos de batata-doce no município de Gurupi, Tocantins.UFT, Gurupi-TO, 2014. Os primeiros sintomas da doença foram observados aos 120 DAT, coincidindo com o período de maior precipitação na região. Com o aparecimento de lesões marrons escuras recobertas por pequenos pontos pretos na haste de todos os genótipos avaliados, porém com diferença significativa quanto á severidade dos sintomas (Tabela 3). Alguns dos genótipos que apresentaram menor severidade da doença nas hastes, aos 140 DAT foram: Princesa (2,55), BDFMI#57 (2,88) e BDFMI#40 (2,91). Já os que apresentaram maior severidade foram: Duda (4,04), BDFMI#106 (4,03) e 2007HSF0128 (3,93). Esses resultados mostram a alto grau de virulência de P. destruens e os diferentes graus de resistência dos genótipos avaliados. Os genótipos BDFMI#106 e Duda apresentaram os maiores valores de AACPD, 4,04 e 4,03, respectivamente. Os genótipos que apresentaram menores valores de AACPD foram PRINCESA, BDFMI#40 e BDFMI#57, com 12,10, 11,47 e 11,40, respectivamente de acordo com o teste de Skott-Knott (p≤0,05). 50 Tabela 3: Severidade e Área Abaixo da Curva de Progresso da Doença (AACPD) em genótipos de batata-doce em condições de campo em Gurupi, região sul do estado do Tocantins. UFT, Gurupi, 2014. GENÓTIPOS SEVERIDADE AACPD BDFMI#04 3,55 A 15,82 A BDFMI#10 3,05 C 12,24 B BDFMI#16 3,44 B 15,54 A BDFMI#31 3,57 A 15,94 A BDFMI#38 3,96 A 16,11 A BDFMI#40 2,68 E 11,47 B BDFMI#51 2,91 D 12,66 B BDFMI#57 2,65 E 11,40 B BDFMI#70 3,09 C 13,59 B BDFMI#89 3,42 B 15,36 A BDFMI#93 3,19 C 14,00 B BDFMI#94 3,26 B 14,44 A BDFMI#106 3,74 A 17,10 A 2007HSF0128 3,93 A 16,72 A 2007HSF1405 3,55 A 16,02 A Amanda 3,29 B 14,57 A Duda 3,73 A 16,87 A Itajuba 3,14 C 13,63 B Marcela 3,34 B 14,84 A Princesa 2,77 E 12,10 B 3,31 14,52 Média Geral 25,72 26,17 C.V. (%) 1 Médias seguidas pela mesma letra na coluna não diferem estatisticamente entre si pelo teste de ScottKnott (p≤0,05). De acordo com Miranda (1989); Lopes & Silva (1994) e Truta et al. (2000), a cv. Princesa foi considerada como padrão de resistência ao mal-do-pé, contudo, esse comportamento não foi observado neste trabalho. Esses resultados concordam com os resultados apresentados por Mendes et al. (2012) e Pereira et al. (2013). Os genótipos BDFMI#40 e 2007HSF1405 apresentaram comportamentos distintos em laboratório, casa de vegetação e campo de produção. De acordo com Carson et al. (2002), a relação patógeno-hospedeiro é distinta entre locais, sendo que, em campos de produção, frequentemente observa-se significativa interação entre genótipo e ambiente, podendo haver variação na severidade da doença devido à instabilidade dos locos de resistência na interação com o ambiente e/ou diferenças na população do patógeno entre os ambientes 51 CONCLUSÕES Na presença de mal-do-pé, os genótipos mais produtivos foram BDFMI#16, Duda, BDFMI#04, BDFMI#93 e 2007HSF0128. O teor de matéria seca das raízes variou de 20,39 a 51,97%, destacando-se o genótipo Marcela com teor médio de 51,97%. Em condição de campo, os genótipos com maiores níveis de resistência genética foram BDFMI#57, BDFMI#40 e Princesa. REFERÊNCIAS BIBLIOGRÁFICAS AMORIN, B.S.C.; OLIVEIRA, G.I. SOUZA; SILVEIRA, M.A.; NASCIMENTO, I.R.; FERREIRA, T.A. Adaptabilidade fenotípica de genótipos de batata-doce oriundos de sementes botânicas na região Sul do Estado do Tocantins. Revista Brasileira de Tecnologia Aplicada nas Ciências Agrárias, Guarapuava-PR, v.4, n.3, p.31-50, 2011. AOAC. ASSOCIATION OF OFFICIAL ANALYTICAL CHEMISTS OFFICIAL. Methods of analysis of the Association of official Analytical Chemists. 12 ed. Washington, 1985. 1094 p. CAMPOS, G. A.; SILVEIRA, M. A.; ANDRÉ, C. M. G.; BESSA, G. F.; NOGUEIRA, S. R.; SANTANA, W. R. Avaliação da Biomassa de Clones de Batata-doce visando a Produção de Álcool. HORT BRAS 2002; 20(2). SUPLEMENTO 2. CARDOSO, A. D.; VIANA, A. E. S.; RAMOS, P. A. S.; MATSUMOTO, S. N.; AMARAL, C. L. F.; SEDIYAMA, T.; MORAIS, O. M. Avaliação de batata-doce em Vitória da Conquista. Horticultura Brasileira, v. 23, n. 4, p. 911-914, 2005. CARSON, M.L., GOODMAN, M.M.; WILLIAMSON, S.M. Variation in aggressiveness among isolates of Cercospora from maize as a potential cause of genotype-environment interaction in gray leaf spot trials. Plant Disease 86:1089–1093. 2002. 52 DAROS, M.; JÚNIOR, ATA.; PEREIRA, S.N.T.; LEAL, R.N.; FREITAS, P.S.; SEDIYAMA, T. Caracterização morfológica de acessos de batata-doce. Horticultura Brasileira, v. 20, n.1, p.421-426, 2002. CEAGESP. 2013. Especial: panorama da batata-doce. Disponível em: http://www.jornalentreposto.com.br/noticias/354-batata-doce. Acesso em 06/11/14. EMPRESA BRASILEIRA DE PESQUISA AGROPECUÁRIA. Centro Nacional de Pesquisa de Hortaliças. Cultivo da batata-doce (Ipomoea batatas (L.) Lam). 3. ed. Brasília, DF: Ministério da Agricultura, Abastecimento e Reforma Agrária, 1995. (EMBRAPA- CNPH. Instruções técnicas 7). FERREIRA, D.F. SISVAR - Sistema de análise de variância. Versão 5.3. Lavras-MG: UFLA, 2008. FILGUEIRA, F. A. R. Novo Manual de Olericultura. Agrotecnologia moderna na produção e comercialização de hortaliças. 3ª Ed. Viçosa. UFV. 2008. 371-376p. GONÇALVES, R. J. S.; CARVALHO, R. C.; GONÇALVES NETO, A. C.; MALUF, W. R.; LASMAR, A.; GOMES, M. S. Potencial produtivo de clones de batata-doce oriundos de famílias de meio-irmãos. Horticultura brasileira, v 28, n. 2, 2010. GONÇALVES NETO, A.C.; MALUF, W.R.; GOMES, L.A.A.; GONÇALVES, R.J.S.; SILVA, V.F.; LASMAR,A. Aptidões de genótipos de batata-doce para consumo humano, produção de etanol e alimentação animal. Pesquisa Agropecuária Brasileira, v. 46, n. 11, p. 1513-1520, 2011. FOOD AND AGRICULTURE ORGANIZATION OF THE UNITED NATIONS (FAO). 2008. Disponível em: http://faostat.fao.org/site/339/default.aspx Acesso em: 03 de SETEMBRO de 2014. IBGE - INSTITUTO BRASILEIRO DE GEOGRAFIA E ESTATÍSTICA, MINISTÉRIO DO PLANEJAMENTO, ORÇAMENTO E GESTÃO - Produção 53 agrícola municipal, culturas temporárias e permanentes, Prod. agric. Munic (2011). Rio de Janeiro, v. 38, p.1-97, 2012. KALKMANN, D.C. Produtividade, qualidade de raiz, resistência aos insetos de solo e aos nematoides-das-galhas e estimativas de parâmetros genéticos em clones de batatadoce, cultivados no Distrito Federal. Brasília: Faculdade de Agronomia e Medicina Veterinária, Universidade de Brasília, 2011, 144p. Dissertação de Mestrado. LEONEL, M.; CEREDA, M.P. Caracterização físico-química de algumas tuberosas amiláceas. Ciência e Tecnologia de alimentos, v. 22, n. 1, p. 65-69. Campinas, 2002. LOPES, C.A., SILVA, J.B.C. Management measures to control foot rot of sweet potato caused by Plenodomus destruens. International Journal of Pest Management, v.39, n.1, p.72-74, 1993. MAGALHÃES, K.A.B. Análise da sustentabilidade da cadeia produtiva de etanol de batata-doce no município de Palmas-TO. Dissertação de Mestrado - Fundação Universidade Federal do Tocantins, Programa de Pós-graduação em Ciências do Ambiente. 121 p. 2007. MARTINS, E.C.A. Variabilidade fenotípica e divergência genética em genótipos de batata-doce no Estado do Tocantins. Dissertação (Mestrado em Agroenergia)Universidade Federal do Tocantins, Palmas-TO, 42f, 2010. MANO, H.; OGASAWARA, F.; SATO, K.; HIGO, H.; MINOBE, Y. Isolation of a regulatory gene of anthocyanim biosynthesis in tuberous roots of purple-fleshed sweet potato. Plant Physiology, v. 143, p. 1252-1268, 2007. MENDES, L.S. PEREIRA, R.B.; AMARO, G.B.; PINHEIRO, J.B. Reação de cultivares de batata-doce ao mal-do-pé. II Jornada Científica da Embrapa Hortaliças, 31de julho e 1 de agosto, Embrapa Hortaliças 2012. 54 MIRANDA, J.E.C. Princesa: cultivar de batata-doce resistente ao"mal-do-pé" (Plenodomus destruens Harter). In:[CONGRESSO BRASILEIRO DE OLERICULTURA], 29, 1989, Recife. Horticultura Brasileira, v.7, p.65, 1989. MOULIN, M.M. Coleta, caracterização e conservação de variedades locais de batatadoce (Ipomoea batatas L. Lam) do Norte do Estado do Rio de Janeiro. Dissertação (Mestrado em Genética e Melhoramento de Plantas). UENF, Campos dos Goytacazes, RJ. 2010. PEREIRA, R. B.; CARVALHO, A.D.; PINHEIRO, J.B. Avaliação da resistência de cultivares de batata-doce ao mal-do-pé por meio de diferentes métodos de inoculação. Brasília, DF: Embrapa Hortaliças, 2013. 16 p. OLIVEIRA, A.C.B.; SEDIYAMA, M.AN.; SEDIYAMA, T.; CRUZ, C.D. Avaliação da divergência genética em batata-doce por procedimentos multivariados. Acta Scientiarum, v. 22, n. 4, p. 895-900, 2000. SANTANA, W.R.; GONÇALVES, R.C.; MARTINS, SOUZA, L.P.; F.R. SILVEIRA, RESPLANDES, M.A. SANTOS, W.F.; G.R.S.; LIMA, M.M. Identificação agronômica de genótipos de batata-doce em banco de germoplasma para fins industriais de etanol carburante. Tecnol. & Ciên. Agropec., João Pessoa, v.7, n.1, p.31-34, mar. 2013 . SHANER, G.; FINNEY, R.E. The effect of nitrogen fertilization on the expression of slow- mildewing resistance in Knox wheat. Phytopathology, St. Paul, v.67, n.8, p.1051-1056, 1977. SILVA, J. O. V. Comparação entre metodologias visando obtenção de maior rendimento de etanol a partir da batata-doce [Ipomoea batatas (l.) Lam.], em PalmasTO. Palmas, 2010. Dissertação (Mestrado) – Universidade Federal do Tocantins, Curso de Mestrado em Agroenergia, 2010. 60p. 55 SILVA, J.C.S. Performance agronômica de genótipos de batata-doce obtidos de sementes botânicas com potencial para produção de etanol. Dissertação (Mestrado em Produção Vegetal), Universidade Federal do Tocantins, UFT, Gurupi, 2010. 57 p. SILVEIRA, M.A. Batata-Doce: uma nova alternativa para a produção de etanol. In: Álcool combustível - Série Indústria em Perspectiva. Instituto Euvaldo Lodi. Núcleo Central. cap. 8, p.109 – 122. Brasília, 2008. SILVA, J.B.C., LOPES, C.A., MAGALHÃES, J.S. Cultura da batata-doce. In: Cereda, M. P. Agricultura: tuberosas amiláceas latino americanas. São Paulo: Cargill. 2:449503. 2002. TRUTA, A.A.C.; ARAÚJO, E.; SILVA, V. F. Reações de cultivares e controle químico do mal-do-pé da batata doce na microrregião do Brejo, Paraíba. Agropecuária Técnica, Areia, v. 2 – 2000. VILAS BOAS, B.M.; OKUMURA, H.H.; MALUF, W.R. Cultura da batata-doce. Boletim Técnico de Hortaliças. Lavras, n 42, p.1-3. 1999. 56 ANEXOS Resumo das tabelas de análise de variância Variável analisada: Lesão (cm). Valores transformados para √(x+1). FONTE DE VARIAÇÃO Isolados Genótipos Dias Isolados*Genótipos Isolados*Dias Genótipos*Dias Isolados*Genótipos*Dias Erro C.V. (%) Média geral GL QM1 25 4,300* 1 6,337* 5 14,127* 25 2,694ns 125 0,314ns 5 0,397ns 125 0,218ns 312 0,275 32,25 1,62 Variável analisada: tamanho da lesão (cm) Valores transformados para √(x+1). FONTE DE VARIAÇÃO GL QM1 Genótipos 35 0,524* Isolados 1 0,380* Dias 7 1,025* Genótipos*Isolados 35 0,163* Genótipos*Dias 245 0,040ns Isolados*Dias 7 0,038ns Genótipos*Isolado*Dias 245 0,015ns Erro 2304 0,045 19,57 C.V. (%) Média geral 1,08 SEVERIDADE Teste: Skott-Knott (p=0,05). Dados transformados para √(x+1). 57 FONTES DE VARIAÇÃO GL QM1 Blocos 2 1,044NS Genótipos 19 16,762* Avaliações 7 366,541* Erro 2995 0,679 C.V. (%) 25,21 MÉDIA GERAL 3,27 Produtividade Fonte de Variação GL PROD 7,79ns 36,673ns 19 661,326* 59,78* 38 95,679 0,679 C.V. (%) 28,72 26,17 Média Geral 34,06 14,52 65,213* 7,894 9,58 29,32 Blocos Genótipos Erro 2 161,113ns QM1 AACPD MS (%)
Download