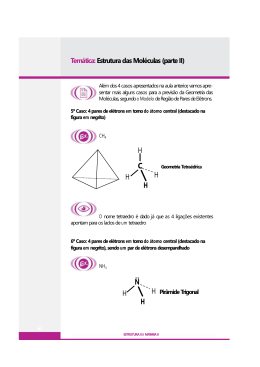
LABORATÓRIO ATIVIDADE Roberto Gois Aluno(a): ________________________________________________________ Série: 1ª Ensino Médio Turma: ________ Data: / / 2015 Pós-Laboratório 01- O modelo de repulsão dos pares de elétrons da camada de valência estabelece que a configuração eletrônica dos elementos que constituem uma molécula é responsável pela sua geometria molecular. Observe as duas colunas a seguir: Geometria molecular 1. linear 2. quadrada 3. trigonal plana 4. angular 5. pirâmide trigonal 6. bipirâmide trigonal Moléculas A. SO3 B. NH3 C. CO2 D. SO2 A alternativa que traz a relação correta entre as moléculas e a respectiva geometria é: a) 5A - 3B - 1C - 4D b) 3A - 5B - 4C - 6D c) 3A - 5B - 1C - 4D d) 5A - 3B - 2C - 1D e) 2A - 3B - 1C - 6D 02- (Vunesp) A partir das configurações eletrônicas dos átomos constituintes e das estruturas de Lewis: a) Determine as fórmulas dos compostos mais simples que se formam entre os elementos (números atômicos: H = 1; C = 6; P = 15): I. hidrogênio e carbono; II. hidrogênio e fósforo. b) Qual é a geometria de cada uma das moléculas formadas, considerando-se o número de pares de elétrons? 03- (Unicamp-SP) Considerando as moléculas NH3, CH4, CO2 e H2O, indique a configuração espacial de cada uma delas, utilizando a terminologia: linear, angular, piramidal, quadrangular, tetraédrica. 04- (UNIP-SP – mod.) Determine a geometria das moléculas: 1 2
Baixar