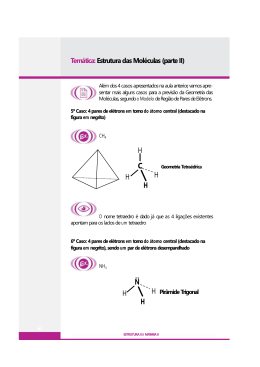
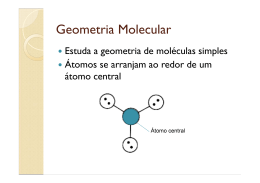
Geometria Molecular Teoria da repulsão dos pares de elétrons da camada de valência • Pares de elétrons ao redor do átomo central (ligados ou livres) se comportam como nuvens eletrônicas que se repelem até a máxima distância angular possível. • Ligações duplas ou triplas são consideradas como uma única nuvem eletrônica. Moléculas Diatômicas • Com átomos iguais ou diferentes, a molécula é sempre linear e o ângulo é de 180º. Exemplos: HBr e HCl Moléculas com três átomos - AX2 • Sem elétrons livres no átomo central a geometria é linear e o ângulo é de 180º. Exemplos: CS2 e CO2 • Moléculas com um par de elétrons livres no átomo central geometria angular. Exemplo: SO2 • Moléculas com dois pares de elétrons livres no átomo central geometria angular. Exemplos: H2O e OF2 Moléculas com quatro átomos – AX3 • Sem elétrons livres no átomo central a geometria é trigonal plana ou triangular e o ângulo é de 120º. Exemplos: BF3 e BI3 • Moléculas com um par de elétrons livres no átomo central geometria piramidal Exemplo: NH3 Moléculas com cinco átomos – AX4 • Sem elétrons livres no átomo central a geometria é tetraédrica e o ângulo é de 109º28´. Exemplos: CI4 e SiBr4 Exceções: Octeto Expandido • PCl5 Cinco nuvens ligantes ao redor do átomo central. Geometria: bipirâmide trigonal ou bipirâmide de base triangular. • SF6 Seis nuvens ligantes ao redor do átomo central. Geometria: bipirâmide de base quadrada ou octaédrica. Exercícios • Edição Antiga: • Fundamentais: todos • Testando: 1, 2 e 3 • Aprofundando: 3, 5 e 9 • Edição Nova: • Fundamentais: todos • Testando: 2, 4 e 5 • Aprofundando: 3, 5 e 7
Baixar