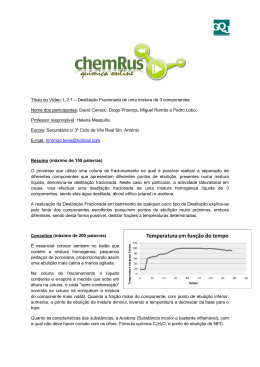
Destilação A destilação é, basicamente, uma técnica de separação de mistura que se baseia nos diferentes pontos de ebulição das substâncias. Tornou-se um dos processos mais comuns nas indústrias químicas, desde a farmacêutica até a petroquímica. Uma das propriedades físicas com as quais mais convivemos no dia-a-dia é a volatilidade de diferentes substâncias. Quem não sabe que a acetona evapora mais rápido do que o álcool e este, por sua vez, mais rápido que a água? Para entendermos esse processo, temos que perceber que nem todas as moléculas de um líquido possuem a mesma energia, algumas são mais lentas e outras mais rápidas, mas a maioria delas apresenta um grau de agitação médio (energia cinética). No caso de moléculas mais energéticas, elas conseguem romper as ligações intermoleculares que as mantêm presas no interior do líquido, atingindo a superfície do líquido e, assim, escapam para a atmosfera. Estando o sistema aberto, o fenômeno vai ocorrer de forma contínua até todo o líquido desaparecer, fenômeno chamado evaporação. Num sistema fechado o fenômeno também ocorre, só que as moléculas não conseguem escapar. À medida que aumenta a concentração de moléculas de vapor, elas acabam se chocando entre si ou com o próprio líquido. Como conseqüência dos choques, acontecem as transferências de energia entre as moléculas. Aquelas com menor grau de agitação são novamente capturadas pelas forças intermoleculares e voltam ao estado líquido, isto é, sofrem condensação. Depois de algum tempo, o sistema entra em equilíbrio dinâmico, com as moléculas passando continuamente do estado líquido para o vapor e do vapor para o líquido. O equilíbrio é atingido quando a velocidade do processo de evaporação se torna igual à velocidade do fenômeno de condensação, mantendo constantes as concentrações do vapor e do líquido, mesmo que suas quantidades não sejam iguais entre si. Processos de Destilação Destilação Simples Separação utilizada quando o soluto da solução não é volátil. O líquido contido no balão de destilação é evaporado, logo depois resfria ao passar por um condensador e, por fim, é recolhido em outro recipiente. As substâncias não voláteis, mantidas no balão de destilação, são os chamados resíduos. No caso de misturas de líquidos, esta técnica não é adequada quando a diferença entre os pontos de ebulição é inferior a 80 °C ou se um dos componentes se apresenta numa concentração muito pequena (menor que 10%), porque os componentes acabam sendo destilados concomitantemente, como caracteriza a variação de temperatura durante a ebulição. Nestas situações, seriam necessárias sucessivas destilações até atingir uma fração que fosse pura. Para evitar repetições, é mais adequado efetuar a destilação fracionada. O que é Ponto de Ebulição? É a temperatura na qual um líqüido vence a pressão atmosférica, passando para o estado gasoso (mudança de estado). Em altitudes diferentes, uma mesma substância apresenta pontos de ebulição diferentes. Quanto maior a altitude, menor é a pressão atmosférica e, portanto, menor é o ponto de ebulição. Ponto de Fulgor É a menor temperatura na qual um líquido combustível ou inflamável desprende vapores em quantidade suficiente para que a mistura vapor-ar, logo acima de sua superfície, propague uma chama a partir de uma fonte de ignição. Os vapores liberados a essa temperatura não são, no entanto, suficientes para dar continuidade a combustão. A pressão atmosférica influi diretamente nesta determinação. Destilação Fracionada É feita com um aparato em que uma coluna separa o balão de destilação do condensador. A coluna é cheia com pequenas pérolas de vidro, o que gera uma grande superfície de contato sobre a qual o componente menos volátil do vapor pode condensar e retornar ao balão de destilação. O componente mais volátil move-se com maior facilidade para cima, pela coluna, e passa ao destilado. Destilação a Vácuo (pressão reduzida) Realizada sob pressão atmosférica reduzida. Como a temperatura de ebulição de um líquido é atingida quando a pressão de vapor se iguala à pressão externa, ao se diminuir artificialmente a pressão sobre o líquido consegue-se realizar a destilação a uma temperatura inferior ao ponto de ebulição normal. A vantagem é poder purificar líquidos que se decompõem antes mesmo de entrarem em ebulição ou que precisam de elevadas temperaturas para serem destilados. Na execução dessa técnica utiliza-se uma aparelhagem similar à da destilação fracionada, com a diferença de que se adapta uma bomba de vácuo que reduzirá a pressão do meio. A nova temperatura pode ser estimada com o auxílio de uma tabela que relaciona colunas de temperatura com pressão (nomograma).
Baixar