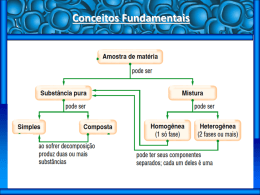
QUÍMICA TECNOLÓGICA Profa. Dra. Aline Rodrigues Soares [email protected] OBJETIVOS Possibilitar o entendimento das características físicoquímicas das substâncias, das reações envolvidas e das propriedades dos produtos químicos formados, bem como a interação direta ou indireta nos diversos segmentos, seja no cotidiano ou nas indústrias; Reconhecer e estabelecer as relações críticas entre o conhecimento dos processos químicos e o meio ambiente; - Mostrar a importância dos conhecimentos da química e suas inter-relações diretas e indiretas com as tecnologias aplicadas aos diversos campos da engenharia. EMENTA Princípios básicos da estrutura atômica e molecular. A Tabela Periódica e suas relações com as propriedades dos metais, não metais, gases nobres e metais de transição. Fórmulas e reações químicas. Funções inorgânicas. Eletroquímica. Química da corrosão. REFERÊNCIAS BIBLIOGRÁFICAS ATKINS, P.; LORETTA, J. Princípios de Química: Questionando a vida moderna e o meio ambiente. 2ed. Porto Alegre: Bookman, 2001. KOTS, J. C.; TREICHEL, P. M.; WEAVER, G. C. Química Geral. 6 ed. – Cengage, 2010. MAHAN, B. H. Química um Curso Universitário. 2ed. Edgard Blucher LDTA, 1986. GENTIL, V. Corrosão. 4ª ed. Rio de Janeiro: Livros Técnicos e Científicos, 2003. Estudo da Matéria O universo é composto por matéria e energia Matéria é tudo aquilo que tem massa e ocupa lugar no espaço Energia, é a capacidade de realizar trabalho, nas mais diferentes formas Propriedades da Matéria: Propriedades Gerais Propriedades Específicas Organolépticas Químicas Físicas Estados Físicos da Matéria Mudanças de Estado Físico Fusão Solidificação Vaporização Condensação Elementos Químicos, Símbolos Químicos e Fórmulas Químicas H2SO4 “TODA MATÉRIA É FORMADA POR ÁTOMOS OU ÍONS”. Elemento químico A matéria é formada por átomos. O conjunto de cada um desses tipos de átomos representa um elemento químico. Substância química A reunião dos elementos forma as substâncias, assim como a reunião das letras do alfabeto forma as palavras. Substância Pura Formada por moléculas (ou agregados iônicos) todas iguais entre si. Tem propriedades e características bem definidas e composição química constante. Mistura É a reunião de duas ou mais substâncias puras que não interagem (as moléculas permanecem inalteradas - fenômeno físico). Mistura Eutética Apresentam temperatura de fusão constante e temperatura de ebulição variável. Mistura Azeotrópica Apresentam temperatura de ebulição constante e temperatura de fusão variável. FENÔMENO FÍSICO E FENÔMENO QUÍMICO Fenômeno Físico: Processo no qual não há alteração da estrutura da matéria, com formação de novas substâncias. As mudanças de estado físico. Aquecer o ferro até que fique incandescente. Adicionar açúcar à água(formação de mistura). Fenômeno Químico: Processo no qual há alteração da estrutura da matéria, com formação de novas substâncias. Que observações experimentais devem indicar a ocorrência de uma reação química? Liberação de gases Formação de precipitado Mudanças inesperadas de cor e aspecto Substância simples e substância composta Substância simples: É o tipo de substância que não pode ser decomposta por agentes físicos; não é capaz de originar outras substâncias. É formada por átomos de um mesmo elemento químico. Ex: H2, O2, N2, He, Fe. Substância composta ou composto químico: É aquela que, por ação de um agente físico (calor, luz eletricidade), sofre reação de decomposição, originando duas ou mais substâncias (que podem ser simples ou compostas). Ex: CO2, H2O, NH3, HCl, NaCl, KNO3 Tipos de misturas Homogêneas: Apresentam o mesmo aspecto em todos os pontos, isto é, são do ponto de vista visual, homogêneas. Heterogêneas: Podemos distinguir seus componentes (visualmente ou através de microscópios). Ex: Água e areia; óleo e vinagre; leite. Aula 1 - Aplicação 1. Defina: a) ponto de fusão b) ponto de ebulição c) transformação física d) transformação química 2. Julgue as afirmativas em verdadeiro ou falso, justificando seu julgamento. a) Qualquer gás próximo à temperatura de condensação é mais desorganizado que os demais estados físicos. b) Qualquer líquido próximo ao ponto de ebulição é mais desorganizado que o estado gasoso. c) Uma substância qualquer no estado sólido próximo ao seu ponto de fusão é mais organizado que seu líquido. 3. Analisando os dados da tabela, indique o estado físico à pressão ambiente (1 atm): a) De cada substância à temperatura de 25°C; b) Do álcool etílico à 50°C; c) Do éter etílico à -130°C; d) Do oxigênio à -200°C; e) Do cloreto de sódio à temperatura de 1000°C; f) Do ferro e do chumbo à 2000°C. 4. Quando você assopra a sua pele úmida de água, sente que a pele esfria. Explique. 5. Bolinhas de naftalina são colocadas nos roupeiros para combater as traças, pois elas danificam as roupas. Com o tempo as bolinhas diminuem de tamanho. Explique a causa desse acontecimento. 6. (ACAFE) Algumas substâncias em contato com a pele, nos dão uma sensação de estarem frias. Dentre elas podemos destacar o éter comum. Isso ocorre por que: a) o éter ao cair na pele, evapora, e este é um processo exotérmico. b) o éter ao cair na pele, evapora, e este é um processo endotérmico. c) o éter reage endotermicamente com substâncias da pele. d) o éter sublima. e) o éter é resfriado. 7. (VUNESP) Indique a alternativa que indica um fenômeno químico: a) Dissolução de cloreto de sódio em água. b) Fusão da aspirina. c) Destilação fracionada de ar líquido. d) Corrosão de uma chapa de ferro. e) Evaporação da água do mar. 8. As mudanças de estado que a água apresenta em função da temperatura podem ser esquematizadas como: Substitua os números de 1 a 5 pelo nome da transformação que representa, em seguida, indique se a transformação é endotérmica ou exotérmica. Métodos de Separação ou Fracionamento de Misturas: Conjunto de processos FÍSICOS que visam separar os componentes de uma mistura sem alterá-los. Esquema geral simplificado: MISTURAS HETEROGÊNEAS Filtração: A separação se faz através de uma superfície porosa chamada filtro; o componente sólido ficará retido sobre a sua superfície, separando-se assim do líquido que atravessa Filtração à vácuo: A filtração pode ser acelerada pela rarefação do ar, abaixo do filtro. Nas filtrações sob pressão reduzida, usa-se funil com fundo de porcelada porosa (funil de Büchner) Decantação Permite a separação de líquidos imiscíveis (que não se misturam) ou um sólido precipitado num líquido. Exemplos: água e areia e água e óleo vegetal. Centrifugação Para acelerar a sedimentação do sólido, pode-se recorrer à centrifugação , como ocorre de rotina na realização de exames de sangue, e separação dos componentes do leite. Flotação: Trata-se a mistura com um líquido de densidade intermediária em relação às dos componentes. O componente menos denso que o líquido flutuará, separando-se assim do componente mais denso, que se depositará. O líquido empregado não deve, contudo, dissolver os componentes. Também é denominado de sedimentação fracionada. Veja o exemplo: Dissolução Fracionada ou Extração: Trata-se a mistura com um líquido que dissolva apenas um dos componentes. Posteriormente, por filtração, separa-se o componente nãodissolvido; por evaporação (ou destilação) da solução, separase o componente dissolvido no líquido. Veja o exemplo a seguir: Catação É um método de separação bastante rudimentar, usado para separação de sistemas sólido-sólido. Baseia-se na identificação visual dos componentes da mistura e na separação dos mesmos separando-os manualmente. É o método utilizado na limpeza do feijão antes do cozimento. Peneiração Também conhecido como tamisação, este método é usado na separação de sistemas sólido-sólido, onde um dos dois componentes apresente granulometria que permita que o mesmo fique preso nas malhas de uma peneira. Separação magnética Só pode ser usada quando um dos componentes é atraído por um imã. Veja: Sublimação Só pode ser aplicada quando uma das fases sublima com facilidade. É empregada na purificação do iodo e do naftaleno. MISTURAS HOMOGÊNEAS Evaporação ou Cristalização Consiste na evaporação do solvente e consequente cristalização dos sais diluídos. Exemplos: salinas Destilação simples Para a separação dos componentes das misturas homogêneas sólido-líquido, recorre-se comumente a destilação simples. O princípio do processo consiste em aquecer a mistura até a ebulição; com isso o componente líquido separa-se do sistema sob a forma de vapor, que a seguir é resfriado, condensandose, e o líquido é recolhido em outro recipiente. Veja: Destilação fracionada Para a separação dos componentes das misturas homogêneas líquido-líquido, recorre-se comumente à destilação fracionada. Aquecendo-se a mistura em um balão de destilação, os líquidos destilam-se na ordem crescente de seus pontos de ebulição e podem ser separados. O petróleo é separado em suas frações por destilação fracionada. Veja: Uma mistura de álcool, acetona e água (por exemplo), também pode ser separada por destilação fracionada. destilação fracionada. O que diferencia a aparelhagem da destilação simples é a adição da coluna de fracionamento. Exercícios 1) A obtenção do álcool etílico hidratado, a partir da cana-de-açúcar, pode ser representada pelo esquema a seguir. Em I e IV, que envolvem processos de fracionamento, são realizadas, respectivamente, 2) Na preparação do café a água quente entra em contato com o pó e é separada no coador. As operações envolvidas nessa separação são, respectivamente: a) destilação e decantação. b) filtração e destilação. c) destilação e coação. d) extração e filtração. e) extração e decantação.
Baixar