UNIVERSIDADE DO ESTADO DO AMAZONAS
FUNDAÇÃO DE MEDICINA TROPICAL DO AMAZONAS
PROGRAMA DE PÓS-GRADUAÇÃO EM MEDICINA TROPICAL
DOUTORADO EM DOENÇAS TROPICAIS E INFECCIOSAS
LEISHMANIOSE MUCOSA – ESTUDO DE CASOS ATENDIDOS EM UM
CENTRO DE REFERÊNCIA EM MANAUS, AMAZONAS
JORGE AUGUSTO DE OLIVEIRA GUERRA
MANAUS
2009
i
JORGE AUGUSTO DE OLIVEIRA GUERRA
LEISHMANIOSE MUCOSA - ESTUDO DE CASOS ATENDIDOS EM UM
CENTRO DE REFERÊNCIA EM MANAUS, AMAZONAS
Tese apresentada ao Programa de PósGraduação em Medicina Tropical da
Universidade do Estado do Amazonas em
Convênio com a Fundação de Medicina
Tropical do Amazonas, para obtenção do
título de Doutor em Doenças Tropicais e
Infecciosas.
Orientador (a): Prof. Dr. Luiz Carlos de Lima Ferreira
Co-orientador (a): Profª Dra. Maria das Graças Vale Barbosa
MANAUS
2009
Ficha Catalográfica
G934lei
Guerra, Jorge Augusto de Oliveira.
Leishmaniose mucosa – estudo de casos atendidos em um
Centro de Referência em Manaus, Amazonas / Jorge Augusto de
Oliveira Guerra. -- Manaus: Universidade do Estado do
Amazonas, Fundação de Medicina Tropical, 2012.
131 f. : il.
Tese de Doutorado do Programa de Pós-Graduação em
Medicina Tropical – UEA/FMT, 2012.
Orientador: Prof.. Dr. Luiz Carlos de Lima Ferreira.
Co- orientadora: Profª Drª Maria das Graças Vale Barbosa
1. Leishmaniose mucosa 2. Saúde Pública - Amazônia I.
Título.
CDU: 616.993.161
Ficha Catalográfica elaborada pela Bibliotecária Sheyla Lobo Mota.
ii
FOLHA DE JULGAMENTO
LEISHMANIOSE MUCOSA – ESTUDO DE CASOS ATENDIDOS
EM UM CENTRO DE REFERÊNCIA EM MANAUS, AMAZONAS
JORGE AUGUSTO DE OLIVEIRA GUERRA
“Esta Tese foi julgada adequada para obtenção do Título de Doutor em
Doenças Tropicais e Infecciosas, aprovada em sua forma final pelo
Programa de Pós-Graduação em Medicina Tropical da Universidade do
Estado do Amazonas em convênio com a Fundação de Medicina Tropical
Dr. Heitor Vieira Dourado”.
Banca Julgadora:
_______________________________
Prof. Luiz Carlos de Lima Ferreira Dr.
Presidente
_____________________
Prof. Sinésio Talhari, Dr.
Membro
________________________________________
Prof. Marcus Vinicius Guimarães de Lacerda, Dr.
Membro
__________________________
Profª. Alda Maria Da Cruz, Dra.
Membro
____________________________
Prof. Fernando Tobias Silveira, Dr.
Membro
iii
A minha esposa amada Graça Vale, pelo carinho que nunca faltou,
incentivo, apoio, compreensão, sendo um exemplo para mim.
Aos meus filhos Esdras e Ciro e aos meus pais Lizete e Leonardo!
A Alaíde, a Franciele e Ida Cristina, in memoriam!
iv
AGRADECIMENTOS
A Deus pela minha vida e por todas as coisas recebidas ou perdidas até aqui.
Aos meus pais Leonardo e Lizete, por terem me incentivado a seguir em frente.
A minha esposa Graça Vale, por tudo que representa: apoio, compreensão e acima de
tudo o amor que me dedica.
Aos meus filhos Esdras e Ciro, pelo tempo roubado de convívio por necessidade da
realização deste trabalho.
Aos meus irmãos pelo carinho e apoio.
A Universidade do Estado do Amazonas e a Fundação de Medicina Tropical do
Amazonas, pela possibilidade de realização deste trabalho.
Ao Dr. Luiz Carlos de Lima Ferreira pela orientação, ensinamentos e dedicação
profissional.
À Coordenação do Curso de Pós-graduação em Doenças Infecciosas e Parasitárias
EUA/FMTAM, pelo apoio inestimável, provendo todas as necessidades concernentes a
este trabalho.
Ao Dr. Sinésio Talhari pelo apoio dado.
A Superintendência da Zona Franca de Manaus SUFRAMA pelo suporte financeiro ao
Programa de pós-graduação.
A Marcilene Gomes Paes, minha grande mentora,
encorajamento, e exemplo de profissionalismo e de vida.
pelos
ensinamentos,
v
Ao Dr. Renato Telles pelo atendimento dos pacientes, e apoio prestado com sua
grande experiência, fundamental neste trabalho.
A Leila Inês de Aguiar Câmara Coelho, grande companheira de trabalho, pelo apoio
nos bons e maus momentos.
A amiga e parceira de pesquisas Maria Luíza Garnelo, pelo incentivo e experiências
partilhadas nessa Amazônia.
Ao Prof. Dr. Henrique Manuel Condinho da Silveira, pelo apoio, e orientação no
desenvolvimento das técnicas biologia molecular, sem o qual uma parte importante
desse trabalho não seria realizado.
Aos alunos do curso de Residencia Médica em Otorrinolaringologia da Universidade
Federal do Amazonas, Thiago Meneghinni, Alexandre Ribera Marcião, Rafael
Carvalho e Renata Santana, pelo acompanhamento otorrinolarigológico dos
pacientes.
A Suzane Ribeiro Prestes, por ter aceitado o desafio de identificar as espécies de
Leishmania, muito obrigado.
Aos companheiros da Gerencia de Leishmaniose: Marcus Guerra, Marcus Barros,
Roosevelt Soares, Rita Teixeira, Osmarina Batista, Maria José, Angelina Amélia
Bitencourt, Maria de Fátima Bentes, Ulisses Souza, Claudemir Felix pela
colaboração e convívio.
Aos alunos (bolsista e colaboradores) Pricila Gama, Aristoteles Moura, Lessandra
Bindá, Maria José Silva, Thiago Almeida, pela ajuda na realização deste trabalho.
Ao pessoal da Coordenação da Pos-graduação, Conceição Tufic, Marcos Castro,
Samantha e Bruno, sempre prontos a nos atender e servir.
Aos funcionários do Ambulatório de Dermatologia da FMTAM.
vi
Ao Dr. Ribamar Araújo e Rosilene Viana e Sandra Caranha, pelas biópsias
analisadas.
Ao Roberto Moreira Júnior pelo apoio no desenvolvimento da técnica de biologia
molecular.
A Omarina Guerra pela paciência e disposição em corrigir meus “esses” e “estes” ou
“essas” e “estas”.
Aos pacientes que concordaram em participar deste estudo.
A Marco Saboía pela confecção dos mapas temáticos
Aos colegas que me enviaram alguns dos pacientes que compuseram este estudo.
A todos que de uma forma ou de outra contribuíram para a realização deste
trabalho, meu muito obrigado.
vii
...mas aqueles que esperam no Senhor, renovam suas forças,
correm e não se cansam, caminham e não se fadigam.
Isaías 40:35
viii
RESUMO
A Leishmaniose Mucosa (LM) é um problema de saúde pública em várias
partes do mundo, em especial nas Américas, sendo conhecida como
“espúndia”, onde a maioria dos casos está concentrada no Brasil. Nos casos de
LCM, as destruições parciais ou totais das membranas da mucosa nasal, boca,
tecidos adjacentes levam a deformidades grosseiras do nariz e boca; assim, o
diagnóstico e a instituição de medidas terapêuticas precoces irão prevenir as
seqüelas e as complicações. É necessário conhecer sua distribuição e os
fatores ligados à sua ocorrência na Região Amazônica. Este estudo teve como
objetivos o estudo de casos de LTA/LM analisando os aspectos clínicos,
epidemiológicos, diagnósticos e terapêuticos em pacientes atendidos na
Fundação de Medicina Tropical do Amazonas (FMTAM) no período de janeiro
de 1992 a dezembro de 2008, dividido em uma parte retrospectiva (janeiro de
1992 a junho de 2006) e uma prospectiva (julho de 2006 a dezembro de 2008).
A justificativa deste estudo é que não há, poucos estudos avaliando a etiologia
dos casos e os aspectos clínicos diagnósticos e terapêuticos da LM na região.
Foram avaliados 234 casos de LM, sendo 184 (78,6%) no estudo retrospectivo
e 50 (21,4%) no prospectivo e observou-se: sexo masculino 193 (82,5%),
feminino 41 (17,5%); faixa etária 47,7 anos (8 a 87), predominância de 51 a 60
anos (55 casos); história de LC anterior 193 (82,5%); 156 70 (66,7%)
procediam de municípios e estados da calha sul do rio Amazonas; 186 (79,5%)
desenvolviam atividades relacionadas com extrativismo à época da provável
exposição; LC anterior 193 (82,5%) pacientes (desses 176 informaram
tratamento, sendo 112 (63,6%) considerados irregulares). Lesão em septo
nasal 232 (98,7%);109 (46,6%) apresentavam perfuração nasal/oral; 18
apresentavam formas orais de acometimento. A Reação de Cadeia de
Polimerase (PCR) foi positiva em 56 casos, 30 para Leishmania (Viannia)
braziliensis e 16 pra L. (V.) guyanensis, em 10 amostras a espécie não foi
identificada. A Intradermo reação de Montenegro (IDRM) foi positiva em 209
(97,7%) dos 214 realizados; a histopatologia foi compatível ou positiva para LM
em 124 (71,3%) dos 174 em que havia registros do resultado; A sorologia foi
positiva em 85 (38,6%) dos 220 realizados; No desfecho final do tratamento,
171 (73,1%) pacientes foram considerados clinicamente curados, 60 (25,6%)
foram perda de seguimento e três (1,2%) estão em acompanhamento. Concluíse que a LM na região tem perfil semelhante ao restante do País, com
predominância de sexo masculino, história de LC anterior, procedência de
regiões de calha sul do rio Amazonas, exposição relacionada a atividades de
extrativismo e predominância da L. (V.) braziliensis entre as espécies
caracterizadas, demonstrando também que a Leishmania (Viania) guyanensis é
a espécie causadora em 1/3 dos casos caracterizados.
Palavras-chave: Leishmaniose Mucosa, Amazônia, Leishmania (Viania)
braziliensis
ix
ABSTRACT
Mucosal Leishmaniasis (ML) is a public health problem in many parts of the
world, especially in the Americas, known as "espúndia", where the majority of
the cases are concentrated in Brazil. In the case of MCL, the partial or total
destruction of the nasal mucous membranes, mouth, adjacent tissues leading to
gross deformities of the nose and mouth, so, early diagnostic and therapeutic
measures will prevent the sequelae and complications. It is necessary to know
its distribution and the factors related to its occurrence in the Amazon region.
The aim of this study was to analyze the significance of clinical and
epidemiological findings, diagnosis and treatment of ML attended at Tropical
Medicine Foundation of Amazonas (FMTAM) from January 1992 to December
2008, divided into a retrospective study(January 1992 to June 2006) and
prospective study (July 2006 to December 2008). The justification for this study
is that there is any published study in the state of Amazonas utilizing scientific
method, evaluating the etiology, clinical aspects of diagnosis and treatment of
ML. It was analyzed 234 cases of ML, 184 (78.6%) in the retrospective study
and 50 (21.4%) in the prospective and observed: male 193 (82.5%), female 41
(17.5% ), median age 47.7, from 8 to 87 years, mainly 51 to 60 years 55 cases,
history of previous CL 193 (82.5%) 156 (66.7%) from cities and states south of
the Amazon River; 186 (79.5%) developed extractive activities related to the
time of probable exposure; previous CL 193 (82.5%) patients (176 reported
such treatment, and 112 (63.6%) considered irregular) . Lesion in the nasal
septum 232 (98.7%), 109 (46.6%) had septal/oral perforation, 18 had oral forms
of involvement. The Polymerase Chain Reaction (PCR) was positive in 56
cases, 30 for Leishmania (Viannnia) braziliensis and 16 for L. (V.) guyanensis,
in 10 samples the species was not identified. The Montenegro skin test (MST)
was positive in 209 (97.7%) of the 214 examined; histopathology was consistent
with ML or positive for ML in 124 (71.3%) of 174 which had the result records;
Serology was positive in 85 (38.6%) of 220 examined; the final outcome of
treatment, 171 (73.1%) patients were considered clinically cured, the follow-ups
of 60 patients (25.6%) were lost and three (1.2%) are in attendance. We
concluded that the ML in this region has a similar profile to the rest of the
country, with a predominance of male gender, history of previous CL, patients
came from regions south of the Amazon River, exposure related to extractive
activities and with a prevalence of L. (V.) braziliensis among species.
Key-words: Mucosal Leishmaniasis. Amazonia.
braziliensis. Leishmania (Viannia) guyanensis
Leishmania
(Viannia)
x
LISTA DE FIGURAS
TESE
Figura 1
Modalidades das Leishmanioses no Brasil......................................................
13
Mucosal Leishmaniasis in a Tertiary Reference Unit in the Amazon.
Distribution of patients by gender and age-group............................................
54
Artigo 1
Figure 1
Figure 2
Mucosal Leishmaniasis in a Tertiary Reference Unit in the Amazon.
Geographic prevalence of cases period (1992 to 2008) according to
municipality source on Brazilian Amazonian region......................................... 55
Artigo 2
Figure 1
Spatial distribution of ML cases by species according to the municipality of
origin………………………………………………………………………………...
75
xi
LISTA DE TABELAS
TESE
Tabela 1
Casos de LTA por regiões – Brasil 1999 a 2005......................................
05
Tabela 2
Distribuição das espécies de Leishmania causadoras de doença
humana......................................................................................................
07
Tamanho em pares de base dos produtos de restrição enzimática com
HaeIII
e
Nco
I
de
produtos
de
PCR
miniexon...........................................................................................................
40
Tabela 3
Artigo 1
Table 1
Clinical epidemiological characteristics of 234 patients with mucosal
Leishmaniasis treated in a Tertiary Reference Center in the Amazon ………. 53
Artigo 3
Table 1
Table 2
Table 3
Mucosal leishmaniasis in a reference unit in the Amazon - Clinical
Presentation – Rhinoscopy.…………………………………………….………… 87
Mucosal leishmaniasis in a reference unit in the Amazon - Sensitivity of
different diagnostic methods……………………………………………………… 88
Mucosal leishmaniasis - Retrospective study of Amazonian cases. The
outcome of 230 cases after the first treatment with antimonials and
pentamidine………………….…………………………………………….………… 88
xii
LISTA DE ABREVIATURAS, SIGLAS E SÍMBOLOS
DNA
ELISA
FMTAM
HeE
IDRM
IL
k DNA
LC
LCD
LCM
LDPC
LM
LTA
LV
pb
PCR
QT-NASBA
RIFI
RNA
SDS
Taq
TNFα
V
Ácido desoxirribonucléico
Enzyme linked immunosorbent assay
Fundação de Medicina Tropical do Amazonas
Hematoxylina Eosina
Intradermo Reação de Montenegro
Gama interferon
Interleucina
Ácido desoxirribonucléico do kinetoplasto
Leishmaniose Cutânea
Leishmaniose Cutâneo Difusa
Leishmaniose Cutâneo Mucosa
Leishmaniose Dérmica Pós Calazar
Leishmaniose Mucosa
Leishmaniose Tegumentar Americana
Leishmaniose Visceral
Pares de base
Reação em Cadeia da Polimerase
Quantitative Nucleic Acid Sequence-Based Assay
Reação de Imunofluorescencia Indireta
Ácido ribonucléico
Sulfato duodecil de Sódio
Termus aquaticus - polimerase termo estável
Fator de necrose tumoral alfa
Volts
xiii
SUMÁRIO
1.
1.1
1.2
1.3
1.4
1.5
1.6
1.7
1.7.1
1.7.1.1
1.7.1.1.1
1.7.2
1.7.2.1
1.7.2.2
1.7.3
1.8
1.9
1.10
INTRODUÇÃO ....................................................................................................
Histórico ..............................................................................................................
Epidemiologia.......................................................................................................
Etiologia...............................................................................................................
A transmissão......................................................................................................
Reservatórios.......................................................................................................
Aspectos clínicos..................................................................................................
Diagnóstico...........................................................................................................
Diagnóstico parasitológico....................................................................................
Histopatologia.......................................................................................................
Classificação histopatológica da LTA...................................................................
Biologia molecular................................................................................................
Reação de Cadeia de Polimerase (PCR)............................................................
NASBA.................................................................................................................
Intradermoreação de Montenegro........................................................................
Terapêutica...........................................................................................................
Controle................................................................................................................
Leishmanioses na Amazônia...............................................................................
1
1
2
6
9
11
12
17
17
17
18
20
20
22
22
23
26
27
2.
2.1
2.2
OBJETIVOS.........................................................................................................
Geral.....................................................................................................................
Específicos...........................................................................................................
31
31
31
3.
3.1
3.2
3.3
3.3.1
3.4
3.5
3.5.1
3.5.2
3.5.2.1
3.6
3.6.1
3.6.2
3.6.2.1
3.6.2.2
3.6.2.2.1
3.6.2.2.1
3.6.2.2.3
3.6.2.2.4
3.6.2.2.5
3.6.2.2.5.1
3.6.2.2.5.1.2
3.6.2.2.5.1.3
3.6.2.2.5.1.4
MATERIAL E MÉTODOS....................................................................................
Modelo de Estudo.................................................................................................
Universo de Estudo..............................................................................................
População de Referência.....................................................................................
População de Estudo...........................................................................................
Período de estudo................................................................................................
Definição de casos...............................................................................................
Estudo retrospectivo.............................................................................................
Estudo prospectivo...............................................................................................
Critérios de inclusão………………………………………………………………….
Procedimentos......................................................................................................
Estudo Retrospectivo...........................................................................................
Estudo prospectivo...............................................................................................
Atendimento inicial dos pacientes........................................................................
Procedimentos diagnósticos.................................................................................
Intradermorreação de Montenegro.......................................................................
Sorologia..............................................................................................................
Biópsias................................................................................................................
Histopatologia.......................................................................................................
Procedimentos moleculares.................................................................................
Extração do DNA total..........................................................................................
Biópsias parafinadas............................................................................................
Biópsias congeladas em meio líquido L6.............................................................
Extração do DNA de material em papel de filtro.................................................
32
32
32
32
32
32
33
33
33
34
34
34
34
34
35
35
35
35
35
36
36
36
36
36
xiv
3.6.2.2.5.2
3.6.2.2.5.2.1
3.6.2.2.5.2.2
3.6.2.2.5.2.3
3.6.2.3
3.6.2.4
3.6.2.5
3.6.2.5.1
3.6.2.5.2
3.6.2.6
3.6.2.7
3.6.3
3.6.3.1
3.6.4
3.6.5
3.6.5.1
3.6.5.2
3.6.5.3
3.6.5.4
3.6.5.5
3.7
3.8
3.9
Reação em Cadeia de Polimerase (PCR)..........................................................
Amplificação de Mini-círculo DNA Kinetoplastidial..............................................
Amplificação do gene que codifica a actina humana..........................................
Identificação de espécies por amplificação e RFLP do mini-exon......................
Tratamento...........................................................................................................
Desenvolvimento do estudo.................................................................................
Cadastramento dos pacientes.............................................................................
Sorologia..............................................................................................................
Biópsia para Histopatológico, cultura e PCR.......................................................
Parasitológico Direto............................................................................................
Isolamento e Caracterização da cepa de Leishmania.........................................
Exames Complementares....................................................................................
Avaliação cardíaca...............................................................................................
Execução dos esquemas terapêuticos.................................................................
Avaliação clínico-evolutiva dos pacientes............................................................
Cicatrização total..................................................................................................
Cicatrização parcial..............................................................................................
Persistência de atividade......................................................................................
Definição de cura..................................................................................................
Definição de falha terapêutica..............................................................................
Análise estatística dos resultados........................................................................
Considerações éticas da pesquisa.......................................................................
Fontes de erros....................................................................................................
37
37
38
38
40
41
41
42
42
42
42
43
43
43
43
43
43
44
44
44
44
44
45
4.
4.1
4.2
4.3
RESULTADOS.....................................................................................................
Artigo 1.................................................................................................................
Artigo 2.................................................................................................................
Artigo 3…………………………………………………………………………………..
46
47
68
83
5.
DISCUSSÃO........................................................................................................
97
6.
CONCLUSÃO...................................................................................................... 104
7.
REFERÊNCIAS.................................................................................................... 105
8.
8.1
8.2
8.3
8.4
ANEXOS...............................................................................................................
Anexo 1- Ficha clínica (roteiro de coletas de dados e exame físico)...................
Anexo 2- Termo de Consentimento Livre e Esclarecido (TCLE)..........................
Anexo 3- Distribuição dos casos de LM por município de ocorrência..................
Anexo 4- Distribuição dos casos de LM por faixa etária......................................
118
118
120
123
123
1
1. INTRODUÇÃO
As leishmanioses são doenças transmitidas por flebotomíneos e causadas por
protozoários do gênero Leishmania, causando diferentes entidades clínicas, como a
Leishmaniose Visceral (LV), que é muitas vezes fatal quando não tratada; a
Leishmaniose Cutâneo Mucosa (LCM), ou apenas Leishmaniose Mucosa (LM) e as
formas cutâneas – Leishmaniose Cutânea (LC) ou ainda a Leishmaniose Cutâneo
Difusa (LCD) 1.
As leishmanioses permanecem como um importante problema de saúde pública
devido a não somente aos riscos ambientais mas também a massivas migrações,
desmatamentos, urbanização, novos esquemas de irrigação, além dos fatores
individuais como HIV, mal nutrição e aspectos genéticos 2.
1.1 Histórico
As leishmanioses remontam aos tempos dos faraós 3. As primeiras descrições da
doença foram realizadas por Alexander Russel em um paciente da Turquia, onde a
doença era conhecida como "Aleppo boil" 4.
A primeira referência sobre a Leishmaniose Tegumentar Americana (LTA) no Brasil
encontra-se no documento da Pastoral Religiosa Político-Geográfica de 1827, citado
no livro de Tello intitulado “Antiguidad de la Syfilis en el Peru”, onde ele relata a
viagem de Frei Dom Hipólito Sanches de Fayas y Quiros de Tabatinga (AM) até o
Peru, percorrendo as regiões do vale amazônico 5.
O primeiro a observar o parasito do gênero Leishmania foi Cunningham, em 1885,
na Índia, em casos de leishmaniose visceral. No novo mundo, foram inicialmente
designadas como “botão do oriente”. No Brasil, Cerqueira, em 1855, observara a
existência da moléstia da pele, identificando-a clinicamente como botão de Biskra.
Em 1895, na Itália, Breda, descreveu a moléstia em italianos provenientes de São
Paulo 5,6.
No Brasil, a natureza leishmaniótica das lesões cutâneas e nasofaríngeas só foi
confirmada, pela primeira vez, em 1909, por Lindenberg, que encontrou formas de
2
Leishmania idênticas à Leishmania tropica (leishmaniose do Velho Mundo, descrita
por Wright, em 1903) em lesões cutâneas de indivíduos que trabalhavam nas matas
do interior do estado de São Paulo. É atribuído a Splendore o diagnóstico da forma
mucosa da doença 5.
Para Altamiro-Ensiso et al.
7
existem duas teorias que discutem sua chegada às
Américas; uma de origem mediterrânea postulava que os casos de pacientes da
Bahia, onde a doença era chamada 'botão da Bahia' assemelhava-se ao “botão do
Oriente”. Esta comparação trouxe o pensamento de que a LTA teria sido introduzida
pelos fenícios ou sírios que supostamente chegaram ao nordeste brasileiro durante
a Antiguidade, tais viagens jamais foram histórica ou arqueologicamente provadas. A
segunda, da origem andina, é a teoria atualmente mais aceita. Começa a formularse a partir dos descobrimentos de peças de cerâmica pré-colombiana ou “huacos”
peruanos em 1895, em que se acredita que tais peças representavam pacientes
portadores de LM, essa teoria é reforçada por documentos do século XVI, embora a
discussão dos dados históricos seja controversa.
Marzochi e Marzochi
8
propuseram uma terceira teoria sugerindo que a doença
humana tenha surgido na região amazônica ocidental, principalmente ao sul do rio
Marañon-Solimões-Amazonas, onde predomina a Leishmania (Viania) braziliensis,
baseados em estudos epidemiológicos e de distribuição geográfica desta espécie
em diferentes ecossistemas, envolvendo vetores e reservatórios diversos, admitem
que o processo de dispersão para outras áreas do Brasil é recente e que ocorreu
principalmente durante o ciclo econômico da borracha, entre 1880 e 1912, que atraiu
milhares de nordestinos para a região. Após o declínio desse ciclo, essa população
retornou às suas origens, atraída pela expansão do cultivo do café, migrou por volta
de 1930, para a Região Sudeste, período em que se iniciou a grande epidemia da
LTA 6.
Esta hipótese é reforçada quando se compara a heterogeneidade genética da
Leishmania (Viania) braziliensis encontrada na Região Amazônica em relação à
homogeneidade genética da mesma espécie fora desta região, sugerindo sua
introdução posterior, longe de sua origem, e propagação pela expansão clonal da L.
(V.) braziliensis 9,10.
3
Em Manaus, um caso descrito por Matta
11
, já relacionava sua ocorrência do caso à
coleta de castanha no rio Trombetas, estado do Pará, e já indicava a procedência de
casos da região do Purus e do estado do Acre. Entretanto, somente depois Vianna12
descreveu a Leishmania braziliensis como uma nova entidade.
1.2 Epidemiologia
A OMS reconhece que as leishmanioses estão entre as mais negligenciadas das
doenças tropicais: mais de 12 milhões de pessoas infectadas no mundo; com dois
milhões de casos a cada ano; 350 milhões de pessoas vivendo em áreas de risco,
reconhece também que estes casos têm aumentado que existe falta de informações
mais acuradas a respeito da sua epidemiologia para um melhor entendimento de da
doença e de seu controle13.
A LTA uma doença que vem crescendo nos países do Hemisfério Norte devido a
turismo e conflitos armadas
14,15,16
, já tendo sido registrados casos humanos
oriundos da América do Sul no continente Australiano, onde também se registra a
presença do parasito em cagurus sem que se tenha identificado a espécie
17,18
.
Distribuídas em 22 países do Novo Mundo e 66 do Velho Mundo, são encontradas
principalmente no sudoeste Asiático, no Leste da África e no Brasil. A infecção
humana é encontrada em 16 países da Europa, incluindo França, Itália, Grécia,
Malta, Espanha e Portugal. Ocorre sob diversas formas, sendo reconhecida
principalmente pelas formas cutâneas, mas também ocorrendo nas formas viscerais
19
.
As leishmanioses entre 88 países afetados dos quais 72 são considerados em
desenvolvimento, incluindo 13 dos últimos países em desenvolvimento, 90% dos
casos de LV ocorrem em Bangladesh, Índia, Nepal, Sudão e Brasil e 90% dos casos
de LTA ocorrem no Afeganistão, Algéria, Brasil, Irã, Peru, Arábia Saudita e Síria 20.
Estima-se que as desabilidades e desajustes relacionados às leishmanioses, em
dias de vida perdidos, têm sido próximos de 2,4 milhões
1
(WHO, 2004). Se a LM
não é tratada precocemente pode causar desfiguração e morte em alguns casos
4
21,22
. Essa forma de doença em algumas áreas da América do Sul representa
aproximadamente 12,5% dos casos de LTA notificados
23
.
Em diversas regiões tem sido observado um aumento do número de casos como,
por exemplo: em Kabul, no Afeganistão, a incidência aumentou de 14.200 em 1994
para 67,500 em 2002; em Aleppo, na Síria, a incidência aumentou de 3.900 casos
em 1998 para 6.275 em 2002; no Brasil, de 21.800 casos no ano de 1998 para
60.000 casos no ano de 2003 1.
A LTA é considerada pela Organização Mundial de Saúde (OMS) como uma das
cinco
doenças
infecto-parasitárias
endêmicas
de
maior
relevância,
sendo
amplamente distribuída nas Américas estendendo-se desde o sul dos Estados
Unidos até o norte da Argentina
24
. É uma doença que acompanha o homem há
muito tempo e que tem apresentado, nos últimos 20 anos, um aumento do número
de casos e expansão geográfica, sendo encontrada atualmente em todos os
Estados brasileiros, sob diferentes perfis epidemiológicos 5.
Transmitida ao homem pela picada de flebotomíneos, são reconhecidas mais de 20
espécies de Leishmania (seis ocorrem no Brasil), responsáveis pela doença em
diversos países, cada uma com padrões epidemiológicos e demográficos distintos. A
estimativa do número de casos está provavelmente subestimada da realidade
porque sua notificação só é obrigatória em 32 dos 88 países afetados
24
.
No Brasil, apresenta-se em franco crescimento, tanto em magnitude, como em
expansão
geográfica,
observando-se
a
coexistência
de
um
duplo
perfil
epidemiológico, expresso pela manutenção de casos oriundos dos focos antigos ou
de áreas próximas a eles e pelo aparecimento de surtos e epidêmias associados a
fatores como o acelerado processo de expansão das fronteiras agrícolas, a
implantação de áreas de garimpo, a construção de estradas, e o processo de
invasão na periferia das cidades 25.
No período de 1985 a 1999, foram registrados no país 388.155 casos autóctones de
LTA. O coeficiente de detecção de LTA no Brasil aumentou de 10,45/100.000 hab.
para 18,63/100.000 habitantes, com a melhoria do fluxo de informação 25.
5
De acordo com dados do DATASUS, são registrados no período de 1999 a 2005,
cerca de 31.957 casos de LTA por ano no Brasil. A doença é registrada em todos os
estados, observando-se sua expansão com 169.361 casos, a região Sul apresenta o
menor número, com 5.064 e a região Norte o maior, com 84.894 no período descrito
(Tabela 1) . As taxas de incidência por 100.000 habitantes em 2004 e 2005 foram
respectivamente de 15,61 e 14,12 para o país, sendo 91,18 e 71,09 para a região
Norte, com 70,44 e 60,24 para o Estado do Amazonas
26
.
O predomínio de caso de LM pra o sexo masculino, tem sido observado em diversas
séries de estudos envolvendo a LM.
Tabela 1 – Casos de LTA por regiões – Brasil 1999 a 2005
Ano
Região
Norte
Região
Nordeste
Região
Sudeste
Região
Sul
Região
Oeste
1999
11201
9112
3983
460
6384
2000
11140
13078
2938
853
4605
2001
12369
15057
2041
635
4962
2002
12489
11548
3514
1053
5440
2003
14200
8005
3472
951
4635
2004
13106
7791
2476
582
4374
2005
10449
7978
2719
530
4338
Total
84954
72569
21143
5064
34738
Centro-
Fonte: DATASUS
Diversos pacientes têm apresentado simultaneamente lesões cutâneas e mucosas,
isto tem sido observado em 59% dos casos da Amazônia brasileira, onde a doença
mucosa é resultado de pacientes com história de lesão cutânea anterior não tratada,
geralmente causada por L. (V.) braziliensis, reconhecido como o mais importante
agente etiológico da LM no Novo Mundo
27,28,29,30,31
.
6
Grande parte do extrativismo da Amazônia relacionado à castanha do Brasil e à
Borracha provém de áreas que abrangem o extremo sul do Amazonas e os estados
do Acre e Rondônia; a exploração madeireira se dá principalmente ao longo das
calhas dos rios Purus e Juruá 32.
No Estado do Amazonas tem sido observado um predomínio de casos de LM em
pacientes procedentes de áreas de calha sul dos rios Amazonas / Solimões e
relacionada a atividades de extrativismo vegetal em áreas de mata primária
33
.
No período de 1976 a 1980 foram diagnosticados no Estado do Amazonas, 2.006
casos de LTA, a maioria em habitantes das margens das estradas e da periferia de
Manaus
34
(Barros et al., 1982). De 1985 a 2000 foram registrados 30.251 casos,
sendo 17.374 (57,43%) procedentes do município de Manaus
35
.
A Fundação de Medicina Tropical do Amazonas (FMTAM), que atende em média
47,5% dos casos de leishmaniose do estado, vem registrando em torno de 1.000
casos novos a cada ano, principalmente oriundos de duas estradas: AM 010, que
liga Manaus ao município de ltacoatiara e BR 174, que liga Manaus a Boa Vista,
capital do Estado de Roraima 35.
No período de 1985 a 1995 a prevalência de casos de LM atendidos na FMTAM foi
de 1,4%
36
, de 2002 a 2008 foi de 2,3% (http://www.fmt.am.gov.br/informe/001-
2005leish.pdf); esses dados estão em consonância com os do Estado do Amazonas,
cujo coeficiente de detecção de casos, para o mesmo período, foi estimado em 2,8%
37
.
1.3 Etiologia
As principais espécies de Leishmania causadoras de doença no mundo estão
descritas na tabela 2. A Leishmaniose mucosa pode ser causada por L. (V.)
panamensis, L. (V.) guyanensis, L. (Leishmania) amazonensis, L. (L) major, L. (L)
tropica e L. (L) infantum, entretanto é mais comumente associada a L. (V)
braziliensis, “Spundia” e restrita à América do Sul, as demais se constituem casos
excepcionais 22.
7
Tabela 2 - Distribuição das espécies de Leishmania causadoras de doença humana
Espécies
Formas clínicas
Distribuição
Ciclo
de
transmissão
Leishmania
(Leishmania)
aethiopica
LC
África (Etiópia e Kênia)
Zoonótico
L. (L.) killicki
LC
Norte da África
Zoonótico
L. (L.) major
LC
LCM
Norte e leste da África,
Ásia central
Zoonótico
L. (L.) tropica
LC
LCM
Norte e leste da África,
Ásia central e sul
Antroponótico
África, sudeste e centro
da Ásia
Antroponótico
Velho Mundo
LCD
L. (L.) donovani
LDPC
LV
Novo Mundo
L. (Viannia) braziliensis
LC
LCM
América do Sul, partes
da América Central e
México
Zoonótico
L. (V.) panamensis
LC
LCM
América do Sul, sul da
América Central
Zoonótico
L. (V.) peruviana
LC
América do Sul
Zoonótico
L. (V.) guyanensis
LC
América do Sul
Zoonótico
L. (V.) lainsoni
LC
América do Sul
Zoonótico
L. (V.) colombiensis
LC
Região norte da América
do Sul
Zoonótico
L. (L.) amazonensis
LC
LCD
América do Sul
Zoonótico
L. (L.) mexicana
LC
LCD
América Central, México
e Estados Unidos
Zoonótico
L. (L.) pifanoi
LC
América do Sul
Zoonótico
L. (L.) venezuelensis
LC
Região norte da América
do Sul
Zoonótico
L. (L.) garnhami
LC
América do Sul
Zoonótico
L. (V.) lindembergi
LC
América do Sul
Zoonótico
Europa, norte da África,
Américas Central e Sul
Zoonótico
LCM
LCM
Novo e Velho Mundo
L. (L.) infantum
LC
LCM
LV
LC= Leishmaniose cutânea
LCM= Leishmaniose cutânea mucosa LV= Leishmaniose visceral
LCD= Leishmaniose cutâneo difusa LDPC=
8
Em estudos realizados sobre a LTA no Peru, observou-se que de 351 isolados de
Leishmania, 79% foram caracterizados como Leishmania (Viania) braziliensis, sendo
69% desses isolados de portadores de LM, observando-se dois casos de LM por L.
(L.) amazonensis e um caso por L.(V.) guyanensis. Os autores levantam a hipótese
de que naquela região a LM parece estar ligada a atividades desenvolvidas pelos
indivíduos em áreas de floresta primária
37
. Outras cepas de Leishmania isoladas de
pacientes portadores de LM do Peru demonstraram características hibridas, sendo
aventada a possibilidade de novas espécies causando doença mucosa naquela
região
39
. Na Bolívia se observam taxas de acometimento mucoso variando entre 5
a 20% 40.
No Brasil as principais espécies incriminadas na ocorrência de casos de LTA são: L.
(V.) braziliensis L (V.) guyanensis, L. (L.) amazonensis, porém à outras espécies
também é atribuída a etiologia de casos de LC, principalmente na Amazônia, tais
como L. (V.) naiffi, L. (V.) lainsoni, L. (V.) shawi e L. (V.) lindenbergi
27
.
Até a presente data, sete espécies de Leishmania causadoras de doença
tegumentar foram identificadas no Brasil 27,41:
1. Leishmania (Viania) braziliensis: é a espécie de maior prevalencia no homem e
pode causar lesões cutâneas e mucosas. É encontrada em todas as zonas
endêmicas do País, desde o norte até o sul, tanto em áreas de colonizações antigas
ou recentes, estando geralmente associada à presença de animais domésticos.
2. Leishmania (V.) guyanensis: causa sobretudo lesões cutâneas. Ocorre na
margem norte do Rio Amazonas em áreas de colonização recente, estando
associada com desdentados e marsupiais.
3. Leishmania (V.) naiffi: ocorre na Amazônia, nos Estados do Pará e Amazonas,
tendo o tatu como reservatório natural. O parasito causa LTA de evolução benigna.
4. Leishmania (V.) shawi: responsável por casos esporádicos no Amazonas e Pará,
tem como reservatórios vários animais silvestres como macacos, preguiças e
procionídeos.
9
5. Leishmania (V.) lainsoni: registrada apenas na Amazônia, tem a paca como
animal suspeito de reservatório natural.
6. Leishmania (Leishmania) amazonensis: agente etiológico de LTA, incluindo a
forma anérgica ou leishmaniose cutânea difusa. Seus reservatórios são roedores e
marsupiais.
7. Leishmania (V.) lindenbergi: recentemente descrita no Estado do Pará a partir de
um surto em um grupo de militares em área de selva, parece associada ao vetor
Lutzomyia (Nyssomyia) antunesi.
Também no Brasil, a LM é mais comumente associada à L. (V.) braziliensis, embora
tenham sido descritos casos associados a outras espécies
42,43,44
. Quando se
considera o rio Amazonas/Solimões como um divisor geográfico para a distribuição
das principais espécies presentes na Amazônia brasileira, observa-se predomínio de
casos de L. (V.) guyanensis na região de Manaus 45,46,47.
Em estudo realizado por Naiff et al.,
48
na região de Manaus, a Leishmania (V.)
guyanensis foi encontrada em 83% das espécies de Leishmania identificadas em 65
indivíduos portadores de LTA da Amazônia brasileira.
Wan der Meide et al.
49
identificaram por PCR, em pacientes portadores de LC
atendidos na FMTAM, 69 indivíduos com leishmaniose causada pela L. (V.)
guyanensis, dois pela L.(L.) amazonensis e cinco pela L. (V.) braziliensis, sendo que
destes, três eram procedentes da calha sul dos rios Amazonas/Solimões. No
restante do Brasil, entretanto, os casos de LM são, em sua maioria, procedentes de
municípios e estados de calha sul e estes tem sido causados pela L. (V.) braziliensis
onde predomina esta espécie 14,50,51.
1.4 A transmissão
A transmissão das leishmanioses ocorre essencialmente via vetorial, as formas não
vetoriais como, por exemplo, acidentes de laboratório, são raras. Os insetos do
gênero Phlebotomus spp são os principais vetores na Europa, Norte da África,
10
Oriente Médio e Ásia e os do gênero Lutzomyia spp são os vetores desde o sul dos
Estados Unidos até o Norte da Argentina 1.
No Brasil as espécies de maior importância são a Lutzomyia intermédia e Lu.
whitmani, implicadas na transmissão da Leishmania (V.) braziliensis, a Lutzomyia
flaviscutellata e Lu. olmeca nociva na transmissão da Leishmania (L.) amazonensis
e a Lutzomyia umbratilis e Lu. anduzei, implicadas na transmissão da Leishmania
(V.) guyanensis 52.
Chagas et al.
53
observaram em uma vila de mineração, entre os estados do
Amazonas e Roraima, que indivíduos exercendo atividades nas proximidades ou em
contato direto com a floresta apresentaram maior número de casos, embora a
doença também tenha sido registrada em indivíduos que não tinham atividades
laborais em contato direto com a floresta, tais como estudantes e donas de casa,
porém, ocasionalmente adentravam na floresta para passeios e balneários.
No Município de Manaus há predomínio da LTA causada pela Leishmania (Víannía)
guyanensis, cujo principal transmissor é a Lutzomyia umbratilis, sendo a Lu. anduzei
um vetor secundário 54,55,56,57.
A Leishmania (Leishmania) amazonensis é um outro agente de LTA na região, cujos
transmissores são a Lu. flaviscutellata e Lu. olmeca nociva
54,58
, acreditando-se que
o Rio Amazonas constitua barreira geográfica para as outras espécies agentes de
LTA na região, por esse motivo a ocorrência da LM é baixa na região
28,57
.
É provável que a transmissão também ocorra no intra e no peridomicílio na região de
Manaus, pela proximidade com as áreas de floresta
Paes et al.
60
58,59
.
em estudo em bairro de implantação antiga na cidade de Manaus,
observaram um novo surto de LTA no qual 9,8% dos casos estudados eram crianças
menores de cinco anos, sugerindo transmissão no intra e peri domicilio. Andrade
61
,
em estudo realizado na Cidade de Deus, bairro da periferia de Manaus, localizado
imediatamente à Reserva Florestal Adolpho Ducke, verificou a ocorrência de vários
casos de LTA na rua que tem limite com a reserva.
11
O impacto sobre o meio ambiente tem sido o fator limitante para as medidas
atualmente em vigor para o controle das leishmanioses, pois o controle dos vetores
é baseado no uso de inseticidas, os quais possuem efeitos indesejados, como
desequilíbrio ecológico e resistência dos vetores 52.
1.5 Reservatórios
Diversos estudos têm demonstrado diferentes espécies de mamíferos roedores,
marsupiais e até cães com infecção por L. (V.) braziliensis, entretanto, não há um
consenso sobre o principal reservatório dessa espécie, embora pequenos roedores
tenham sido os mais incriminados como reservatórios silvestres
62,63,64,65
.
A infecção natural por Leishmania tem sido encontrada em uma ampla variedade de
mamíferos não humanos, principalmente em marsupiais, roedores, edentados e
carnívoros. Até agora a maioria dos reservatórios hospedeiros de Leishmania spp L.
(L.) infantum, L. (V.) peruviana, L (L.) amazonensis, L (L.) mexicana, L (L.)
guyanensis, L. (V.) panamensis, L. (L.) major, e L. (L.) aethiopica, tem sido descritos,
entretanto os reservatórios da L. (V.) braziliensis permanecem por ser identificados
de maneira mais conclusive 22.
A implicação de um determinado reservatório é difícil porque muitas vezes é
específica de um contexto epizoonótico e depende de muitas variáveis, como por
exemplo, abundância e distribuição do hospedeiro, infectividade para o flebotomíneo
vetor, por isso são menos frequentemente investigados
22
.
A técnica de PCR tem sido utilizada para identificação Leishmania em animais
suspeitos de serem reservatórios da leishmaniose. Em 123 amostras coletadas de
roedores silvestres (Thrichomys apereoides, Oryzomys subflavus, Galea spixii,
Bolomys lasiurus and Wiedomys pyrrhorhinos) e sinantrópicos (R. rattus) em Minas
Gerais. Quinze amostras foram positivas após PCR-hibridização, identificadas como:
nove L. mexicana complexo, três L. braziliensis complexo e três para L. donovani
complexo. A PCR resultou positiva em 11 de 61 (18%) amostras de sangue e em
quarto de 62 (6,4%) fragmentos de pele 66.
12
Dentre os possíveis reservatórios silvestres da L. (V.) guyanesis, à preguiça
(Choloepus didactylus) tem sido atribuído o papel principal na Amazônia brasileira e
em alguns locais da Guiana Francesa nas áreas de floresta primária, embora testes
de precipitina tenham revelado que a preferência de Lu. umbratilis seja por roedores
67
. Também implicado como reservatório secundário está o Tamandua tetradactyla
(tamanduá), e secundariamente temos Proechimys sp. (rato silvestre) e o Didelphis
marsupialis (gambá) 31,45,68,69,70.
1.6 Aspectos clínicos
No Brasil, a Leishmaniose Tegumentar Americana (LTA) está agrupada sob três
diferentes formas clínicas: Leishmaniose Cutânea (LC), Leishmaniose Cutânea
Difusa (LCD) e Leishmaniose Mucosa (LM) 25,52.
Leishmaniose Cutânea – caracterizada pela presença de lesões únicas ou múltiplas
acometendo o tegumento, podendo apresentar-se com variado polimorfismo que vai
desde as formas cutâneas ulceradas simples até as formas verrucosas, papulosas e
impetigoides, associadas ou não a lifadenopatia regional, nestes casos também
chamadas de formas linfáticas 25,52.
Leishmaniose Cutânea Difusa (LCD) – Apresentam como característica a presença
de lesões papulosas disseminadas pelo tegumento, não ulceradas associadas a
Leishmania (L.) amazonensis, ligadas a deficiência de imunidade, são consideradas
formas raras 25,52.
Leishmaniose Mucosa (LM) – Mais associada a L. (V.) braziliensis, o acometimento
ocorre na maioria das vezes anos após a LC, embora possam ocorrer formas
concomitantes chamadas de LCM. Apresentam caráter evolutivo, sendo mais
freqüente o acometimento nasal, podendo também ocorrer formas orais, laringeais e
até traqueais; costumam destruir o septo nasal, conferindo aos doentes o aspecto
conhecido como nariz de tapir ou de anta, são conhecidas nas Américas como
“spundia” denominação dada por Escomel 7.
Marzochi
71
dividiu em grupos as modalidades de Leishmanioses no Brasil (Figura
1), conforme se pode visualizar a seguir:
13
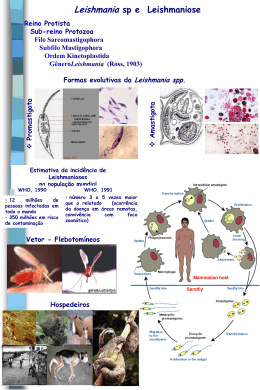
Figura 1 – Modalidades das Leishmanioses no Brasil (MS, 2000)
O diagnóstico clínico da LM é difícil devido aos sinais e sintomas que podem ser
confundidos com outras condições como outras granulomatoses e malignidades
72
.
O aparecimento das lesões mucosas ocorre frequentemente anos após a
cicatrização da lesão primária, e embora, na maioria das vezes a evolução seja
lenta, a necrose do tecido mucoso costuma ser progressiva e há dificuldade em se
obter a cura das lesões 73.
A apresentação mucosa da LTA é na maioria das vezes secundária às lesões
cutâneas, surgindo geralmente, meses ou anos após a resolução das lesões de
pele. Às vezes, porém, não se identifica a porta de entrada supondo-se que as
lesões sejam originadas de infecção subclínica 25.
Acredita-se que um grande risco de reativação e desenvolvimento de lesões
mucosas esteja associado a tratamentos incompletos ou inadequados
51
.
14
A LM é uma doença crônica progressiva que usualmente aparece meses ou anos
após a inoculação na pele, pode levar a lesões destrutivas do trato respiratório
superior, mucosa e submucosa dos tecidos do nariz, boca, faringe, laringe e até
traqúéia e ser acompanhada de desnutrição, quando causa disfagia, podendo
também, em casos excepcionais, levar a morte por pneumonia ou asfixia, em todos
esses casos raramente se encontra as formas amastigotas, comumente associada a
uma exacerbada resposta à Intradermo Reação de Montenegro (IDRM)
74,75,76
.
A LM é definida clinicamente pelo comprometimento do revestimento mucoso das
vias aéreas superiores, causando lesões ulcerosas e perfurantes ou vegetantes e
necróticas do septo cartilaginoso, cornetos nasais, palato mole e duro, queda da
pirâmide nasal, úvula, faringe e laringe. Pode comprometer seriamente a estrutura
óssea do esplacnocrânio e, como conseqüência, ocasionar problemas na deglutição,
fonação, respiração, além de causar também uma expressiva alteração estética na
face dos indivíduos, podendo ainda provocar a morte do doente pela cronicidade e
complicações respiratórias 51,77.
Na LM, são mais freqüentemente acometidas as cavidades nasais, seguidas da
faringe, laringe e cavidade oral. Por esse motivo, as queixas mais comuns no
acometimento nasal são obstrução, epistaxes, rinorréia e crostas; quando ocorre na
faringe, a odinofagia; na laringe, rouquidão e tosse; e na cavidade oral, ferida na
boca 25,72,78.
Lesões infiltradas, ulceradas, perfuração do septo nasal, lesões ulcero- vegetantes,
úlcerocrostosas ou ulcero-destrutivas podem ser observadas ao exame clínico. A
destruição parcial ou total da pirâmide nasal e outras estruturas acometidas na boca
também podem ocorrer. As lesões podem ser discretas com poucos sintomas, daí a
necessidade de sempre se buscar a identificação de doença em mucosas
25
.
A presença de uma ou várias cicatrizes atróficas em pele ou história de úlcera
cutânea com evolução prolongada, ao lado das queixas como obstrução nasal,
epistaxes, rinorréia e eliminação de crostas; odinofagia; rouquidão e ferida na boca,
reforçam o diagnóstico clínico de leishmaniose mucosa. A ausência de cicatrizes
não afasta a suspeita clínica de acometimento mucoso por leishmaniose, pois pode
15
ocorrer em pacientes sem história de LTA anterior 25,78.
Os aspectos envolvendo a evolução da LTA para o acometimento mucoso não são
claros, devido ao tempo entre a ocorrência da doença cutânea, (quando esta
ocorre), e o aparecimento da doença mucosa; entretanto, diversos fatores têm sido
associados ao aparecimento da doença mucosa, entre eles a ocorrência de LTA
anterior 33,36,51.
Estudos anteriores associam risco de ocorencia de lesões mucosas em pacientes
com lesões acima da cintura pélvica, grandes lesões ulceradas e história de LC
inadequadamente tratada 78,79.
Os mecanismos que podem disparar essas reativações não são conhecidos,
entretanto, diversos fatores podem ter influência em sua ocorrência, incluindo o
estado imune do hospedeiro, a associação com doenças sistêmicas, assim como
traumas locais ou tratamentos imunossupressivos ou co-infecção com o vírus do HIV
79,80
.
As razões da progressão para doença mucosa não são muito claras, a associação
entre L. (V.) braziliensis e essa forma de doença sugere que os fatores estão ligados
ao parasito, embora condições do hospedeiro também possam estar envolvidas. Se
aceita que depende de fatores do parasito, resistência do hospedeiro e nível de
resposta imune deste. A progressão parece ligada a fatores do sistema linfáticos,
metastáticos, sabe-se que os vasos no interior do septo nasal apresentam boas
condições para o desenvolvimento de amastigotas, assim como também existem
teorias que ligam esse desenvolvimento a menores temperaturas nas passagens de
ar do nariz 79.
Na Colombia foi feita uma avaliação de 28 doentes portadores de LTA, sendo dois
com LM e 26 com LC (caracterizados como L. (V.) panamensis, L. (V.) guyanensis e
L. (V.) braziliensis). Foi encontrado DNA de Leishmania (Viannia) nas mucosas
(nasal, tonsilas e conjuntiva) dos dois portadores de LM e em 21 dos portadores de
LC 81.
16
Na LM as lesões nasofaríngeas estão associadas à forte resposta das células T,
evidenciada por uma exacerbação da resposta imune celular aos antígenos de
Leishmania
e
aos
testes
de
proliferação
de
linfócitos.
Essa
marcada
hipersensibilidade da resposta celular também pode ser demonstrada nos cortes
histológicos do tecido mucoso onde, em alguns pacientes, pode ser uma reação
granulomatosa tipo tuberculóide como uma resposta mais extremada ou também um
infiltrado linfoplasmocitário com poucos histiócitos e raros parasites 82.
O DNA da Leishmania (V.) braziliensis foi encontrado no sangue circulante de 26%
de indivíduos vivendo em áreas endêmicas de LTA, os autores levantam a hipótese
de que novas lesões de cutâneas ou de doença mucosa pode ser resultado de
reativação endógena dos parasitos 73.
Mata et al.
83
observaram que a L.(V.) guyanensis induz a uma baixa regulação do
sistema imune, quando comparada á L. (V.) braziliensis; os autores levantam a
hipótese de que estes achados se correlacionam com os aspectos clínicos desta
espécie:
como
alta
carga
parasitária
e
freqüente
resistência
à
terapia
medicamentosa. Provavelmente por esse motivo essa espécie esteja menos
associada às formas mucosas de doença.
O exato mecanismo de LM não está ainda bem estabelecido, tem sido aceito que a
LM possa representar um pólo de reação de hipersensibilidade à infecção por
Leishmania, outros estudos têm revelado uma mistura de citocinas do tipo 1 e tipo 2
em lesões com sobre-regulação de RNAm para gama interferon, fator de necrose
tumoral alfa, interleucina 4 e interleucina 10. Adicionalmente tem sido mostrado que
os linfócitos de pacientes com LM produzem altos níveis de IFNγ TNFα
resposta a estimulação antigênica.
tem
Esses dados levantam a questão de que a
hiperatividade do sistema imune, levando a dano dos tecidos do hospedeiro,
desempenha um papel na LM 84.
Altos títulos de TNFα têm sido observados na LM humana, que decaem após o
tratamento sugerindo mais uma vez o papel dessa citocina nos mecanismos de
destruição dos tecidos do hospedeiro
85
.
17
1.7 Diagnóstico
1.7.1. Diagnóstico parasitológico
O diagnóstico laboratorial das leishmanioses inclui os métodos diretos de
observação do parasito, que podem ser obtidos por meio de: escarificado de lesão
com exame em lamina de vidro corado pelo GIEMSA; isolamento do parasito em
meios de cultura, a partir de fragmentos de biópsia e/ou aspirado de lesão; Imprint
em lamina de vidro a partir de material coletado de biópsia de pele ou mucosa e
visualização do parasito em cortes histológicos de biópsia e a pesquisa do DNA do
parasito pela Reação em Cadeia da Polimerase (PCR).
Os métodos indiretos incluem: o exame histopatológico, que pode ser considerado
compatível com leishmaniose de acordo com o aspecto histopatológico encontrado
86
; a sorologia, onde são mais utilizados a Reação de Imunofluorescencia Indireta
(RIFI) e os ensaios imunoenzimáticos (enzyme linked immunosorbent assay-ELISA),
52
.
O diagnóstico parasitológico de LC requer demonstração microscópica ou cultivo de
parasitos de Leishmania sp através de aspirado das úlceras, ou de biópsias de pele
52
.
O diagnóstico definitivo das formas mucosas requer demonstração do parasito nos
meios de cultura ou em biópsias de histopatológico, porém, devido à baixa
freqüência de parasitos nestas lesões a sensibilidade desses métodos varia entre 10
a 45 %
51
. A sensibilidade dos métodos sorológicos também é variável, pois mesmo
naqueles mais sensíveis há possibilidade de reações cruzadas e não se pode
distinguir entre as species
87
, dessa forma aceita-se o diagnóstico por métodos como
histopatológico compatível com LM e IDRM, preferencialmente associados a clínica
e epidemiologia indicativos da doença
88,89
.
1.7.1.1 Histopatologia
A observação do parasito, além do exame de escarificado da lesão, pode ser feita
pelo exame histopatológico, que também permite se observar características
teciduais sugestivas de LTA. Nos casos em que ou quando o agente etiológico não é
encontrado o anatomopatologista pode emitir um laudo histopatológico de
compatível com Leishmaniose Tegumentar baseado nestas características, ou seja,
18
biópsias de pele com suspeita clínico-epidemiológica de LTA cujo exame
histopatológico demonstre formações granulomatosas, constituídas por células
epitelióides,
células
gigantes
tipo
Langhans,
linfócitos,
hiperplasia
pseudoepiteliomatosa, histiócitos vacuolizados e moderado infiltrado de plasmócitos
86
.
1.7.1.1.1 Classificação histopatológica da LTA
90
Azulay
em 1960, propôs a primeira classificação de LTA, esse autor acreditava
que a fase inicial da doença era caracterizada histopatologicamente por um
processo exsudativo agudo e que na fase tardia surgisse um granuloma tuberculóide
e propôs a seguinte classificação:
Inflamação exudadativa aguda;
Inflamação predominantemente histiocitária;
Inflamação histiócitolifocitária difusa com nichos epitelióides;
Inflamação histiócito-linfócito-plasmocitária;
Granuloma gigantocitário;
Granuloma tuberculóide;
Granuloma histiocitário lepromatóide.
Posteriormente, Ridley et al.
88
apresentaram uma nova classificação histopatológica
baseados em biópsias de 60 indivíduos com leishmaniose cutânea dividida em cinco
grupos:
Grupo I, derme quase normal exceto por leves alterações degenerativas do
colágeno, raras células inflamatórias ou ausentes e sem granuloma;
Grupo II, a característica predominante foi um processo necrozante mais
severo que o grupo l;
Grupo III infiltrado inflamatório acentuado sem necrose ou granuloma.
Grupo IV abundancia de linfócitos e células plásmaticas (porém não
predominando), células gigantes de Langhans e pouco desenvolvidas
primitivo granuloma de células epitelióides e necrose central;
Grupo V Granuloma bem desenvolvido células epitelióides com ou sem
células gigantes de Langhans bem desenvolvidas e numerosas células
plasmáticas.
19
A partir de um estudo histopatológico de 162 casos de Leishmaniose cutânea e
mucosa com pacientes da Bahia, Magalhães et al.
91
descreveram também cinco
diferentes padrões histopatológicos, estabelecendo um prognóstico pra cada tipo de
acordo com as formas clínicas, mucosa ou cutânea:
Tipo
I
reação
exsudativo-celular
com
infiltrado
inflamatório
histiolinfoplasmocitário dérmico ou do córion da mucosa com proporções que
tendem a equivalência;
Tipo II reação exsudativo-necrótica distinguida por necrose tissular de
amplitude variável, na derme ou no córion da mucosa, associado a vasculite
aguda, no seio do infiltrado histiolinfoplasmocitário;
Tipo III reação exsudativa e necrótico-granulomatosa caracterizada por
reação granulomatosa desorganizada nas proximidades da área de necrose
tissular, com vasculite aguda menos freqüente com presença de macrófagos
ativados e de células gigantes no seio do infiltrado histiolinfoplasmocitário;
Tipo IV reação exsudativa e granulomatosa com reação granulomatosa
desorganizada isolada no seio do infiltrado inflamatório, sem presença de
necrose tissular. Infiltrado histiolinfoplasmocitário;
Tipo V reação exsudativa e tuberculóide - reação granulomatosa organizada
em arranjos tuberculóides, no centro do infiltrado histiolinfoplasmocitário.
Em 1991, Bittencourt e Barral
Magalhães et al.
91
89
, reavaliaram as classificações de Riddley et al.
88
e
e propuseram uma classificação mais simplificada constando
apenas de três padrões histopatológicos:
A – Infiltrado inflamatório de células plasmáticas linfócitos e macrófagos, e
ausência de células epitelióides gigantes;
B – Ocorrência de células gigantes e/ou epitelióides, associados a infiltrado
inflamatório;
C – Presença de granuloma bem circunscrito com células gigantes ou
epitelióides, associado ou não aos outros dois padrões.
Neste trabalho, os autores concluem que os padrões histopatológicos não
representam um estágio de leishmaniose tegumentar, não podendo, dessa forma,
ser correlacionados com o prognóstico e resposta a tratamento como a literatura
20
sugeria.
Andrade-Narvaez et al.,
92
avaliaram 73 casos de leishmaniose cutânea localizada
pela histopatologia. Esses achados histopatológicos basearam-se na classificação
de Magalhães et al., 1986. O padrão mais comumente encontrado foi presença de
granulomas não organizados sem necrose, observado em 43,8% dos exames. O
parasito foi encontrado em 68,5% dos casos.
1.7.2. Biologia molecular
1.7.2.1. Reação de Cadeia de Polimerase (PCR)
Originalmente descrita por Mullis e Faloona
93
a Reação em Cadeia da Polimerase
(PCR) é uma técnica in vitro que possibilita a rápida detecção e identificação do
DNA dos parasitos, sem a necessidade de isolamento, permitindo a geração de
cópias de seqüências específicas de DNA e a amplificação de seqüências
específicas de ácido desoxirribonucléico (DNA) ou de ácido ribonucléico (RNA), este
último realizado a partir da síntese de ácido desoxirribonucléico complementar.
Rodgers et al.
94
desenvolveram um método sensível o suficiente para detectar o
DNA do cinetoplasto (kDNA) de um simples organismo permitindo o uso de métodos
de hibridização não radioativos. O kDNA da Leishmania é um dos principais alvos
das técnicas moleculares desenvolvidas no diagnóstico de leishmaniose. O kDNA é
constituído por duas moléculas, os minicírculos de 1,42 Kb e os maxicírculos de
cerca de 36 Kb. A PCR pode ser usada para aumentar a sensibilidade da detecção
de Leishmanias por métodos de hibridização através da amplificação de seqüências
do minicírculo.
Por causa das limitações mencionadas para a detecção direta do parasito, um
número de diagnósticos alternativos, incluindo os testes sorológicos como o ELISA,
a RIFI e técnica direta de Aglutinação (TDA) tem sido desenvolvidos, entretanto, a
maioria delas têm demonstrado baixa sensibilidade
95,96
. O uso de técnicas
sorológicas é complicado devido à baixa correlação com os aspectos clínicos da
doença 97.
Na tentativa de evitar esses problemas, técnicas moleculares como a PCR e PCR
21
Elisa tem sido desenvolvidas para a detecção dos parasitos de Leishmania nas
amostras de tecidos, inclusive parafinados, retirados de pacientes com suspeita de
LC e LM com sensibilidade variando entre 83,3 a 92% e especificidade de até 100%
86,98,99
.
A PCR tem sido apontada como uma ferramenta de grande importância no
diagnóstico da LM
66,72,100,101
. É altamente sensível e específica para a detecção de
Leishmania; sua aplicação é requerida para diagnóstico diferencial antes da
terapêutica; tem se mostrado substancialmente superior à microscopia e à cultura de
parasitos, principalmente em formas com baixas cargas parasitárias como nas
mucosas 102.
Laskay et al.
103
foram os primeiros a usar a PCR em tecidos, fixados em parafina,
para diagnóstico de leishmaniose em biópsias de pele de pacientes infectados por
Leishmania aethiopica.
No entanto, ocorre uma baixa sensibilidade do método no diagnóstico das espécies
de Leishmania em decorrência da degradação do DNA pela fixação em formol e o
tempo de emblocamento 104,105.
Libório et al.
105
em relação ao material extraído de biópsias parafinadas,
demonstraram que, apesar de o DNA extraído de tecido parafinado guardado por
muitos anos estar degradado, é possível usar DNA genômico em reações de PCR
de produtos pequenos; porém a amplificação de produtos maiores é mais difícil.
Um estudo para identificação das cinco principais espécies de Leishmania que
causam LC do Novo Mundo, em biópsias fixadas em parafina através daPCR, foi
realizado por Mimori et al.
106
, os autores enfatizaram sua importância como uma
ferramenta utilizadas no diagnóstico da leishmaniose cutânea.
Andrade
104
avaliou por PCR 43 biópsias de pacientes suspeitos de LC, cujo
diagnóstico foi dado como compatível com LTA, e 40 biópsias dos pacientes com
diagnóstico de LTA comprovado na microscopia pela observação das amastigotas e
encontrou 96,66% de correspondência utilizando o PCR com “primers” de área
22
conservada do kDNA com 120 pares de base.
A técnica de PCR tem sido indicada como ideal, em detrimento da caracterização
por isoenzimas, método trabalhoso e despendioso, porém considerado de escolha
para o diagnóstico e caracterização de species de Leishmania 107.
Disch et al.
87
utilizaram a PCR para o diagnóstico de LM em 13 pacientes e
encontraram 86,4% de positividade contra apenas 16,7% pela microscopia.
Embora a PCR seja uma técnica muito sensível na detecção dos parasitos, requer
cuidados seletivos, comparação e avaliação dos reagentes, equipamentos e
condições para os testes bem como técnicos treinados
96
.
1.7.2.2. NASBA
O Nasba é uma técnica baseada na detecção do RNA parasitário que tem sido
utilizada principalmente na quantificação da carga viral do vírus do HIV e, mais
recentemente, tem sido utilizada para diagnóstico e quantificação de Leishmania em
lesões de pele, teste conhecido como “QT-NASBA - Quantitative Nucleic Acid
Sequence-Based Assay” mostrando ser um teste promissor no monitoramento de
casos de LTA pós- tratamento 108,109.
1.7.3. Intradermoreação de Montenegro
A IDRM é o mais utilizado teste complementar no diagnóstico presuntivo de infecção
por Leishmania, classicamente a IDRM positiva pode ser um indicativo de contato
prévio com o parasito. Alternativamente, o teste positivo pode resultar de imunidade
adquirida por vacina ou ainda pode ser positivo por reações não específicas ligadas
ao mertiolato ou fenol usados como preservatives 110.
Na prática clínica os métodos utilizados para o diagnóstico etiológico de
leishmaniose (imprint, histopatologia, cultura e PCR) são usados para confirmar o
diagnóstico de indivíduos com suspeita clínica e IDRM positivo
Amato
112
111
.
acompanhou 17 pacientes portadores de LM nos quais a IDRM e a RIFI
foram positivas em todos os pacientes, ao exame histopatológico observou-se
23
alterações inflamatórias inespecíficas em 16 (94,1%) e em somente um paciente
foram
observadas
formas
amastigotas
de
Leishmania.
A
reação
de
imunohistoquímica, realizada em 16 doentes, foi positiva em 12 (70,5%).
A IDMR é de grande importância no diagnóstico da LM por ser um método de fácil
aplicação, podendo ser utilizado no campo e realizado por um técnico treinado. Nas
lesões mucosas a resposta cutânea ao teste de Montenegro é mais intensa,
podendo ocorrer até ulceração e necrose local
25
quando ocorre acima de 10 mm e
com necrose é bastante sugestiva de doença mucosa em atividade
84
.
A ocorrência da LM no Amazonas com taxas de prevalência de 1,4% é menor que
no restante do país, onde as taxas de acometimento mucoso variam entre 3 a 5 %,
as dificuldades encontradas para o estabelecimento do diagnóstico incluem a grande
maioria dos casos com diagnóstico clínico e epidemiológico, na maioria das vezes
com apenas um critério laboratorial a mais, como a IDRM, histopatologia, inoculação
em “Hamster” e cultura ou apenas com diagnóstico clinico – epidemiológico 98,112.
1.8 Terapêutica
O brasileiro Gaspar Vianna foi quem utilizou o Tártaro emético pela primeira vez no
tratamento da leishmaniose, mudando dessa forma a história natural da doença
humana
113
, esse medicamento vem sendo a primeira escolha no tratamento das
leishmanioses até os dias atuais 51.
A terapia da LC inclui injeções com antimoniais pentavalentes e Anfotericina B,
pentamidina ou itraconazol e mais recentemente o Miltefosine
114,115
. Essas drogas
podem causar diversos efeitos colaterais. Muitos esquemas de tratamento são
empregados com sucesso variado, embora, em sua maioria descontrolados,
Atualmente a duração do tratamento e cura da doença tem sido baseado apenas em
critérios clínicos 116,117.
A duração do tratamento da LMC é, eventualmente, mais difícil de estabelecer (em
relação à LC) e não está padronizado. Falhas no tratamento são regularmente
encontradas. Entretanto, é importante que se determine o número de parasitos por
lesão antes e após o tratamento como segurança em possíveis sucessos no final do
24
tratamento 25.
Amato et al.
118
fizeram uma revisão sobre o tratamento da LM na América Latina e
encontraram 51% de taxas de cura entre os 150 pacientes tratados com
Estibogluconato de sódio e 88% entre os tratados com Antimoniato de meglumina,
consideraram que o antimoniato de meglumina é a droga de escolha e que oferece
taxas de cura semelhantes a anfotericina B e a pentamidina.
O Antimoniato-N-metilglucamina é indicado como droga de primeira escolha no
tratamento das leishmanioses, correspondente ao Sb+5 conjugado a metilglucamina, sendo comercializado sob a denominação de Glucantime apresentandose sob a forma de ampolas contendo 5 ml (85mg/Sb+5/ ml). O Glucantime - é
manufaturado pela Rhone Poulenc na França e amplamente utilizado nos paises de
língua não-inglesa, sendo fornecido para o Brasil através do laboratório Aventis- SP.
No tratamento da LM, é indicado nas doses de 20 mg/Kg/peso ao dia durante 30
dias 25.
Preparações comerciais de Anfotericina B incluem a formulação lipídica anfotericina
B liposomal (Ambisome®), anfotericina de dispersão coloidal (Amphocil®) e
amfotericina complexo lipídico (Abelcet®) e a clássica apresentação, anfotericina
desoxicolato (Fungizon®) 14.
Possui excelente atividade anti-Leishmania, embora seja limitada por fatores como
administração de uso hospitalar e efeitos colaterais, principalmente acometimento
renal, o que limita seu uso
14
. É capaz de potencializar a atividade do macrófago na
respost
ta antimicrobiana, seja por via direta ou por indução na produção de citocinas como
TNFα e IL-1β, assim como a geração de mecanismos oxidativos
40
.
A Pentamidina está entre as medicações de segunda e terceira linhas utilizadas na
LTA e indicadas pelo Ministério da Saúde, em função de sua pouca utilização no
restante do Brasil 25.
No Estado do Amazonas esta medicação vem sendo amplamente utilizada, inclusive
25
como segunda opção no tratamento da LTA, nas formas Cutânea e Mucosa,
principalmente na doença mucosa, como uma excelente alternativa nos casos de
não resposta aos antimoniais. A Pentamidina é utilizada na dose de 4 mg por Kg de
peso, em três aplicações, com dois dias de intervalo entre as doses (esquema usual
– Brasil MS, 2000). No Suriname é utilizada em doses semanais com bastante
eficácia 33,60,119,120,121,122,123.
Amato
111
tratou 17 pacientes de LM com isotionato de pentamidina observando
cicatrização das lesões em 94,1% dos pacientes, período médio de seguimento 13,3
meses (3 a 37 meses). Um doente apresentou recidiva após quatro meses do
término da medicação. Em 58,8% observou aumento dos níveis de uréia e creatinina
em 47,0% e leucopenia em 5,8%, que regrediram com o espaçamento da dose da
pentamidina, não sendo necessário suspender o tratamento. Uma mulher
desenvolveu diabetes melittus. 41,1% dos pacientes nada apresentaram.
Amato et al.
124
estudaram, em quinze pacientes com LM, antes e após tratamento
com lesões consideradas cicatrizadas pela avaliação otorrinolaringológica, a
correlação entre a presença de antígeno no tecido através da reação de imunohistoquímica, os títulos da reação de imunofluorescência indireta e os achados
anatomopatológicos. Após a terapêutica houve negativação do antígeno tecidual em
quatro doentes (grupo A), sendo a redução ou negativação dos títulos da RIFI
estatisticamente significante (p<0.05), o que não ocorreu nos doentes, em que
houve permanência do antígeno posteriormente ao tratamento (grupo B), sugerindo
que o acompanhamento sorológico deva ser realizado conjuntamente com a
pesquisa do antígeno tecidual indicando que a negativação destes testes nos
doentes do grupo A, provavelmente indicam menor possibilidade de recidiva.
Trabalhos desenvolvidos na FMTAM apontam a pentamidina como uma alternativa
de primeira escolha no tratamento da LM
Paula
125
122,33
. Trabalhos desenvolvidos por De
destacam a vantagem da pentamidina no custo geral em relação aos
antimoniais.
A despeito da experiência acumulada no manuseio dos antimoniais e da
pentamidina, não há no Estado do Amazonas um estudo publicado, dentro do
26
método científico, comparando a eficácia de ambas as drogas no tratamento da LTA
na forma mucosa.
No Peru, o incremento das medidas no diagnóstico e seguimento dos doentes de LM
não impediu a grande perda de seguimento que já existia (que ficou em 47%), essa
alta proporção de perdas após o tratamento é explicada pelas características sócioeconômicas da população daquela área; as pessoas afetadas vivem em vilas
isoladas no meio da floresta, com pouco acesso a transporte, causando uma grande
dificuldade de alcançar e/ou serem alcançadas pelos agentes ou serviços de saúde;
são usualmente trabalhadores migrantes que permanecem por poucas semanas ou
meses na floresta e retornam as suas vilas de origem
126
.
1.9 Controle
No Brasil, a doença foi tradicionalmente confinada às zonas rurais e periferias das
cidades, mas, nos últimos anos, os números de casos de leishmaniose nas áreas
metropolitanas tem aumentado dramaticamente
52
.
O aumento da incidência de leishmaniose tem ocorrido devido a diversos fatores:
expansão geográfica, abertura de estradas, implantação de pólos agropecuários.
Movimentação de pessoas para regiões endêmicas (como colonização em novas
regiões do estado do Amazonas ou movimentações de trabalhadores, garimpeiros e
suas companhias e ainda treinamentos militares em áreas de selva
122,126,127
.
O desenvolvimento de vacina eficaz contra a doença seria fundamental para seu
controle, mas isto ainda não é possível embora existam diversas propostas
2,129,130.131
e diversos estudos estejam em andamento, ou já tenham sido
desenvolvidos, poucos deles demonstraram, ou vem demonstrado perceptivas para
curto ou médio prazo, tampouco a quimioprofilaxia, com drogas anti – Leishmania. O
controle das leishmanioses pode ser feito parcialmente, mediante algumas medidas
como borrifação aplicáveis aos vetores que, no entanto, devem ser específicas para
cada foco ou situação 25.
Em áreas de densa floresta e grandes distâncias, como na Amazônia, estas
medidas são bem menos aplicáveis ficando, portanto, esse controle dependente do
27
diagnóstico precoce e do tratamento dos casos humanos 129.
1.10 Leishmanioses na Amazônia
Na Amazônia brasileira ocorrem a Leishmaniose Tegumentar Americana (LTA) e
Leishmaniose Visceral (LV). A LTA está agrupada sob três diferentes formas
clínicas: Leishmaniose Cutânea (LC), Leishmaniose Cutânea Difusa (LCD) e
Leishmaniose Mucosa (LM)
34,132
. Já foram notificados casos de LTA/LC, LCD, LM e
LV. A etiologia de casos de Leishmaniose nessa região é atribuída a sete diferentes
espécies - L. amazonensis, L. (V.) naiffi, L. (V.) lansoni, L. (V.) shawi, L. (V.)
guyanensis, L. (V.) braziliensis, L. (V.) lindemberg e L (L.) chagasi
LTA é primariamente uma zoonose
31,56
82
. Nessa região a
com ciclo de transmissão ocorrendo entre os
flebotomíneos e os animais silvestres. Na maioria das vezes, o homem se infecta ao
alterar o ambiente interrompendo o ciclo silvestre ao penetrar neste ecossistema
68,69
.
No Amazonas, no município de Manaus, principalmente na periferia da cidade, o
grau de exposição dos indivíduos acometidos tem uma significativa parcela
relacionada diretamente a processos de ocupação desordenada ou ás chamadas
invasões. Dessa forma, a LTA, geralmente ocorre em lugares de assentamentos
populacionais recentes e relacionada com desmatamentos
próximas a áreas de floresta primária
31
36,123,133
em populações
onde ocorre a construção de habitações em
locais nos quais a Leishmania (Viania) guyanensis é enzoótica 68.
É provável que a transmissão também ocorra no intra e no peridomicílio na região de
Manaus. Paes et al.
60
, em estudo em bairro de implantação antiga na cidade de
Manaus, observaram um novo surto de LTA no qual 9,8% dos casos estudados
eram crianças menores de 5 anos. Andrade
131
(1998), em estudo realizado na
Cidade de Deus, bairro da periferia de Manaus, localizado imediatamente à Reserva
Florestal Adolpho Ducke, verificou a ocorrência de vários casos de LTA na rua que
tem limite com aquela reserva.
Dentre os possíveis reservatórios silvestres da L. (V) guyanesis, à preguiça
(Choloepus didactylus) tem sido atribuído o papel principal na Amazônia brasileira
56,68,69
e em alguns locais da Guiana Francesa
134
, nas áreas de floresta primária.
28
Também implicado como importante reservatório silvestre está o Tamandua
tetradactyla (tamanduá), e secundariamente temos Proechimys sp. (rato silvestre) e
o Didelphis marsupialis (mucura ou gambá)
45,56,68,69,70
encontrados na pele e nas vísceras desses animais
. Os parasitos podem ser
31,69
, embora seu encontro não
seja fácil. O Didelphis marsupialis adquire especial importância em áreas de floresta
alteradas pelo homem
31,45,56,69
com uma taxa de infecção na região de Manaus de
mais de 20%. Este animal se alimenta em refugos domésticos nos limites da floresta
próximo às casas
68
ocorrendo constante circulação entre o meio florestal, onde se
infecta, e o ambiente humano, onde serve de fonte de infecção para os flebótomos
ali presentes
133
, dessa forma possivelmente estabelecendo um elo entre o ciclo
silvestre e o peridomicílio.
A transmissão da LTA nas regiões de calha Norte do rio Amazonas é atribuída às
Lutzomyia umbratilis
57,69
135
e Lutzomyia anduzei
, considerados respectivamente
vetores principal e secundário da Leishmania (V.) guyanensis, o parasito prevalente
na etiologia da LTA/LC na região
68,136
. No estudo de Naiff et al.
49
, das espécies de
Leishmania identificadas de 65 indivíduos portadores de LTA, da região amazônica
brasileira, a Leishmania (V.) guyanensis foi encontrada em 83% dos casos, destes,
91% apresentavam lesão cutânea.
Maior número de casos é registrado no período das chuvas
35,57,137
, quando há
aumento da densidade de vetores. O número de casos de LTA tem correspondência
direta com o índice pluviométrico na região
138,139
.
Provavelmente este fenômeno deva-se ao aumento da densidade dos vetores de na
base das árvores, na floresta, segundo verificado por Pajot et al.
134
na Guiana
Francesa, onde a maioria dos casos ocorria no início do período chuvoso (dezembro
e
janeiro),
quando
as
fêmeas
infectadas
de
Lutzomyia
umbratilis
eram
excepcionalmente abundantes nesses locais, fato mais uma vez comprovado pela
captura de maior número de flebotomíneos neste período, destacando-se a
predominância da Lutzomyia umbratilis em áreas de transmisão na periferia de
Manaus 137.
A maioria dos casos de LTA ocorre em pacientes jovens do sexo masculino, com
predomínio entre 20 e 29 anos. Isto corresponde pelo fato de que atividades
29
extrativas na floresta, normalmente realizadas por homens adultos, são o principal
fator de risco para transmissão. As diferenças marcantes observadas com relação à
distribuição de casos segundo o sexo entre as diversas faixas-etárias
112
refletem
diferentes tipos de transmissão: a domiciliar e peridomiciliar e a ocupacional. Em
grupos de menor idade, as pessoas ficam dentro ou ao redor das casas, portanto
ambos os sexos podem ser igualmente infectados 59,140.
Uma parte significativa dos pacientes de LTA tem atividades que os expõe aos
vetores da Leishmania, como agricultura e trabalho em granjas. Há grupos de
pacientes que possivelmente é infectado no intra/peridomicílio, como crianças e
idosos além de uma casuística importante de domésticas e estudantes, sendo a
aquisição da doença nestes casos provavelmente devido a flebótomos infectados
que foram atraídos da floresta vizinha pela luz das casas à noite, já que os vetores
não estão adaptados ao hábitat peridoméstico
31,112,141,142
.
Os habitantes das localidades do interior, como pequenos povoados e também da
periferia das grandes cidades na Amazônia, costumam adentrar a mata para
atividades extrativistas e mesmo buscar água em cacimbas cedo pela manhã,
período de maior risco de infecção por Leishmania 31,69. Assim, diversos pacientes, a
despeito de não possuírem atividade relacionada à mata, poderiam ter se infectado
ao adentrar a floresta para extrativismo, prática comum de subsistência das
populações amazônicas, busca de água ou mesmo lazer, em qualquer período do
dia com grande risco de infecção.
Guerra et al.
141
em trabalho com reservatórios em área periférica de Manaus
avaliaram 20 exemplares de Didelphis marsupialis, dos quais se coletou material
para cultura, obtendo isolamento de flagelados no sangue periférico, que, no
entanto, não foram caracterizados como Leishmania. Porém é freqüente o relato de
gambás
(ou
mucuras)
na
periferia
das
casas,
sugerindo
que
estas,
reconhecidamente reservatórios de leishmaniose, estejam exercendo este papel em
seu trânsito peridomicílio-mata. Pode ser encontrada uma alta taxa de infecção
destes animais, explicável por uma diminuição no número dos reservatórios
primários, bem como aumento no número de gambás, atraídos pelo homem, pra
estas áreas degradadas 28,59.
30
No município de Cacual (RO), área de alta endemicidade de LTA, tanto para as
formas mucosas quanto cutâneas - a Lutzomyia antunesi foi o flebotomíneo mais
capturado em armadilhas luminosas CDC e em base de árvores
143
. Este mesmo
vetor foi encontrado associado a casos da L. (V.) lindembergi na região de Belém
(PA) 27.
van der Meide et al.
109
identificaram por PCR, em pacientes portadores de LC
atendidos na FMTAM, 69 indivíduos com leishmaniose causada pela L. (V.)
guyanensis, dois pela L.(L.) amazonensis e cinco pela L. (V.) braziliensis,
demonstrando que estas espécies circulam na região de Manaus, como
demonstrado também por Romero et al. 47.
Silva et al.
144
observaram altas taxas de LM no Estado do Acre, cujo perfil clínico
epidemiológico se coaduna com os casos do restante do pais, entretanto,
configuram um significativo problema de saúde pública naquele estado.
Camuset et al. 145 encontraram em Guajará Mirim (RO) uma importante casuística de
LM, sem a caracterização da espécie causadora. Entretanto, Shaw et al.
146
descreveram diferentes espécies agentes de LC naquele estado, registrando pela
primeira vez a infecção humana por L. (V.) braziliensis e L. (V.) lainsoni em
Rondônia.
A proposta desse trabalho foi mostrar os aspectos clínico- epidemiológicos da LM no
estado do Amazonas a partir dos dados de atendimento da FMTAM. Avaliar os
aspectos clínicos, epidemiológicos, e terapêuticos em pacientes de LTA/LM
atendidos na Fundação de Medicina Tropical do Amazonas (FMTAM) no período de
julho de 1992 a dezembro de 2008. Avaliar os aspectos clínicos e epidemiológicos
terapêuticos e definir o perfil clínico-epidemiológico dos casos de LM da região
Amazônica.
31
2 OBJETIVOS
2.1 Geral
Estudar
os
aspectos
etiológicos,
clínicos,
epidemiológicos,
diagnósticos
e
terapêuticos relacionados à Leishmaniose Cutâneo Mucosa em pacientes atendidos
na FMTAM e oriundos da Amazônia.
2.2 Específicos
2.2.1 Descrever os aspectos clínicos da LM nos casos atendidos;
2.2.2 Estabelecer o perfil epidemiológico dos casos;
2.2.3 Descrever as espécies de Leishmania envolvidas na doença;
2.2.4 Avaliar os aspectos relacionados a aderência ao tratamento;
2.2.5 Descrever a distribuição espacial dos casos de acordo com a sua procedência;
32
3. PACIENTES E MÉTODOS
3.1 Modelo de Estudo
Trata-se de um estudo descritivo, retrospectivo/prospectivo, de série de casos. A
amostra será de conveniência, incluindo-se os pacientes portadores de LTA – Forma
Mucosa (LTA - LM), com diagnóstico clínico ou confirmado por Intradermorreação de
Montenegro (IDRM), exame direto (por escarificação em lâmina), histopatológico
biópsia (com demonstração de parasito ou compatível com LTA) ou por PCR.
3.2 Universo de Estudo
Casos de LM em pacientes atendidos na Fundação de Medicina Tropical do
Amazonas (FMTAM).
3.3 População de Referência
O estudo teve como alvo a população que habita a região Amazônica, sendo os
pacientes atendidos na cidade de Manaus, capital do Estado do Amazonas, que
procurou o serviço de atendimento da FMTAM durante o período determinado para o
estudo.
3.3.1 População de Estudo
A população de estudo foi de pacientes de LM atendidos, diagnosticados e tratados
na FMTAM, na cidade de Manaus, capital do Estado do Amazonas e procedentes da
Amazônia brasileira, região que abrange uma área de 5.000.000 Km2 - 59% do
território brasileiro, distribuída por 775 municípios, abrangendo os Estados do
Amazonas, Amapá, Mato Grosso, oeste do Maranhão, Pará, Rondônia, Roraima,
Acre e Tocantins, com uma população estimada em 20,3 milhões de moradores,
sendo 68,9% residentes na área urbana e 31,1% na área rural
147
.
3.4 Período de estudo
Os dados são referentes a dois períodos: no primeiro foram levantados dados de
prontuários de pacientes com LM atendidos na FMTAM no período de julho 1992 a
junho de 2006. No segundo foram incluídos os pacientes com diagnóstico de LM
resultantes da demanda espontânea de atendimento ambulatorial da FMTAM no
período de julho de 2006 a junho de 2008, que concordarem em participar do estudo
33
mediante assinatura do Termo de Consentimento Livre e Esclarecido (TCLE).
Para ambos os estudos se utilizou um ficha clínica, elaborada em conjunto com o
otorinolaringologista, onde constam os dados do doente com um roteiro dos
aspectos clínicos do acometimento nasal/oral ou outras formas de acometimento
mucoso associados à leishmaniose e encontrados no exame físico (Anexo 2).
Este estudo foi elaborado segundo as diretrizes éticas internacionais para pesquisas
Biomédicas envolvendo seres humanos (Resolução 196/96 CNS, 1996), e foi
aprovado pela Comissão de Ética médica da FMTAM, sob protocolo de número
1809/2006-FMTAM.
3.5 Definição de casos
3.5.1 Estudo retrospectivo:
Considerou-se como caso de LM:
Pacientes com história clínica e exame físico sugestivos de doença mucosa,
tratados e notificados como LM e associados preferencialmente a pelo menos um
dos seguintes critérios:
úlcera ou infiltrado ou eritema importante em septo nasal ou orofaringe com
exposição ou perfuração ou destruição de cartilagem nasal ou lesão de palato
com características clínicas de LM;
exame complementar positivo (IDRM, exame direto, cultura, inoculação em
hamster, sorologia e histopatologia com parasito ou compatível com LM);
submetido a tratamento com droga leishmanicida e notificado como caso de
LM.
Foram avaliadas todas as informações contidas em documentos (prontuários, fichas
relatórios, resultados de exames etc...), relativas aos casos de LM atendidos no
referido período dispostas e analisadas no programa Microsoft Exel versão 6.0 e
montada uma base de dados com ênfase nas informações relativas aos aspectos
clínicos, epidemiológicos, laboratoriais e terapêuticos dos casos atendidos.
3.5.2 Estudo prospectivo:
Foram considerados casos de LM:
34
Pacientes com história clínica e exame físico sugestivos de doença mucosa, e
associados preferencialmente com pelo menos um dos seguintes critérios:
Úlcera ou infiltrado importante em septo nasal ou orofaringe com exposição
ou perfuração ou destruição de cartilagem nasal ou lesão de palato com
características clínicas sugestivas de LM;
exame complementar positivo (IDRM, exame direto, PCR, cultura, inoculação
em hamster, sorologia e histopatologia com parasito ou compatível com LM);
3.5.2.1 - Critérios de inclusão
Quaisquer idade;
clínica compatível com LM em atividade, mesmo após ter sido submetido a
tratamento;
quaisquer tempo de doença;
comprometimento mucoso, com ou sem história de lesão leishmaniótica
cutânea pregressa;
pelo menos um dos seguintes exames diagnósticos positivos: IDRM,
parasitológico direto por esfregaço ou “imprint” de fragmento de biópsia, e/ou
aspecto histopatológico compatível com LTA ou PCR positivo para
Leishmania;
concessão do termo escrito, de consentimento após-informação, pelo
paciente ou por pessoa responsável no caso de menores de idade (ANEXO
1), através de assinatura ou impressão digital.
3.6 Procedimentos
3.6.1 Estudo Retrospectivo
Inicialmente foi feito o levantamento dos prontuários de pacientes com diagnostico
de LM para identificação de informações sócio-epidemiológicas e busca de biópsias
em blocos de parafina depositadas na Gerência de Patologia da FMTAM, para
identificação da espécie de Leishmania pela técnica de PCR a fim de confirmar a o
diagnóstico e a etiologia dos casos estudados.
3.6.2 Estudo prospectivo
3.6.2.1 Atendimento inicial dos pacientes
35
Na primeira consulta, os pacientes selecionados a participarem do estudo foram
submetidos a uma avaliação clínica completa, durante a qual se efetuou o
preenchimento de ficha clínica, incluindo dados de identificação pessoal,
antecedentes pessoais e familiares.
Realizou-se exame otorrinolaringológico de todos os pacientes suspeitos de LM para
se determinar o tipo, localização, extensão e aspecto das lesões mucosas. Buscouse, no exame físico, cicatrizes sugestivas de LC anterior, diagnosticada e/ou tratada
ou não como LTA. Em seguida o paciente foi submetido aos procedimentos
laboratoriais de diagnóstico e exames complementares.
3.6.2.2 Procedimentos diagnósticos
Os procedimentos diagnósticos foram realizados conforme Boaventura et al., (2006).
3.6.2.2.1 Intradermorreação de Montenegro
Realizada seguindo descrição de Reed et al.
148
, onde aplicou-se
0.1 mL de
antígeno (250 mg/mL de proteína) intradermicamente na face anterior do antebraço
esquerdo. A leitura do diâmetro da induração (em mm) foi determinada 48 a 72h
após a inoculação. As reações com diâmetro igual ou superior a 5 mm foram
consideradas positivas.
3.6.2.2.2 Sorologia
Imuno-fluorescência indireta (IFI): a reação de imuno-fluorescência indireta, para a
pesquisa de IgG e IGM, foi realizada segundo a descrição do kit de IFI para
diagnóstico
da
leishmaniose
Janeiro/FIOCRUZ/MS).
humana
Considerando-se
como
(Biomanguinhos-Rio
positivas
amostras
de
que
apresentaram fluorescência em diluições iguais ou maiores que 1/40.
3.6.2.2.3 Biópsias
As biópsias de lesões nasais ou orais foram realizadas sob anestesia local com
lidocaína spray (10%) ou lidocaína (2%) com vasoconstrictor usando a Pinça
sacabocado
de
nariz
da
Factory
cirúrgico
(http://www.factorycirurgico.com.br/compara/pincas.htm), sendo o tecido preservado
em formalina a 10% para posterior análise histopatológica
149
.
36
3.6.2.2.4 Histopatologia
O tecido fixado em formol e emblocado em parafina, foi processado e corado pela
Hematoxilina Eosina (HeE) para leitura.
3.6.2.2.5 Procedimentos moleculares
3.6.2.2.5.1 Extração do DNA total
3.6.2.2.5.1.2 Biópsias parafinadas
Os blocos de tecido parafinizado foram submetidos à 12 cortes de 20 µm com
navalhas descartáveis (Duraedge), uma navalha para cada bloco, em micrótomo
usual (American optical). Estes foram armazenados em microtubos estéreis de 1,5
ml e mantidos a temperatura ambiente.
As biópsias foram desparafinizadas utilizando 1200 ul de xilol por 5 minutos à 14000
rpm em temperatura ambiente. O sobrenadante foi desprezado, as amostras lavadas
com 1200 ul etanol absoluto e centrifugadas 5 minutos a14000 rpm por duas vezes.
O excesso de etanol foi retirado e o residuo seco à 37C por 30 minutos. O DNA foi
extraido utilizando o protocolo “DNeasy Blood e Tissue Kit” (Qiagen) de acordo com
o manual fornecido pelo fabricante.
3.6.2.2.5.1.3 Biópsias congeladas em meio líquido L6
As biópsias armazenadas congeladas foram maceradas individualmente utilizando
homogenizador comercial descartável (Anachem). O DNA foi extraído do
homogeneizado de tecido utilizando o protocolo: Purification of Total DNA from
Animal Tissue - Spin-Column Protocol (Qiagen).
3.6.2.2.5.1.4 Extração do DNA de material em papel de filtro
O decalque em papel filtro foi recortado em pequenos cortes e colocado em
microtubos estéreis de 1,5 ml, aos quais foram adicionado 180 ul de tampão de
digestão e 20 ul de proteinase K. A extração do DNA total foi de acordo com o
protocolo Blood spots do kit PuriLink Genomic DNA (Invitrogen). Todas as amostras
do DNA total extraídas foram conservadas à -20ºC.
37
Durante o processo de extração de DNA, a cada 10 amostras foi incluído um papel
em branco para certificação de não-contaminação no processo. As amostras do
DNA total foram conservadas à -20ºC.
3.6.2.2.5.2 Reação em Cadeia de Polimerase (PCR)
3.6.2.2.5.2.1 Amplificação de Mini-círculo DNA Kinetoplastidial
Esta PCR tem como DNA alvo uma região constante de 116 pares de bases do minicírculo de kDNA e é utilizada atualmente na identificação do gênero Leishmania. Os
iniciadores utilizados foram: 13a (5`-GTGGGGGAGGGGCGTTCT-3`) e o 13b (5`ATTTTACACCAACCCCCAGTT-3´) descritos por Rodgers et al. 1990. Os iniciadores
eram da marca invitrogen.
A mistura de reação de PCR foi composta por 0,4 uM de cada iniciador, 3,5uM
MgCl2, 0,2 mM dNTPs, 1U Taq DNA polimerase Platinnum e tampão 1X (Invitrogen),
em um volume final de 25µl. Em cada reação foi incluso um controle NT (notemplate), para certificação de não contaminação da PCR e um controle positivo de
Leishmania sp.
A reação foi executada num ciclo térmico inicial de desnaturação à 94°C por 5 min,
seguido de 40 ciclos de: desnaturação à 94°C por 35 s, hibridização à 60°C por 30 s
e extensão a 70°C por 30s. A extensão final foi efetuada a 70°C por 7 min
150
. A
reação de amplificação ocorreu no termociclador da marca Eppendorf mastercycler
gradient.
Os produtos da reação foram submetidos à eletroforese em gel de agarose a 1,5%
submerso em TBE 1X, dissolvido sobre aquecimento em microondas durante 2
minutos e corados com brometo de etídio. O tamanho aproximado em pares de
bases do produto de amplificação foi determinado por comparação com um
marcador de 100 pb. Os produtos de reação de PCR foram visualizados sobre luz
ultravioleta no transiluminador UVP (Upland CA91786 USA Model, 115 v 60Hg, 60
Amps). As fotos foram obtidas com maquina fotográfica digital Canon Power Shot
G6 e arquivadas em formato de arquivo JPEG para documentação.
A análise do gel consistiu na visualização das "bandas" dos produtos amplificados,
38
comparativamente com os produtos amplificados relativos aos controles positivos
negativos e os Ladder estipulados em cada PCR realizado.
3.6.2.2.5.2.2 Amplificação do gene que codifica a actina humana
Devido à natureza das amostras – biópsias parafinizadas e com longo tempo de
armazenamento - foi necessário certificar que as amostras negativas para
Leishmania, não foram o resultado da degradação de DNA. Assim as amostras
negativas para 13a e 13b (Mini-círculo kDNA), foram amplificadas para confirmação
da presença de DNA total além de verificar a presença de algum inibidor na reação
causando resultados falso-negativos. A reação de PCR teve como alvo uma região
de 147bp do gene que codifica actina humana.
A mistura de reação de PCR foi composta por 0,3 uM de cada iniciador, 3,5 uM
MgCl2, 0,2 mM dNTPs, 1U Taq DNA polimerase e tampão 1X, resultando em um
volume final de 25µl. Em cada reação foi feito um controle NT (no-template), para
certificação de não contaminação da PCR.
A reação foi executada num ciclo térmico inicial de desnaturação à 94°C por 5 min,
seguido de 40 ciclos de desnaturação a 94°C por 35 s, hibridização à 55°C por 30 s
e extensão à 70°C por 30s. A extensão final foi efetuada a 70°C por 7 min.
Os produtos amplificados foram submetidos a eletroforese em gel de agarose a
1,5% em TBE 1X, corados com brometo de etídio. Para determinar o tamanho
aproximado do produto de amplificação, foi usado um marcador de 100 bp. Os
produtos de reação de PCR foram visualizados sob luz ultravioleta e posteriormente
fotografados.
3.6.2.2.5.2.3 Identificação de espécies por amplificação e RFLP do mini-exon
As amostras positivas para a PCR Mini-círculo utilizando os iniciadores 13a e 13b
foram submetidas à identificação da espécie amplificando a região do mini-exon com
um número menor de pares de bases, o qual pôde tornar viável a identificação do
DNA do parasito. O par de iniciadores a utilizar foi o Fme (5`TAT TGGTAT GCG
AAA CTT CCG-3`) e Rme (5´-ACA GAA ACT GAT ACT TAT ATA GCG-3´),
conforme metodologia de Marfut et. al. 151.
39
A mistura de reação de PCR foi composta por 0,2 uM cada iniciador, 1,5uM MgCl2,
0,2 mM dNTPs, 1U Taq DNA polimerase e tampão 1X, resultando em volume final
de 50µl. Em cada reação foi feito um controle NT (no-template), para certificação de
não contaminação da PCR e um controle positivo.
A reação foi executada num ciclo térmico inicial de desnaturação a 94°C por 5 min,
seguido de 40 ciclos de: desnaturação a 94°C por 30s, hibridização a 52°C por 30 s
e extensão a 72°C por 45s. A extensão final foi efetuada a 72°C por 5 min.
Os produtos amplificados foram submetidos a eletroforese em gel de agarose a 1,5
% em TBE 1X, corados com brometo de etídio.
As espécies de Leishmania foram identificadas através da digestão enzimática dos
produtos de PCR descrito acima. Foram utilizadas a enzimas de restrição HaeIII e
NcoI durante 2h e 30 minutos à 37ºC. Estas enzimas clivam em locais específicos o
DNA de L. (V.) braziliensis e L. (V.) guyanensis, conforme o perfil de restrição
conforme seus pares de bases descritos na Tabela 1.
As espécies de Leishmania foram identificadas através da digestão enzimática dos
produtos de PCR descrito acima. Foram utilizadas a enzimas de restrição HaeIII e
NcoI durante 2h e 30 minutos à 37ºC. Estas enzimas clivam em locais específicos o
DNA de L. (V.) braziliensis e L. (V.) guyanensis, conforme o perfil de restrição
conforme seus pares de bases descritos na Tabela 3.
Para determinar o tamanho aproximado dos fragmentos foi utilizado um marcador de
100 bp. Os produtos de reação de hidrolise enzimática (RFLP) foram submetidos a
eletroforese em gel de agarose a 2,5 % em TBE 1X, corados com brometo de etídio,
visualizados sob luz ultravioleta e posteriormente fotografados.
40
Tabela 3 - Tamanho em pares de base dos produtos de restrição
enzimática com HaeIII e Nco I
Espécie
Enzima de restrição
Hae III
Nco I
Total do produto
L. braziliensis
L.guyanensis
118/108
-
-
173/53
226 pb
226 pb
Para confirmar os resultados da restrição enzimática, 10 amostras foram
selecionadas para sequenciamento do produto de PCR mini-exon. As cepas de
referência utilizadas foram L. (V.) braziliensis L408 e L. (V.) guyanensis L 565 e L
566 (OMS) tendo sido gentilmente cedidas pela Dra. Leila Inês Coelho e pelo
Biólogo Roberto Moreira.
Para os controles negativos foram utilizadas biópsias de pacientes com doenças
mucosas não relacionas à leishmaniose. Amostras de biópsias de lesões de LTA,
com presença de parasitos à microscopia óptica (MO) foram utilizadas como controle
positivo.
3.6.2.3 Tratamento
Os pacientes foram tratados com as drogas indicadas pelo Ministério da Saúde e de
acordo com o esquema proposto no Manual de condutas da FMTAM
controle das Leishmanioses do Ministério da Saúde Brasil
152
e Manual de
25
, sendo os antimoniais
(doses de 20 mg/kg/dia durante 30 dias) utilizados como primeira escolha e a
pentamidina (4 mg/Kg/dose em 10 doses em dias alternados) ou anfotericina B (1
mg/kg/dose em dias alternados, com um máximo de 1,5 gr) como segunda escolha.
Foi considerado insucesso a presença de úlceras ou infiltrado nas lesões mucosas
após o prazo de 180 dias 25.
41
Foi considerado recidiva o aparecimento de sinais de atividade nas lesões mucosas
após a cicatrização completa das lesões.
Nos pacientes que apresentaram ainda sinais de atividade (infiltrado ou úlceras),
após este período, ou com piora do quadro e considerados como insucesso, ou
recidiva com os antimoniais ou pentamidina, repetir-se nova série com igual dose, e
tempo de tratamento.
Em casos de impossibilidade, insucesso ou intolerância a ambas as drogas foi
utilizada a Anfotericina B segundo as mesmas recomendações pela FMTAM e/ou
ministério da Saúde.
Cada paciente teve uma ficha de identificação constando de dados de sua
procedência e aquiescência escrita própria ou do responsável – Termo de
Consentimento Livre e Esclarecido (anexo).
O estudo foi desenvolvido de julho de 2006 a dezembro de 2008.
Todos os procedimentos necessários ao estudo e relativos aos pacientes foram
realizados no ambulatório de Dermatologia e no Laboratório de Leishmaniose da
FMTAM. A realização da biópsia de mucosa foi feita apenas por médicos.
3.6.2.4 Desenvolvimento do estudo
O desenvolvimento das atividades do estudo seguiu o cronograma esquematizado,
com as seguintes etapas:
3.6.2.5 Cadastramento dos pacientes
Foram incluídos, para ambos os grupos, todos os pacientes LM atendidos na
FMTAM, no período determinado pelo estudo, que atendam a seguinte de definição
de casos:
Foram considerados como casos de LM aqueles pacientes com história clínica e
exame físico sugestivos de doença mucosa: úlcera ou infiltrado importante em
região nasal ou orofaringe, com exposição, perfuração ou destruição de cartilagem
nasal ou lesão de palato com características clínicas de LM; pacientes com história
42
de LC anterior e ou procedência de regiões da Amazônia; e/ou se exerciam
atividades em áreas de mata primária; com pelo menos um exame complementar
positivo; estes pacientes que foram submetidos a tratamento para LM com as drogas
indicadas pelo Ministério da Saúde
25
.
3.6.2.5.1 Sorologia
Para avaliação dos anticorpos séricos foi utilizada a técnica de ELISA ou
Imunofluorescencia indireta (RIFI). Foram colhidos, de cada paciente, 10 mililitros de
sangue periférico, através de punção venosa, de membro superior, utilizado-se
tubos “vacutainer” estéreis, após antissepsia local com álcool a 70%. O exame foi
efetuado no início do tratamento e no primeiro e sexto mês de acompanhamento
pós-tratamento.
3.6.2.5.2 Biópsia para Histopatológico, cultura e PCR
Após realização de antissepsia, conforme descrito anteriormente, e anestesia local
com lidocaína a 2%, sem vasoconstrictor, na borda da lesão que apresentou
maiores sinais de atividade clínica, foi feita biópsia utilizando-se uma pinça em saca
Bucado obtendo-se dois fragmentos, sendo destes realizado “imprint” por aposição
em lamina de vidro pra pesquisa direta de Leishmania e o outro em papel de filtro
para realização de PCR. Um fragmento foi para a análise histológica e o outro para o
PCR e para semeadura em meios de cultura específicos (NNN, Schneider’s).
3.6.2.6 Parasitológico Direto
Foi realizado imprint das biópsias das lesões, ou raspado das lesões (onde não
havia possibilidade de biopsiar), para pesquisa de Leishmania corado pelo GIEMSA
ou Panótico.
3.6.2.7 Isolamento e Caracterização da cepa de Leishmania
As espécies foram caracterizadas por PCR em projeto paralelo desenvolvido na
FMTAM a partir de material obtido por raspado, aspirado ou biópsia das lesões, seja
fixado em laminas, papel de filtro, guardados em meio de conservação ou
parafinado.
43
3.6.3 - Exames Complementares:
4.6.3.1 Avaliação Laboratorial Hematológica, Hepática, Pancreática E Renal
De cada paciente foi coletada uma amostra de 10 ml de sangue venoso periférico,
para hemograma, dosagens séricas de Glicose, aminotransferases, uréia, creatinina
e amilase e sorologia. Esta avaliação foi realizada antes e após o início do esquema
terapêutico, sendo repetida caso alguma alteração tivesse sido detectada
anteriormente.
3.6.3.1 Avaliação cardíaca
Foi realizado Eletrocardiograma (ECG) dos pacientes antes e após o tratamento
específico da LM.
3.6.4 Execução dos esquemas terapêuticos
Após o cadastramento e realização dos procedimentos diagnósticos e de avaliação
cardíaca, renal e hepática, descritos anteriormente, os pacientes foram enquadrados
dentro de um dos esquemas terapêuticos:
Antimoniato-N-metilglucamina: 20 mg/Sb+5/kg/dia, dose única diária, durante 30
dias, via endovenosa.
Pentamidina - 4 mg por Kg de peso, em dez aplicações, via IM profunda, com dois
dias de intervalo entre as doses.
3.6.5 Avaliação clínico-evolutiva dos pacientes
O seguimento clínico dos pacientes foi realizado por um médico e um
otorrinolaringologista nos dias 1, 30, 45, 60, 90 e 180, do protocolo observando-se
os seguintes aspectos:
3.6.5.1 Cicatrização total
Reepitelização total da lesão, sem presença de infiltrado úlceras ou edema na
mucosa 25, avaliado á rinoscopia.
3.6.5.2 Cicatrização parcial
Reepitelização parcial da área ulcerada, com diminuição, porém persistência, do
infiltrado das bordas da lesão associada a neoformação vascular e tecido de
granulação no fundo da lesão. A reepitelização parcial foi classificada segundo o
44
grau de redução da área acometida em percentuais de 1 a 99% em relação ao
aspecto inicial 25.
3.6.5.3 Persistência de atividade
Ausência de sinais de reepitelização, com persistência de bordas infiltradas e
úlceras, sem que ocorresse melhora clínica precedente ou casos de aumento
progressão das lesões da área acometida inicialmente, ou aparecimento de novas
lesões.
3.6.5.4 Definição de cura
O critério de avaliação da resposta terapêutica foi clínico, sendo definido como cura
a reepitelização total da lesão, sem presença de edema ou eritema, observado
durante o período de seguimento clínico de 180 dias após o tratamento
25
.
3.6.5.5 Definição de falha terapêutica
Qualquer outra evolução clínica da lesão diferente das definições de cura e melhora
clínica, foi considerada falha terapêutica. Incluindo-se, portanto, reativação de lesão
mucosa, aparecimento de nova lesão mucosa anatomicamente relacionada com LM
a(s) primária(s). Estes pacientes foram submetidos a uma nova série de tratamento
com a mesma medicação utilizada anteriormente, salvo na ocorrência de efeitos
colaterais considerados severos, conforme esquema recomendado pelo Ministério
da Saúde do Brasil 25.
3.7 Análise estatística dos resultados
Para a análise dos resultados criou-se um banco de dados, no Software Excel,
realizando-se testes estatísticos para determinação da significância nas diferenças
de médias e de proporções encontradas entre as variáveis estudadas. Foi analisada
a distribuição de variáveis categóricas como sexo, idade, número, localização, área
de lesões ulceradas e tempo de evolução da doença, utilizando-se o teste do Chiquadrado. Nos casos em que a freqüência esperada de um determinado evento foi
inferior a cinco utilizou-se o Teste exato de Fisher, utilizando o programa estatístico
SPSS 16 e Minitab 14.
3.8 Considerações éticas da pesquisa
Este projeto foi elaborado segundo as diretrizes éticas internacionais para pesquisas
45
Biomédicas envolvendo seres humanos (Resolução 196/96 CNS, 1996), e foi
submetido a julgamento e aprovado pela Comissão de Ética médica da FMTAM sob
protocolo de número 1809/2006-FMTAM e não houve conflitos de interesse neste
estudo.
3.9 Fontes de erros
Como a maioria dos pacientes portadores de LM residia em outros municípios ou em
áreas distantes dos centros urbanos, como BR 174, AM 010, tornou-se difícil de
prever e controlar a adesão ao tratamento e os seus resultados, dessa forma, foram
inclusos no estudo todos aqueles que concordaram com o mesmo, ainda que o
seguimento não pudesse se ter completado ou realizado integralmente na FMTAM.
Os dados de demográficos, aspectos clínicos e isolamento e caracterização de
cepas foram de grande valor no delineamento dos aspectos da doença na região.
46
4. RESULTADOS
Os resultados destes projetos estão descritos nos três artigos anexados a
seguir, seguindo a formatação do Programa de Pós-graduação em Medicina Tropical
da UEA/FMTAM.
47
4.1 Artigo 1
Mucosal Leishmaniasis – Epidemiological Aspects of 234 Cases Treated in a
Tertiary Reference Center in the Brazilian Amazon
Leishmaniose mucosa – Aspectos epidemiológicos de 234 casos atendidos em
um centro de referência na Amazônia Brasileira
Jorge Augusto de Oliveira Guerra1,2, Maria das Graças Vale Barbosa1,3,4,
Marcilene Gomes Paes1, Renato Teles de Sousa3, Pricila Gama da Silva3, Maria
José Silva3, Alexandre Ribera Macião3, Leila Inês de Aguiar Raposo da Câmara
Coelho1,3 & Luiz Carlos de Lima Ferreira1,2,3
1. Fundação de Medicina Tropical do Amazonas
2. Universidade do Estado do Amazonas
4. Universidade Federal do Amazonas
5. Centro Universitário Nilton Lins
Abstract:
A retrospective study including patients of the Brazilian Amazon region who were
diagnosed with ML ATL and treated in a tertiary reference center in the Amazon
between July 1992 to December 2008. 234 patients fulfilled the requirements for
inclusion in the study. There was a clear predominance of males, comprising 193
(82,5%) of cases. The mean age was 48 years; 186 (79.5%) of patients had
undertaken activities that are considered to place one at risk of acquiring ATL:
vegetal, animal or mineral extraction. Of the total, 193 (82,5%) presented a prior
history of cutaneous leishmaniasis (CL), the average time between the onset of CL
and the first symptoms of ML in 138 cases was 16.3 years. 156 cases (66,7%) were
located in municipalities that lie on the south bank of the Amazon river, which
suggests that Leishmania (Viannia) braziliensis was the principal etiological agent of
the cases.
Kay words: Leishmaniasis; Mucocutaneous; Leishmania braziliensis; Amazon region
48
Resumo
Estudo retrospectivo, incluindo pacientes da Amazônia brasileira diagnosticados com
Leishmaniose Tegumentar Americana (LTA), forma mucosa (LM), tratados em um
centro de referencia terciária do Amazonas entre julho de 1992 a dezembro de 2008.
234 pacientes preencheram os requisitos mínimos para inclusão no estudo.
Observou-se uma clara predominância do sexo masculino com 149 (81%) dos
casos. A média de idade foi de 48 anos; 142 (%) dos pacientes desenvolviam
atividades consideradas de risco pra adquirir LTA: 60 (32,6%) eram agricultores, 82
(44,6%) trabalhavam em extrativismo vegetal, animal ou mineral, dois (1,11%) eram
topógrafos de estradas. Do total, 155 (84,2%) apresentavam história de
Leishmaniose Cutânea (LC) anterior, a média de tempo entre o início da LC e o os
primeiros sintomas da LM, em 138 casos, foi de 16,3 anos. 156 casos (66,7%) eram
procedentes de municípios localizados na margem direita ou calha sul do rio
Amazonas, o que sugere que a Leishmania Viannia braziliensis foi o principal agente
etiológico dos casos.
Palvras
chave:
Leishmaniose;
Mucocutânea;
Leishmania
braziliensis;
RegiãoAmazônica
Introduction
American Tegumentary Leishmaniasis (ATL) is geographically distributed from the
southern United States to northern Argentina. Across the three American continents
(Western Hemisphere), eleven different Leishmania species are responsible for the
forms that are clinically recognizable, and present distinct epidemiological and
demographic patterns1. Between 1995 and 2005, 223,699 cases of ATL were
registered in Brazil, 37.9% of which originated in the Northern region, which
presented the largest number of overall cases 2. Marsden et al.
3
reported that the
prevalence of ML in Brazil lies between 3 and 5%. In the state of Amazonas, ML is
around 1.5%, less prevalent than in the rest of the country 4.
49
The dispersion of ATL throughout Brazil from the Amazonian region is believed to
have taken place during the rubber boom between 1880 and 1912, which attracted
thousands of workers from the Northeast. After this period, most returned to their
native lands or were attracted to the coffee boom in the Brazilian southeast.
However, the war effort of the 1940s reactivated rubber production in the Amazon,
and new waves of Northeasterners arrived in the region 5.
The increase in the incidence of leishmaniasis occurred due to various reasons: the
geographic expansion of human population, the construction of roads and the
creation of new agricultural centers. It brought into play other important factors such
as the movement of people to endemic regions as part of colonization projects, the
movement of laborers, miners and their companies, and military exercises in jungle
areas 6 7 8 9.
Within the Amazonian region ATL is primarily a zoonosis, with a transmission cycle
that occurs within sand flies and wild animals. In the majority of cases, humans are
infected due to environmental alterations, when they may place themselves within
the transmission cycle through penetration of the ecosystem
10 11 12
. In the
municipality of Manaus, in the state of Amazonas, ATL is predominantly caused by
Leishmania (Viannia) guyanensis, whose principal transmitting agent is Lutzomyia
umbratilis, followed in frequency by Lutzomyia anduzei
13 14 15 16
. The etiology of
mucosal leishmaniasis (ML) in South America is most related to Leishmania (V.)
braziliensis17.
In Brazil, cases of ML originate mainly in municipalities and states situated on the
right bank of the Amazon river when the river is considered a line of separation for
the geographic distribution of leishmaniasis species and their various vectors.
50
Manaus is situated on the left bank, a region in which Leishmania (Viannia)
guyanensis is predominant. In consonance with this theory, it is observed that the
incidence of ML is low in the municipality of Manaus 3 10.
Still, it is very difficult to accurately diagnosis ML. A vast majority of cases present
only with clinical-epidemiological criteria, many times only supported by additional
laboratorial criteria such as a Montenegro skin test (MST – delayed hyper-sensitivity
to leishmanial antigens), histopathological data or other characteristics, or detection
of parasites via direct exam. In deep mucosal lesions macrophages are seldom seen
and parasites are rare. Due to the scarcity of parasites in the mucosal tissues,
routine diagnosis is mostly done through clinical aspects and indirect immunologic
methods. The intradermal reaction of the Montenegro (skin test) indicates high
sensitivity to ML 18.
The aspects related to the occurrence of ML in the Brazilian Amazon have yet to be
clarified, though it has been asserted that there is a relationship between the
cutaneous lesion and the mucosal disease, principally in individuals who engage in
activities such as vegetal extraction in areas of pristine rainforest, particularly the
collection of latex and Brazil nuts 4 11 19.
Acquisition of data on the clinical, epidemiological, and laboratorial factors related to
the mucosal disease in the region is important in order to improve disease control
and diagnosis of ATL in the Manaus metropolitan area
3 20 21 22
. A majority of cases of
ML treated in Manaus have originated in distant regions, and the etiological agents of
these cases were never defined, leaving them open to epidemiological inferences.
The Amazonas Tropical Medicine Foundation (FMTAM), which treats approximately
51
50% of the cases of ATL in the state, has registered around 1,000 new cases each
year 9 12, and approximately 15 to 20 of them are ML.
The purpose of this paper is to discuss the appearance of ML in relation to previous
cutaneous lesions and how they were managed, in relation to aspects of the disease
such as geographic origin, source of patient livelihood, socio-cultural practices and
traditions and environmental factors, in patients diagnosed with ATL/ML and treated
at the FMTAM.
Material and Methods:
A retrospective study including patients of the Amazon region who were diagnosed
with ML ATL at FMTAM between July 1992 and June 2006 was conducted. The
inclusion criteria were: patients submitted for treatment of ML as recommended
under official guidelines of the Brazilian Government
23
with a clinical history and
physical exam suggesting a mucosal disease and/or a prior history of CL, and/or
originating of brazilian Amazonian region. We also took into account the fact that
some of them engaged in activities in jungle areas. The cases were confirmed by a
positive complementary exam such as MST, detection of Leishmania parasites
(direct
exam,
culture,
inoculation
in
hamsters),
serology
(indirect
immunofluorescence assays with titers ≥ 1:40) and histopathology – with the parasite
present, or histological alterations compatible with ML24. Most of the cases of ML
were confirmed by histological alterations due to the scarcity of parasites in the
mucosal tissues18.
Patients were classified according to a set of employment activities defined by
Cassano et al.25 in agriculture, animal raising and mineral extraction (hunters,
fishermen, forest workers, miners, oil workers, and mineral hunters). For this
52
analysis, priority was given to those who fell within the category of agricultural
livelihoods. In the category of risk exposure, the activities considered to be at-risk
were: those working directly in the rainforest environment, those involved in vegetal
extraction (principally rubber tappers or seringueiros, and others whose primary
occupation was the harvest of natural products, such as Brazil-nut collectors and
woodcutters), farmers, and inhabitants of endemic areas (both indigenous and nonindigenous populations) during the period of cutaneous lesions.
A case of cutaneous leishmaniasis was defined as an ulcerated lesion on the skin
hith positive examen (presence of amastigots forms) in the lesion, or which took more
than three months to heal and/or the presence of an atrophic scar suggestive of
ATL23.
All the information contained in documents (treatment records, exam results, etc...)
relating to the cases of ML treated in the aforementioned period were evaluated. The
data compiled in the clinical charts were registered in a single database, created with
the program EPI-Info, version 6.0, 2000 (Center for Disease Control. Epidemiology
Program Office. Atlanta, Georgia). This database provided the tools to perform the
necessary tests to determine the statistical significance of the data. For all the
analyses a significance value was set at 0.05.
This is a retrospective study in which the majority of the patients who were carriers of
ML resided in places far from urban centers, roads and/or other municipalities. In the
cases in which follow-up could not be completed, demographic data, along with
clinical and epidemiological aspects were considered. This study was developed
according to international ethical standards for biomedical research involving human
53
subjects, and was approved by the Medical Ethics Commission of the FMTAM
protocol number - 1809/2006-FMTAM.
Results:
Two hundred three four patients who had fulfilled the requirements for inclusion in the
study were selected. The estimate of ML patients treated in FMTAM was from 15 to
20 cases a year and the results of this study represent nearly 74% of the total cases
seen in this unit.
Among the cases, there was a clear predominance of males, comprising 192 (82.5%)
of the cases. The mean age was 47.6 years (ranging from 8 to 87 years), with the
greatest frequency (55 cases, or 23.5%) between 51 and 60 years of age (Figure 1).
Table 1 - Clinical epidemiological characteristics of 234 patients with mucosal
leishmaniasis treated in a Tertiary Reference Center in the Amazon
Characteristic or finding
Value
Gender, male
Age, years (median)
Procedence of the right or south bank (Amazon river)
193 (82.5%)
47.7 (8 to 87)
156 (66.7%)
High risk activities for acquiring ATL
Previous history of CL
Presence of cutaneous scar
Inadequate treatment of CL
Average time between CL and ML
186 (79.5%)
193 (82.5%)
193 (82.5%)
112 (63.6%)
16.7 (30 days to 74
years)
7.9 (30 days to 50
years)
Duration of disease, years (median)
With regards to lifestyles, 186 (79.5%) of patients engaged in activities extraction of
natural resources: 74 (39.8%) patients were agricultural workers, 112 (60.2%)
54
worked in extraction of natural resources (97 rubber tappers, six fishing’s, four
woodcutters and
five mineral-worker´s) 48 (21.5%) patient’s lived or worked in another activities on the
No. patients
transmission areas.
60
Male
50
Female
40
30
20
10
70
>
70
61
to
60
to
50
51
to
40
41
31
to
30
to
20
21
to
12
1
to
10
0
Age-group
Figure 1 – Mucosal leishmaniasis in a Tertiary Reference Unit in the Amazon.
Distribution of patients by gender and age-group.
Of the total, 193 (82.5%) had a prior history of CL (of which eight had the
concomitant form – mucocutaneous leishmaniasis- MCL), 41 (17.5) had no prior
history of CL. The average time between the onset of CL and the first symptoms of
ML, in 163 cases, was 16.7 years, ranging from 30 days to 74 years (Table 1). The
average duration of the mucosal disease, on 227 patients, was 7,9 years.
With regards to geographic location, 156 (66.7%) cases originated in the state of
Amazonas, 45 (19.2%) in Pará, 15 (6.4%) in Acre, 11 (4.7%) in Rondônia, and the
remainder from other Brazilian states of Amazon region. 156 cases (66.7%) were
55
located in municipalities that lie on the right or south bank of the Amazon river
(Figure 2).
Figure 2 - Mucosal leishmaniasis in a Tertiary Reference Unit in the Amazon.
Geographic distribution of cases period (1992 to 2008) according to municipality
source on Brazilian Amazonian region.
Discussion
Mucosal leishmaniasis represents a considerable public health problem in Latin
America. Widespread distribution in some countries and the severity of its morbidity
explain part of the concern for the healthcare system. Recent data have shown an
increase in its incidence in several Brazilian states and new areas 26 being affected
with each passing year. The questions concerning the occurrence of ML and its
56
diverse facets have been discussed by various authors24 27 28. The way of life of the
population in the Amazon region, in direct contact with an otherwise pristine
environment, particularly increases its exposure to the different vectors of ATL. This
fact results in infections, symptomatic or asymptomatic, which lead to ML. Various
activities have been associated with the risk of contracting ATL 29 30 31. In the same
way, activities related to vegetal extraction, mainly those related to rubber tapping as
observed in the cases discussed here, appear to represent an increasing risk factor.
This finding is in congruence with Marzochi and Marzochi 32 who refer to the
predominant areas of L. (V.) braziliensis, the large rubber tapping region of the
Amazon, which are confined almost exclusively to the tributary rivers on the right
(southern) bank of the Amazon river, as observed in this study with 73.4% of cases
analyzed coming from this region.
In the Amazon, ribeirinhos (people living near the river) and indigenous people use
different products to feed themselves. They get their food mainly from hunting,
fishing, resource extraction and agriculture. The abundance or scarcity of these
resources in a certain region is an important factor that determines the search for
new economic activities. In this way, even when agriculture is the basic subsistence
activity, other initiatives, such as vegetal extraction become fundamental strategies in
the survival of these populations33.
In Manaus, a description given by Matta in 1910 34, correlates the incidence of
leishmaniasis with the harvesting of Brazil nuts on the Trombetas river in the state of
Pará and indicates the origin of such cases in the Purus region of the state of Acre.
The findings of the present study, with 156 cases who proceedings of municipalities
that lie on the right or south bank of the Amazon river, which suggests that L. (V.)
braziliensis was the principal etiological agent of the cases and confirm the
57
conclusions of Paes et al. and Sousa4 19, who observed 1.4% of cases of ML patients
who came from areas within the right side of the Amazon river and engaged in
vegetal extraction in the rainforest.
Unlike the outbreaks of CL linked to the unplanned settlements close to areas
considered to be pristine rainforest12 35, ML in the Amazon region appears to be more
closely related to occupational activities of the patients in forest regions, principally
those linked to vegetal extraction, as was observed in the majority of cases described
herein, in agreement with previous studies3 4 19 32.
Most of the activities carried out by our patients put them into a situation considered
to be at-risk for primary infection (CL) or development of mucosal disease (ML) years
later. Studies involving half-caste population in the Amazon region have
demonstrated that activities in forested areas are associated with different
professional categories, agriculture being the most important of them. On the one
hand, they call themselves or are referred to as “agro workers”, but on the other, they
take part in other activities inside jungle areas year-round, as observed in our
patients in this study. These activities include hunting, fishing, wood-extraction,
collecting material for domestic use (fences, firewood, palm leaves for building, etc.)
and collecting wild fruits36. Regarding rubber tappers (seringueiros), it is possible that
the geographic proximity and time spent in contact with rubber trees facilitate
transmission due to the presence of sand flies on tree trunks, as was observed in
other studies carried out in the Amazon region10 11.
In the rest of Brazil, however, ML is predominantly caused by L. (V.) braziliensis24 26
27 28 29 37 38
, whereas in the state of Amazonas both L. (V.) braziliensis and L. (V.)
guyanensis are found39. Human infections are observed in people who undertake
58
activities related to forest extraction, such as deforestation, road construction, oil
drilling, and scientific expeditions22.
In most endemic areas, 1–10% of CL infections result in mucosal leishmaniasis 1-5
years after CL healed3 18 35. In this study, the median gap between occurrence of LC
and ML was 16.7 years.
In the cases described herein, the predominance of subjects over 40 years of age, as
indicated by the average age of 47,7 years, has also been observed in studies
involving ML29. These data differ from those observed in the cutaneous forms of the
disease, for which the predominant age group is between 20 and 40 years28.
Various studies have demonstrated the predominance of the male sex and the
incidence of ATL, including ML10 11 28. Environmental factors predispose men to the
vectors within forested areas or in other areas of transmission and in this study
82,5% of patients were male.
In a study carried out in Peru, Lucas et al.40 observed that, of 351 people isolated
with Leishmania, 279 had Leishmania (Viannia) braziliensis, with 69% of these
patients being carriers of MCL. Therefore, the Peruvian reality shows that a greater
number of cases come from areas with difficult access, mainly due to the forest or
lack of roads. This fact represents an obstacle to the diagnosis and adequate
treatment of many people with leishmaniasis.
A few patients within the state of Amazonas ended up travelling for more than 15
days by boat to reach the capital, Manaus. Once they reached Manaus, they needed
to stay there enough time to get an appointment and to allow time to confirm
diagnosis and receive treatment. Unfortunately most of them remained only for a
short period of time, because they did not have the financial resources to stay longer
59
in the city. A large part of these patients only sought out medical attention in the
capital after many years with the disease without having received a definitive
diagnosis or specific treatment.
The findings are corroborated by several authors3
27 30 38
, who suggest that a
contributing factor to the development of the mucosal disease could be inadequate or
irregular treatment of the primary cutaneous lesions. These findings are similar to
those in this study which showed that, of the 192 patients who had CL, 112 (63.5%),
had a history of inadequate treatment of their cutaneous lesions.
Our research indicates that patients required a long time to have their cutaneous
lesions healed, in most of cases more than six mouths. Multiple or extensive
cutaneous lesions of long duration are more frequently associated with mucosal
complications, determining ML29.
Epidemiological data suggest that MCL occurs principally as a result of inadequate
treatment or irregular dosages of the medication for primary cutaneous lesions 3 29 37.
Apart from that, individual characteristics should be related to an hypersensitivity to
other Leishmanial antigens in the regulation of immunological response41. Mucosal
lesions tend to form years after the healing and scarring of the primary lesion.
Although the evolution is usually slow, the necrosis of mucosal tissue tends to be
progressive and difficult to cure15.
In the Brazilian Amazon, where the mucosal disease tends to occur in patients with a
history of a previously untreated, or inadequately treated, cutaneous lesion, various
patients have presented with simultaneous cutaneous and mucosal lesions. Such
cases have L. (V.) braziliensis as their etiological agent, which is recognized as the
60
most important etiological agent of Mucocutaneous Leishmaniasis (MCL) in the
western hemisphere10 30 37.
With regards to laboratorial diagnosis, in the cases studied by Camera et al. 17, L. (V.)
braziliensis DNA was encountered in the blood of 26% of those individuals who lived
in areas with endemic ATL; these authors put forward the hypothesis that the
formation of new cutaneous lesions or the mucosal disease could be the result of the
endogenous reactivation of the parasite, echoing the hypothesis already proposed by
Saravia et al.42. The mechanisms that are responsible for these reactivations are still
unknown. However, various factors could influence this reactivation, including the
patient’s genetic background and/or the state of their immune system, systemic
conditions (such as diabetes or hypertension), local trauma, immunosuppressive
treatment or co-infection with HIV17 27 29.
In this study, a important relationship between the mucosal form of the disease and a
prior history of ATL was observed, as noted by several authors3 26 28 29 35.
In accordance with the data analyzed, it can be observed that despite the low
prevalence of the mucosal disease in the region, ML is amply distributed in the
Amazon region35. Thus, it is quite probable that distance, accessibility and even the
notification of cases, inhibit the actual spread of the disease within the region. This
fact also contributes to the evolution of this clinical form, because the time for the
development of LC has an important relation with the appearance of ML
3 17 26 28 29
.
The official data do not reflect the reality either, due to the lack of notification or
information about the outcome of such cases.
It is important to emphasize that the level of difficulty involved in the diagnosis of
MCL impedes its incorporation into the routine of the majority of healthcare centers,
61
and for this reason, notification data and studies of epidemiological variables are
extremely relevant.
The complexity and severity of the mucosal disease, its chronic character, its
tendency to relapse, the difficulty in obtaining a correct diagnosis, and the limited
access to treatment are some of the characteristics that hinder the understanding of
the clinical and epidemiological aspects of these cases, reflecting the challenges
facing these populations and their healthcare services.
For these reasons, studies that are simpler, cheaper, and more effective are
necessary to trace the endemic profiles which could clarify the demands upon and
actions of the public health services. Therein lies the importance of this study.
Based on these results, we can infer firstly that the exposure of individuals to
activities mainly in areas of dense jungle, in the regions on the right side of the
Amazon river leaves them exposed to LTA vectors; and secondly, that the difficulties
that they face to receive diagnosis and subsequent treatment of the cutaneous
lesions contribute to the appearance of the mucosal form.
We can state, based on this research, that MCL is also a great challenge for the
public health of the populations that inhabit the Amazon and which manifests itself in
the very livelihood of these populations, who maintain a high degree of intimacy with
the rainforest, from which they derive their sustenance. This gives rise to, in the
majority of cases, the formation of a cutaneous lesion which is not adequately treated
because of the lack of knowledge of its complications, which itself is the result of a
lack of access to a valid diagnosis and appropriate treatment, eventually manifesting
itself, often years later, as the mucosal disease.
62
In sum, we emphasize that the findings of this study ought to be complemented by
others involving populations with similar characteristics, due to the magnitude of this
problem in the Amazonian population.
References
1. World Health Organization. Control of the leishmaniases. Technical report series 793. Geneva, 1990.
2. MS B. Indicadores de morbidade e fatores de risco. Leishmaniose tegumentar
http://tabnet.datasus.gov.br/ 2008 (accessed on 10/Oct/2008).
3. Marsden PD. Mucosal leishmaniasis ("espundia" Escomel, 1911). Transactions of
Royal Society of Tropical Medicine and Hygiene 80(6):859-876, 1986.
4. Paes MG, Barros M, Toledo LM. Considerações sobre a produção da
Leishmaniose tegumentar americana no Estado do Amazonas. In: Iñiguez-Rojas LB,
Toledo LM (organizadores). Espaço e doença: Um olhar sobre o Amazonas 1ª.
edição, Editora Fiocruz, Rio de Janeiro, p.105-113, 1998.
5. Altamirano-Enciso AJ, Marzochi MC, Moreira JS, Schubach AO, Marzochi KB.
Sobre a origem e dispersão das leishmanioses cutânea e mucosa com base em
fontes históricas pré e pós-colombianas. História Ciências e Saúde Manguinhos
10(3):852-882, 2003.
6. Barros MLB Paes MG, Talhari S. Leishmaniose cultaneo-mucosa na Amazônia –
Estudo dos casos diagnosticados em Manaus no período de 1976 a 1980. Anais
Brasileiros de Dermatologia 57:153-154, 1982.
63
7. Talhari S AJ, Cunha MGS, Naiff RD, Freitas RA, Barrett T. Leishmaniose no
Estado do Amazonas- Aspectos Epidemiológicos Clínicos e Terapêuticos. Anais
Brasileiros de Dermatologia 63:433-438, 1988.
8. Handman E. Leishmaniasis: current status of vaccine development. Clinical and
Microbiology Reviews 14(2):229-243, 2001.
9. Guerra JAO, Talhari S, Paes MG, Garrido M, Talhari JM. Aspectos diagnósticos
da Leishmaniose Tegumentar Americana em militares simultaneamente expostos á
infecção na Amazônia. Revista da Sociedade Brasileira de Medicina Tropical
36(6):587-590, 2003.
10. Lainson R. The American leishmaniases: some observations on their ecology
and epidemiology. Transactions of Royal Society of Tropical Medicine and Hygiene
77(5):569-596, 1983.
11. Lainson R. Our present knowledge of the ecology and control of leishmaniasis in
the Amazon Region of Brazil. Revista da Sociedade Brasileira de Medicina Tropical
18:47-56, 1985.
12. Guerra JA, Ribeiro JA, Coelho LI, Barbosa MG, Paes MG. Epidemiologia da
leishmaniose tegumentar na Comunidade São João, Manaus, Amazonas, Brasil.
Cadernos de Saúde Pública 22(11):2319-2327, 2006.
13. Arias JR FR. On the vectores of cutaneous leishmaniasis in the Central Amazon
of Brazil. Acta Amazonica 7:507-527, 1977.
14. Grimaldi G, Jr., Tesh RB, McMahon-Pratt D. A review of the geographic
distribution and epidemiology of leishmaniasis in the New World. American Journal of
Tropical Medicine and Hygiene 41(6):687-725, 1989.
64
15. Lainson R, Shaw J. New world leishmaniasis The neotropical Leishmania
species. In: Feg Cox, JP Kreier, D Wakelen (eds), Topley & Wilson's Microbiology
and Microbial Infections, Arnold, London, Auckland, Sydney, p. 241-266, 1998.
16. Paes M. Estudo de quatro espécies de Lutzomyia França, 1924 (Diptera,
Psychodidae) em área endêmica de Leishmaniose Tegumentar Americana na
periferia de Manaus. Disertação de Mestrado. Fundação Universidade do
Amazonas, Manaus, AM, 1991.
17. Camera PA Junger J, Pires FESS, Mattos M, Oliveira-Neto MP, Fernandes O,
Pirmez C. Haematogenous dissemination of Leishmania (Viannia) braziliensis in
human American tegumentary leishmaniasis. Transactions of the Royal Society of
Tropical Medicine and Hygiene 100(12):1112-1117, 2006.
18 Pedras MJ OM, Castro M, Passos VMA, Rabello A. Antibody subclass profile
against Leishmania braziliensis and Leishmania amazonensis in the diagnosis and
follow-up of mucosal leishmaniasis. Diagnostic Microbiology and Infectious Diseases
47:477-485, 2003.
19. Sousa R. Estudo das seqüelas em otorrinolaringologia de pacientes clinicamente
curados para leishmaniose cutâneo-mucosa da Amazônia. Dissertação de mestrado,
Universidade Federal de São Paulo, São Paulo, SP, 2001.
20. Guerra JAO PM, Coelho LIARC, Barros MLB, Fé NF, Barbosa MGV, Guerra
MVF Estudo de dois anos com animais reservatórios em área de ocorrência de
leishmaniose tegumentar americana humana em bairro de urbanização antiga na
cidade de Manaus-AM, Brasil. Acta Amazonica 37(1):33-37, 2007.
65
21. Romero GAS Guerra MVF, Paes MG, Macêdo VO. Comparison of Cutaneous
Leishmaniasis due to Leishmania (Viannia) braziliensis and Leishmania (Viannia)
guyanensis in Brazil: Clinical findings and diagnostic approach. Clinical of Infectious
Diseases 32:1304-1312, 2001.
22. Lainson R, Shaw JJ. Evolution, classification and geographical distribution. In:
Peters, W, Killick-Kendrick R (ed) The Leishmaniasis in biology and medicine,
London, Academic Press, 1, p. 1-121, 1987.
23. Brasil MS. Manual de controle da leishmaniose tegumentar americana.
Fundação Nacional de Saúde 2000.
24. Castellucci L, Cheng LH, Araujo C, Guimarães LH, Lessa H, Machado P,
Almeida MF, Oliveira A, Ko A, Johnson WD, Wilson ME, Carvalho EM, De Jesus AR.
Familial aggregation of mucosal leishmaniasis in northeast Brazil. American Journal
of Tropical Medicine and Hygiene 73(1):69-73, 2005.
25. Cassano C, de Medeiros Frias LA, Valente JG. Classification by occupation of
AIDS cases in Brazil - 1995. Cadernos de Saúde Pública 16(1):53-64, 2000.
26. Amato VS, Tuon FF, Bacha HA, Neto VA, Nicodemo AC. Mucosal leishmaniasis.
Current scenario and prospects for treatment. Acta Tropica 105(1):1-9, 2008.
27. Amato VS, Tuon FF, Siqueira AM, Nicodemo AC, Neto VA. Treatment of
mucosal leishmaniasis in Latin America: systematic review. American Journal of
Tropical Medicine and Hygiene 77(2):266-274, 2007.
28. Marsden PD Llanos-Cuentas EA, Lago EL, Cuba CAC, Barreto AC, Costa JM,
Jones TC. Human mucocutaneous leishmaniasis in Três Braços, Bahia, Brazil. An
area of Leishmania braziliensis braziliensis transmission. III. Mucosal disease:
66
presentation and initial evolution. Revista da Sociedade Brasileira de Medicina
Tropical 17:179-186, 1984.
29. Machado-Coelho GL, Caiaffa WT, Genaro O, Magalhaes PA, Mayrink W. Risk
factors for mucosal manifestation of American cutaneous leishmaniasis. Transactions
of Royal Society of Tropical Medicine and Hygiene 99(1):55-61, 2005.
30. Silveira FT, Lainson R, Corbett CE. Clinical and immunopathological spectrum of
American cutaneous leishmaniasis with special reference to the disease in
Amazonian Brazil: a review. Memórias do Instituto Oswaldo Cruz 99(3):239-251
2004.
31. Guerra JA, Barbosa MG, Loureiro AC, Coelho CP, Rosa GG, Coelho LI.
Leishmaniose tegumentar americana em crianças: aspectos epidemiológicos de
casos atendidos em Manaus, Amazonas, Brasil. Cadernos de Saúde Pública
23(9):2215-2223. 2007.
32. Marzochi MC, Marzochi KB. Tegumentary and visceral leishmaniases in Brazil:
emerging anthropozoonosis and possibilities for their control. Cadernos de Saúde
Pública 10(2):359-375, 1994.
33. Guerra JA, Barros MLB, Fé NF, Guerra MV, Castellon E, Paes MG, et al.
Leishmaniose visceral entre índios no Estado de Roraima, Brasil. Aspectos
clínicoepidemiológicos de casos observados no período de 1989 a 1993. Revista da
Sociedade Brasileira de Medicina Tropical 37(4):305-311, 2004.
34. Matta A. Leishmaniose trópica. Revista Médica de São Paulo 440-441, 1910.
35. Silveira FT, Duarte E, Farias ECF, Ikeda CS, Lopes AP, Chagas EJ, Teixeira LM,
Ishikawa
EAY.
Leishmaniose
mucosa
na
Amazônia
Brasileira:
Avaliação
67
retrospectiva de aspectos clínicos e epidemiológicos da doença, com ênfase ao
estado do Pará. In: XXXV Congresso da Sociedade Brasileira de medicina Tropical,
Guarapari p. 9, 1999.
36. Franco JLA. As Sociedades Caboclas na Amazônia: Tradição e Modernidade
Boletim do Museu Paraense Emílio Goeldi Ciências Humanas 3(2):255-258, 2008.
37. Reithinger R, Dujardin JC, Louzir H, Pirmez C, Alexander B, Brooker S.
Cutaneous leishmaniasis. Lancet Infectous Diseases 7(9):581-596, 2007.
38. Marsden P. Pentavalent Antimonials: Old Drug for New Diseases. Revista da
Sociedade Brasileira de Medicina Tropical 18(3):187-198, 1985.
39. Naiff RD, Talhari S, Barrett TV. Isolation of Leishmania guyanensis from lesions
of the nasal mucosa. Memórias do Instituto Oswaldo Cruz 83(4):529-530, 1988.
40. Lucas CM, Franke ED, Cachay MI, Tejada A, Cruz ME, Kreutzer RD, CM
Kreutzer RD, Barker DC, McCann SH, Watts DM. Geographic distribution and clinical
description of leishmaniasis cases in Peru. American Journal of Tropical Medicine
and Hygiene 59(2):312-37, 1998.
41. Da-Cruz AM, Bittar R, Mattos M, Oliveira-Neto MP, Nogueira R, Pinho-Ribeiro V,
Azeredo-Coutinho RB, Coutinho SG. T-cell-mediated immune responses in patients
with cutaneous or mucosal leishmaniasis: long-term evaluation after therapy. Clinical
and Diagnostic Laboratory Immunology 9(2):251-256, 2002.
42. Saravia NG, Weigle K, Segura I, Giannini SH, Pacheco R, Labrada LA,
Goncalves A. Recurrent lesions in human Leishmania braziliensis infectionreactivation or reinfection? Lancet 18;336(8712):398-402, 1990.
68
4.2 Artigo 2 – Publicado na Revista Plos Neglected
A Description of 46 cases of mucosal leishmaniasis associated with
Leishmania (Viannia) braziliensis and Leishmania (Viannia) guyanensis in the
Brazilian Amazon
Authors:
Jorge Augusto de Oliveira Guerra1,2; Suzane Ribeiro Prestes2, Henrique M. C.
Silveira1,3, Leila Inês de A.C.R. Coelho1,4, Pricila Gama4, Aristoteles Moura4, Valdir
Amato5 Maria das Graças Vale Barbosa1,2, Luiz Carlos de Lima Ferreira1,4,
1. Tropical Medicine Foundation of Amazonas.
2. University of the State of Amazonas.
3. Center for Malaria and other Tropical Diseases, UEI Malaria, Institute of
Hygiene and Tropical Medicine of Lisboa, New University of Lisboa.
4. Federal University of Amazonas.
5. University of São Paulo.
Study conducted as part of the doctoral thesis Student Jorge Augusto de Oliveira
Guerra, as a prerequisite for obtaining a doctorate in tropical and infectious diseases
at the University of the State of Amazonas.
Abstract
Background:
Leishmania (Viannia) braziliensis is a parasite recognized as the most important
etiologic agent of mucotaneous leishmaniasis (MCL) in the New World. In Amazonia,
seven different species of Leishmania, etiologic agents of human Cutaneous
Leishmaniasis, have been described. Isolated cases of mucosal leishmaniasis (ML)
have been described for several different species of Leishmania: (L. (V.)
panamensis, L. (V.) guyanensis and L. (L.) amazonensis)
69
Methodology
This paper describes 46 cases of ML and their geographical origin, 30 for Leishmania
(Viannia) braziliensis and 16 for Leishmania (Viannia) guyanensis, that were
characterized by PCR of tissues taken from mucosal biopsies of Amazonian patients
who were diagnosed with ML and treated in a Tertiary Care Unit, in the city of
Manaus, Amazonas State, Brazil.
Results
The reported 46 cases of ML caused by L. (V.) guyanensis, and L. (V.) braziliensis
and their geographical origin. This is the first record of ML cases in 16 different
municipalities in the state of the Amazonas and of simultaneous detection of both
species in 4 municipalities of this state. It is also the first record of LM by L. (V.)
guyanensis in the states of Pará, Acre, and Rondonia and cases of LM by L. (V.)
braziliensis in the state of Rondônia.
Conclusions/Significance
L. (V.) braziliensis, is the predominant species that causes ML in the Amazon region.
However, contrary to previous studies, L. (V.) guyanensis is also as significant
causative agent of ML in the region. The clinical and epidemiological expression of
ML in the Manaus region is similar to the rest of the country although the majority of
ML cases are found south of the Amazon River.
Introduction
Mucosal Leishmaniasis (ML) in the Americas is mainly associated with L. (V.)
braziliensis, the specie recognized as the most important etiologic agent of the
70
disease. L (V.) panamensis, L (V.) guyanensis and L. (L.) amazonensis have also
been associated with ML, but very few cases of ML have been associated with L (V.)
guyanensis [1,2,3,4,5].
Marzochi and Marzochi (6) [6], based on the epidemiological and geographical
distribution of L. (V.) braziliensis in different ecosystems, suggested that human
Leishmaniasis emerged in the western Amazon, in particular south of the Amazon
River where L. (V.) braziliensis is predominant. In eastern Amazonia, the mucosal
disease is the result of patients with a previous history of skin lesions that were not
treated properly [7].
According to Alvar et al. [8] Leishmaniasis is a neglected tropical disease that has a
strong link with poverty; its burden falls disproportionately on the poorest segments of
the global population in endemic areas. Increased infection risk is mediated by poor
housing conditions, environmental factors, lack of personal protective measures,
economically driven migration and contact to the vectors. Lack of healthcare access
causes delays in appropriate diagnosis and treatment and accentuates leishmaniasis
morbidity and mortality. ML is an important public health problem and neglected
disease in the Amazon.
Early diagnosis and access to treatment of cutaneous lesions are crucial to avoid the
evolution to the ML, or complications of this form of the disease, given its complexity
and severity.
71
In the state of Amazonas, the majority of cases of ML are seen in patients from areas
south of the Amazon River, who typically work in areas of primary rain forest,
involved in activities related to forest product extraction [9,10].
In an attempt to improve diagnosis, molecular techniques like PCR have been
developed for the detection of Leishmania parasites in clinical samples [11,12],
however the low amount of DNA found in paraffin tissue hinders the characterization
of species [13]. The identification of parasite species, today most commonly from
genetic analyses, can directly contribute to our understanding of the epidemiology of
Leishmaniasis [14,15,16,17]. The aim of this study is to describe the distribution of
Leishmania species in Amazonian patients with ML that were treated at the Tropical
Medicine Foundation of Amazonas (FMT-AM), a Tertiary Care Unit, while taking into
consideration the geographic origin of each case.
Materials and methods:
The study population consists of patients with ML who were diagnosed and treated at
the FMT-AM in the city of Manaus, Amazonas State, Brazil, from July 1992 to
December 2006. All patients came from the Brazilian Amazon. This region covers an
area of 5,000,000 km2, 59% of Brazil’s territory, and contains over 775 municipalities
in the states of Amazonas, Amapá, Mato Grosso, Western Maranhão, Pará,
Rondônia, Roraima, Acre and Tocantins. The total population for the region has been
estimated at 20.3 million people - 68.9% of whom reside in urban areas while the
remaining 31.1% reside in rural areas [18].
DNA Preparation
72
The biopsied tissues were preserved in three different media: a) Formalin-fixed
paraffin-embedded, b) Imprint tissue on filter paper, or c) in buffer L6 [19]. The
methodology for the extraction of DNA varied according to preservation methodology.
Embedded in paraffin: We performed 12 cuts of 20 µm in each block of embedded
tissue, using a disposable blade for each block, and the samples were deposited in
1.5 mL Ependorf tubes. The deparafinization was done with xilol and the DNA
extraction using the protocol of the Dneasy Blood & Tissue Kit (Quiagen).
Filter paper: The material from the filter paper was cut and placed in sterile ependorff
tubes. DNA was extracted using the "blood spot" protocol of PureLink Genomic DNA
kit (Invitrogen).
Biopsies solution L6: Excess solution was removed by centrifugation at 14.000rpm.
The supernatant was discarded and the tissue was homogenized using individual
disposable test tubes (Anachem). The tissue was then processed using the DNeasy
Blood & Tissue Kit (Qiagen) as described by the manufacturer.
DNA amplification by PCR
The presence of Leishmania DNA in tissue samples was detected by PCR using
genus-specific primer 13a and 13b [20] according to the protocol described by Reale
et al. [21].
In all tissue samples that were positive for Leishmania, PCR-RPLF was used to
identify each species present in the biopsy. PCR was performed as described by
73
Marfurt et al. [22]. DNA was amplified using primers Fme and Rme. Ten ul of the
PCR products were digested with 1U HaeIII and 1U NcoI (New England Biolabs) at
37 ° C for 2 hours and 30 min. The resulting restriction fragments were separated on
a 2.5% agarose gel . The size of the fragments was estimated by comparison with a
100bp DNA ladder and compared with positive controls for L. (V.) braziliensis and L.
(V.) guyanensis.
As positive controls for DNA extraction, all DNA samples that did not amplified
Leishmania-PCR using 13a and 13b primers, were subjected to PCR targeting 147bp
fragments of human actin gene. The sequence of primer used was Hu_actin1_fwd
5'-CTGTGGCATCCACGAAACTA-3 'and Hu_actin1_rev
5'-AGGGCAGTGATCTCCTTCTG-3'. The PCR reaction was performed in a volume
of 25µl 0.3µl containing each primer, 3.5, µgCl2, 0.2 mm dNTPs and 1U Platinum
Taq DNA Polymerase (Invitrogen). The PCR conditions were 5 min at 94 ° C followed
by 40 cycles of 35s at 94 ° C, 30s at 55 º C, and 30s at 70 º C.
This study was prepared in accordance with international ethical guidelines for
biomedical research involving human subjects (Resolution CNS 196/96, 1996), and it
was approved by the Ethics Committee of FMTAM under protocol number
1809/2006-FMTAM. The authors are not part of any associations or commercial
relationships that might represent conflicts of interest in the writing of this study.
Results:
The reported 46 cases of ML caused by L. (V.) guyanensis, and L. (V.) braziliensis
and their geographical origin are depicted in Figure 1. This is the first record of ML
74
cases in 16 different municipalities in the state of the Amazonas and of simultaneous
detection of both species in 4 municipalities of this state. It is also the first record of
LM by L. (V.) guyanensis in the states of Pará, Acre, and Rondonia and cases of LM
by L. (V.) braziliensis in the state of Rondônia. Thirty eight patients had previous
history of LC. Thirteen patients were from municipalities located north of the Amazon
River and 33 patients came from south of the river.
Among the 46 patients, 38 were male and 8 were female. The average period
mediating skin to mucosal disease was 17.9 years (range: 4 months to 74 years) and
the average duration of the mucosal disease was 8.3 years (30 days to 39 years).
Two of the female patients had concomitant injuries (CL / ML). Both were pregnant at
the time of the CL and therefore did not treat their skin lesions. The average age of
the study population was 47.5 years (range: 16 to 80) (Table 1).
The PCR, performed on samples of 143 patients, was positive in 56 individuals, but
in 10 samples it was not possible to characterize the species, probably due to the low
amount of DNA or a consequence of formalin fixation and paraffin embedded tissues.
Nine patients received adequate treatment of their LC while 29 had inadequate or
irregular treatment. One patient had only oral involvement, 45 had nasal involvement,
eight of which were associated with oral forms., 20 patients had ulcerated or
granulomatous lesions, 20 had perforation, one of which was in the palate, and six
patients had infiltrated. The most frequent complaints were nasal obstruction (33/46),
removal of crusts (28/46), epistaxis (18/46), rhinorrhea (16/46), and pruritus (16/46).
75
Figure 1 - Spatial distribution of ML cases by species according to the municipality of
origin.
The Montenegro skin test (MST) was positive in 41 cases, negative in one, and not
performed in the remaining four. Direct examination was positive in six cases,
negative in 33, and not performed in six. The histopathological exam of the mucosal
tissues was compatible with LM in 31 cases, positive in three, and inconclusive in six.
Chronic rhinitis was seen in three patients and absent in two. Serology was positive
in 23 of 41 samples.
Discussion:
Leishmaniasis is a disease that is increasing in the Northern Hemisphere as a result
of tourism and armed conflict in tropical regions [23,24]. Cases of ML has been
76
associated with multiple species [2,3,4], but, our record of cases of ML caused by L.
(V.) guyanensis is unusual. It was believed that the occurrence ML caused by L. (V.)
guyanensis was extremely low, with only isolated cases having been described. The
past low infection rates described in the literature is likely the result of scarce studies
on ML in the regions where L. guaynensis is endemic.
The geographic distribution of american tegumentary leishmaniasis cases indicate
that L. (V.) braziliensis is the predominant species south of the Amazon River [25]
while studies in the Manaus region (north of the Amazon River) [19,26] found that L.
(V.) guyanensis is the most common species. In this study, 32 (71.1%) of the ML
cases are from the south of the River: 22 (68.7%) were caused by L. (V.) braziliensis
and 10 (31.3%) by L. (V.) guyanensis. North of the Amazon River 13 (28.9%)
patients were infected: 8 (61.5%) with L. (V.) braziliensis and 5 (38.5%) with L. (V.)
guyanensis (Figure 1) which were mainly found in the Manaus area. This data
suggests that no major differences exist between north and south of the river
distribution of species causing ML.
The association between mucosal disease and previous skin lesions is widely
accepted, as both forms can be caused by a single species [27,28], and indeed in the
46 cases described here 37 had previous history of CL. In the eastern Brazilian
Amazon, the mucosal disease is the result of patients with a history of previous skin
lesions that were untreated or treated inappropriately and which were often caused
by L. (V.) braziliensis [5,27]. The data from this study on patient age and the
relationship between a previous history of LC are in support of previous findings
[10,29].
77
The current study extends this information and contributes new data on the
distribution of L. (V.) braziliensis in western Amazonia, providing the first record of
this species in 16 municipalities of Amazonas state and an additional 12
municipalities in three other states in the region: Acre - 1 case, Rondonia - 5 cases,
and Pará - 7 cases. It is also very important to emphasize the record of 16 ML cases
caused by L. (V.) guyanensis in six different municipalities of Amazonas state, in
three municipalities of Pará, one of Rondônia and one of Acre (Figure 1).
The prevalence in males in our study population was also observed by other authors
[30,31]. The average time of 17.6 years between the occurrence of LC and the
appearance of LM (with one patient having a 74-yer gap between CL and ML)
recorded in this study is also in agreement with previous findings [32,33] on the
persistence of this parasite in the host’s body of the host and the subsequent
triggering the mucosal disease.
From the clinical point of view, we would like to draw the reader’s attention to the
large number of cases - 21 (45.7%) - with nasal perforation, which supports previous
findings [28] that have demonstrated the potential of this species to cause more
severe disease.
In summary, based on the results of this study L. (V.) braziliensis, which caused 2/3
of the studied cases, is the predominant species that causes ML in the Amazon
region. However, contrary to previous studies, L. (V.) guyanensis is also as
significant causative agent of ML in the region. The clinical and epidemiological
78
expression of ML in the Manaus region is similar to the rest of the country although
the majority of ML cases are found south of the Amazon River. ML infections are
much more common in men than in women, and men also tend to develop more
severe forms of disease with large numbers of perforation and involvement outside of
the nasal cavity.
Author Contributions
Conceived and designed the experiments: HMCS SPR LIARC. Performed the
experiments: SPR HMCS. Analyzed the data: MGVB PG AM LCLF. Contributed
reagents/materials/analysis tools: JAOG LIARC MGVB LCLF. Wrote the paper:
JAOG LCLF MGVB.
References
1. Amato VS, Tuon FF, Siqueira AM, Nicodemo AC, Neto VA (2007) Treatment of
mucosal leishmaniasis in Latin America: systematic review. Am J Trop Med
Hyg 77: 266-274.
2. Barral A, Pedral-Sampaio D, Grimaldi Junior G, Momen H, McMahon-Pratt D, et al.
(1991) Leishmaniasis in Bahia, Brazil: evidence that Leishmania amazonensis
produces a wide spectrum of clinical disease. Am J Trop Med Hyg 44: 536546.
3. Naiff RD, Talhari S, Barrett TV (1988) Isolation of Leishmania guyanensis from
lesions of the nasal mucosa. Mem Inst Oswaldo Cruz 83: 529-530.
79
4. Osorio LE, Castillo CM, Ochoa MT (1998) Mucosal leishmaniasis due to
Leishmania (Viannia) panamensis in Colombia: clinical characteristics. Am J
Trop Med Hyg 59: 49-52.
5. Silveira FT, Lainson R, Corbett CE (2004) Clinical and immunopathological
spectrum of American cutaneous leishmaniasis with special reference to the
disease in Amazonian Brazil: a review. Mem Inst Oswaldo Cruz 99: 239-251.
6. Marzochi MC, Marzochi KB (1994) Tegumentary and visceral leishmaniases in
Brazil: emerging anthropozoonosis and possibilities for their control. Cad
Saude Publica 10 Suppl 2: 359-375.
7. Lainson R (1985) Our present knowledge of the ecology and control of
leishmaniasis in the Amazon Region of Brazil. Rev Soc Bras Med Trop 18: 4756.
8. Alvar J, Yactayo S, Bern C (2006) Leishmaniasis and poverty. Trends Parasitol 22:
552-557.
9. Silva ALd (2008) Sociedades caboclas amazônicas: modernidade e invisibilidade.
Ambiente & sociedade 11: 443-446.
10. Paes MG, Barros MLB, Toledo LM (1998) Considerações sobre a produção da
leishmaniose tegumentar americana no Estado do Amazonas. In: IñiguezRojas LB, Toledo LM, editors. Espaço e doença: um olhar sobre o Amazonas.
Rio de Janeiro: Editora Fiocruz. pp. 105-113.
11. Faber WR, Oskam L, van Gool T, Kroon NC, Knegt-Junk KJ, et al. (2003) Value
of diagnostic techniques for cutaneous leishmaniasis. J Am Acad Dermatol 49:
70-74.
80
12. Mimori T, Sasaki J, Nakata M, Gomez EA, Uezato H, et al. (1998) Rapid
identification of Leishmania species from formalin-fixed biopsy samples by
polymorphism-specific polymerase chain reaction. Gene 210: 179-186.
13. Libório TN, Etges A, Neves AdC, Mesquita RA, Nunes FD (2005) Evaluation of
the genomic DNA extracted from formalin-fixed, paraffin-embedded oral
samples archived for the past 40-years. Jornal Brasileiro de Patologia e
Medicina Laboratorial 41: 405-410.
14. Disch J, Pedras MJ, Orsini M, Pirmez C, de Oliveira MC, et al. (2005) Leishmania
(Viannia) subgenus kDNA amplification for the diagnosis of mucosal
leishmaniasis. Diagn Microbiol Infect Dis 51: 185-190.
15. Laskay T, Miko TL, Negesse Y, Solbach W, Rollinghoff M, et al. (1995) Detection
of cutaneous Leishmania infection in paraffin-embedded skin biopsies using
the polymerase chain reaction. Trans R Soc Trop Med Hyg 89: 273-275.
16. Oliveira JG, Novais FO, de Oliveira CI, da Cruz Junior AC, Campos LF, et al.
(2005) Polymerase chain reaction (PCR) is highly sensitive for diagnosis of
mucosal leishmaniasis. Acta Trop 94: 55-59.
17. Pirmez C, da Silva Trajano V, Paes-Oliveira Neto M, da-Cruz AM, Goncalves-daCosta SC, et al. (1999) Use of PCR in diagnosis of human american
tegumentary leishmaniasis in Rio de Janeiro, Brazil. J Clin Microbiol 37: 18191823.
18.
Peixoto
F
(2009)
A
Amazônia
em
números.
Available:
http://www.bbc.co.uk/portuguese/noticias/2009/07/090722_amazonia_numeros_fbdt.
shtml. BBC Home Brazil accessed 2010 jul 02.
19. Van der Meide W, Guerra J, Schoone G, Farenhorst M, Coelho L, et al. (2008)
Comparison between quantitative nucleic acid sequence-based amplification,
81
real-time reverse transcriptase PCR, and real-time PCR for quantification of
Leishmania parasites. J Clin Microbiol 46: 73-78.
20. Rodgers MR, Popper SJ, Wirth DF (1990) Amplification of kinetoplast DNA as a
tool in the detection and diagnosis of Leishmania. Exp Parasitol 71: 267-275.
21. Reale S, Maxia L, Vitale F, Glorioso NS, Caracappa S, et al. (1999) Detection of
Leishmania infantum in dogs by PCR with lymph node aspirates and blood. J
Clin Microbiol 37: 2931-2935.
22. Marfurt J, Nasereddin A, Niederwieser I, Jaffe CL, Beck HP, et al. (2003)
Identification and differentiation of Leishmania species in clinical samples by
PCR amplification of the miniexon sequence and subsequent restriction
fragment length polymorphism analysis. J Clin Microbiol 41: 3147-3153.
23. Amato VS, Tuon FF, Bacha HA, Neto VA, Nicodemo AC (2008) Mucosal
leishmaniasis .Current scenario and prospects for treatment. Acta Trop 105: 19.
24. Reithinger R, Dujardin JC, Louzir H, Pirmez C, Alexander B, et al. (2007)
Cutaneous leishmaniasis. Lancet Infect Dis 7: 581-596.
25. Lainson R (1983) The American leishmaniases: some observations on their
ecology and epidemiology. Trans R Soc Trop Med Hyg 77: 569-596.
26. Romero GA, Ishikawa E, Cupolillo E, Toaldo CB, Guerra MV, et al. (2002) The
rarity of infection with Leishmania (Viannia) braziliensis among patients from
the Manaus region of Amazonas state, Brazil, who have cutaneous
leishmaniasis. Ann Trop Med Parasitol 96: 131-136.
27. Marsden PD (1986) Mucosal leishmaniasis ("espundia" Escomel, 1911). Trans R
Soc Trop Med Hyg 80: 859-876.
82
28. Marsden PD, Llanos-Cuentas A, Lago EL, Cuba-Cuba AC, Barreto AC, et al.
(1984) Human mucocutaneous leishmaniasis in Três Braços, Bahia, Brazil. An
area of Leishmania braziliensis braziliensis transmission. III. Mucosal disease:
presentation and initial evolution. Rev Soc Bras Med Trop 17: 179-186.
29. Machado-Coelho GL, Caiaffa WT, Genaro O, Magalhaes PA, Mayrink W (2005)
Risk factors for mucosal manifestation of American cutaneous leishmaniasis.
Trans R Soc Trop Med Hyg 99: 55-61.
30. Camuset G, Remy V, Hansmann Y, Christmann D, Gomes de Albuquerque C, et
al. (2007) [Mucocutaneous leishmaniasis in Brazilian Amazonia]. Med Mal
Infect 37: 343-346.
31. Falqueto A, Sessa PA, Ferreira AL, Vieira VP, Santos CB, et al. (2003)
Epidemiological and clinical features of Leishmania (Viannia) braziliensis
American cutaneous and mucocutaneous leishmaniasis in the State of Espirito
Santo, Brazil. Mem Inst Oswaldo Cruz 98: 1003-1010.
32. Ramirez JL, P. G (1997) Persistent Infections by Leishmania (Viannia)
braziliensis. Memórias do Instituto Oswaldo Cruz 92: 333-338.
33. Schleucher RD, Zanger P, Gaessler M, Knobloch J (2008) Successful diagnosis
and treatment 50 years after exposure: is mucocutaneous leishmaniasis still a
neglected differential diagnosis? J Travel Med 15: 466-467.
83
4.3 Artigo 3
CLINICAL
ASPECTS,
DIAGNOSIS,
AND
THERAPY
OF
MUCOSAL
LEISHMANIASIS IN THE AMAZON
Jorge Augusto de Oliveira Guerra
Sousa
1,3
,1,2
, Leila Inês de A.C.R. Coelho
, Marcilene Gomes Paes1, Renato Teles de
1,3
, Pricila Gama
3
1,2
, Alexandre Ribeira Macião
, Aristóteles Moura 3, Rafael Carvalho 3, Maria das Graças Vale Barbosa
1,2,4
, Luiz
Carlos de Lima Ferreira 1,2,3
1. Tropical Medicine Foundation of Amazonas
2. State University of Amazonas
3. Federal University of Amazonas
4. Nilton Lins University
Summary
In this paper we discuss the clinical diagnosis and treatment of patients with Mucosal
Leishmaniasis (ML) at the Tropical Medicine Foundation of Amazonas (FMTAM) from
July, 1992 to December, 2008. We followed 234 patients, 193 of whom were males
(82.5%) from a study population whose mean age was 47.7 years. 193 (82.5%) of
our subjects had a previous history of cutaneous leishmaniasis (CL) and 112 (63.6%)
previously received irregular treatment. Lesions in the nasal septum were seen in
232 (98.7%) cases and we had 109 (46.6%) nasal/oral perforations, 103 (44%)
ulcerated lesions, 22 (9.7%) granulomatous lesions, and 18 (7.7%) had oral
involvement. The average delay between LC skin lesions and the onset of ML
symptoms was 16.7 years in 163/193 patients, while the mean duration of ML
84
infection was 7.8 years. The observed symptoms of ML were: nasal obstruction 127
(70%), removal of crusts 103 (53.3%), rhinorrhea 90 (48 9%), epistaxis 85 (46.2%),
pruritus 70 (38%), pain 37 (20.1%), and dysphonia 24 (13%). Rhinoscopy showed
ulcers 69 (37.5%), perforation 89 (48.4%), nasal forms without extra perforation 13
(7.1%), and infiltration 13 (7.1%). Intradermal reaction to the Montenegro skin test
(MST) was positive in 209/214 (97.7%) cases. Histopathology was compatible or
positive for leishmaniasis in 124/174 (71.3%) cases. Serology was positive in 85/220
(38.6%) cases. Of the 230 patients, 170 (73.9%) were treated initially with
antimonials yielding a 48.2% cure rate and a 12.4% loss. 60 (26.1%) were initially
treated with pentamidine, which cured 61.7% with a loss of 28.3%. The final outcome
of treatment was a 74% (173/234) cure rate with a 26% (61/234) loss.
Keywords: Mucosal leishmaniasis, Brazilian Amazon, antimony
INTRODUCTION
In the Americas, Mucosal Leishmaniasis (ML) frequently presents with the
involvement of the mucosal lining of the upper airways, causing perforation,
ulcerative or vegetating lesions, and necrosis of the cartilaginous septum, nasal
turbinate, soft and hard palates, the nasal pyramid, uvula, pharynx and larynx. It may
also cause problems with swallowing, phonation, and respiration
1,2
.
ML is most commonly associated with L. (V.) braziliensis, a species recognized as
the most important etiologic agent of ML in the New World 3. It is a disease that is
increasing in the Northern Hemisphere as travelers return home following
participation in tourism or armed conflict
4,5,6
. In Brazil, most cases comes from cities
85
and states to the south of the Amazon River where L. (V.) braziliensis predominates
7,2
.
In the eastern Brazilian Amazon, the mucosal disease is the result of patients with a
history of previous skin lesions, often caused by L. (V.) braziliensis, that were either
untreated or were treated inappropriately 7,8,9.
It
was
difficult
to
diagnose
LM
because
patients
typically
had
only
a
clinical/epidemiological diagnosis and few had a laboratory diagnosis. Unlike
cutaneous leishmaniasis (CL), which has relatively fixed treatment lengths, there is
not a standardized treatment length for LM. Treatment failures are regularly
encountered and dropouts and discontinuities are frequent
10
.
There have been a few studies of LM in the state of Amazonas
11,12,13
, and yet none
of them discusses all aspects surrounding the disease. Thus, the purpose of this
study is to show the clinical diagnosis and treatment of patients with LM who were
treated at FMTAM.
PATIENTS AND METHODS:
This is a retrospective study that evaluates data from patients diagnosed with LM and
treated at the FMTAM between July, 1992 and December, 2008.
We included patients with LM treated at the FMTAM with clinical histories and
physical examinations suggestive of mucosal disease (hyperemia, ulcer, or infiltration
in the nasal region, oropharynx or larynx with exposure, perforation or destruction of
nasal cartilage and injury of the palate)1,2, preferably with a complementary positive
test (serology, intradermal Montenegro skin test (MST), direct examination, with
86
positive histopathological findings compatible with LM
14
or Polymerase Chain
Reaction (PCR)). The study group consisted of patients who were previously treated
for ML (whether they responded to the treatment or not). During rhinoscopy we
considered severe cases to be those patients with lesions, those with nasal and extra
nasal destruction, and/or those with perforation. Moderate cases were those with
ulcers, and mild cases were those with infiltration.
Data (medical records, report cards, test results etc.) were analyzed in Microsoft
Excel version 6.0. For all statistical tests we used a significance value of 0.05.
This study was conducted in accordance with international ethical guidelines for
biomedical research involving human subjects (protocol number 1809/2006-FMTAM).
There are no conflicts of interest.
RESULTS:
We had a total of 234 patients in the study, 193 (82.5%) of whom were male. The
mean age was 47.7 years (range: 8-87). 193 (82.5%) had a previous history of LC
(176 reported treatment, of which we considered 112 (63.6%) to have received
irregular treatment). Lesions were seen in the nasal septum in 232 (98.7%) cases.
Of patients with lesions, 109 (46.6%) had perforation nasal/oral, 103 (44%) had
ulcers, 22 (9.4%) had infiltrates, and 18 (7.7%) had oral lesions. 73 (31.2%) of
patients had LM 1 to 10 years after they had LC. The mean delay between LC and
LM was 16.7 years in 163/193 patients (in 30 cases the patients did not note the
timing of their infections). The mean duration of the LM infection was 7.8 years
(range: 30 days - 50 years). The clinical presentations were: 200 (85.6%) nasal, 29
nasal pharynx (12.4%), 2 nasal pharynx and larynx (0.8%), 1 oropharyngeal (0.4%),
87
and 1 oropharynx and larynx (0.4%). The most frequent patient complaints were:
nasal obstruction 127 (70%), crust formation 103 (53.3%), rhinorrhea 90 (48.9%),
epistaxis 85 (46.2%), pruritus 70 (38%), pain 37 (20.1%), and dysphonia 24 (13%).
At Rhinoscopy we observed: ulceration 104 (%), perforation 109 (48.4%), nasal
forms without extra perforation 13 (7.1%), and infiltration 22 (7.7%) (Table 1). Among
patients with perforation, the mean disease duration was 11.2 years.
For those
without perforation it was 4.7 years. Seven patients (3%) had perforated palates.
The MST was positive in 209/214 (97.7%) cases and histopathology was compatible
or positive for LM in 124/174 (71.3%). Serology was positive in 85/220 (38.6%) cases
(Table 2). In the analysis of the treatments received by the 230 patients, 170 (73.9%)
were treated initially with antimonials, of which 48.2% were considered cured and
12.4% were lost. In the 60 (26.1%) cases that were treated initially with pentamidine
we observed a 61.7% cure rate and a 28.3% loss. In the final outcome of treatments
173 (74%) patients were considered clinically cured and 61 (26%) were lost due to
lack of follow-up. The evaluation period varied between 6 and 12 months.
Table 1 - Clinical Presentation – Rhinoscopy
Clinical presentation
Serious
N
%
Nasal
Perforated
90
38.5
Extra-nasal
Perforated
19
8.1
Unperforated
15
6.4
Moderate
Ulcerated
90
38.5
Mild
Infiltrated
20
8.5
234
100.0
Total
88
Table 2 – The sensitivity of different diagnostic methods
Histopathology
Direct exam
IDRM
Serology
Positive
6 (2.6%)
32 (13.7%)
209 (89.3%)
85 (36.3%)
Negative
50 (21.4%)
98 (41.9%)
3 (1.3%)
135 (57.7%)
Not realized
26 (11%)
60 (25.6%)
18 (7.7%)
0 (0%)
Not recorded
35 (15%)
11 (4.7%)
1 (0.4%)
14 (6%)
Compatible with ML
117 (50%)
-
-
-
Table 3 - The outcome of cases following the first treatment with Antimonials or
Pentamidine
Frist treatment
Antimonials
Total N
170 (72.%)
Pentamidine
60 (25.6%)
Outcome
Cured
Failed
Lost
Cured
Failed
Lost
N
82 (48.2%)
67 (39.4%)
21 (12.4%)
37 (61.7%)
6 (10%)
17 (28.3%)
DISCUSSION
American Tegumentary Leishmaniasis is a serious public health problem in
Amazonia, particularly in the state of Amazonas
15,16
and mucosal involvement is
frequent13. The majority of the LM cases in our study were seen in individuals over
40 years old (mean 47.77), similar to what has been reported elsewhere
10,19
. One
factor in the development of LM may be inadequate treatment of skin lesions or
irregularities in their primary treatment
14,18,19
as we observed in 112/193 (63.6%)
patients who had a previous treatment history for their skin lesions. The average
time of 16.7 years between LC and LM differs from the 3 to 4 years found by
Marsden et al.
18
but they found, as did we, that most cases occurred between 1 and
5 years after the LC.
89
The genetic background of the host, immune status, association with systemic
diseases, local trauma, immunosuppressive treatments, and co-infection with the HIV
virus are all mechanisms that theoretically can trigger reactivation 20,21.
We also found a relationship between the occurrence previous of LC and mucosal
disease, as observed by several other authors
2,18
. Another possibility explaining the
trend could be an age-related decline in immunity because most patients who had
LM were over 40 years old. For 15 patients in our study ML appeared 40 to 74 years
after the onset of LC, as was observed by Schleucher et al. 22.
The extreme shortage of parasites in ML lesions was not correlated with the severity
of disease in these cases 23. Factors related to an exacerbated immune response are
the most widely accepted as determinants of clinical disease
22,23,24
. In this study
nasal septum involvement was the most common finding. While the oral mucosa,
pharynx, and larynx may be affected, the apparent preferred locale of the disease is
in the mucosa of the nasal septum
1,4,17, 18
. 85.5% of patients in this study had just
nasal involvement and only 1% of the remaining forms were not associated with
nasal involvement.
A study done in Bahia18 found 56.5% of patients had nasal perforation, though we
found slightly fewer - 46.6%. The perforations in this study seem to be more related
to the average evolution time of 11.2 years versus the 4.7 years that was observed in
cases without perforation.
Although many diagnostic techniques have been developed, in endemic areas the
diagnosis of LC and LM is often done based only on the clinical data associated with
the MST
25
. This results in the variety of diagnostic limitations that have previously
been discussed in the literature 10, 12,26, 27.
90
In this study we found 20% positivity in the direct exam. In addition to the four
different methods of isolation/encounter, the parasite was recorded in 35 cases
(19.2%) (the PCR results added an additional 80 cases (39.8%)). However, due to
the low frequency of parasites in these lesions, the sensitivity of these methods
varies from 10-45% and rarely exceeds 50% 2,28.
The sensitivity of serological methods and the possibility of cross reactions are also
variable and they have low correlations with the clinical aspects of the disease29,30.
However, Barroso-Freitas et al.31 had good results using the ELISA and IIF to
compare two different antigens (L. braziliensis and L. major-like).
In this study
serology also demonstrated a low correlation, with 37% of the cases being positive.
The MST test performed best, and although it is subject to positive cross reactions,
when it is more than 10 mm it is suggestive of LM. Da-Cruz et al.
24
observed
statistically significant differences between patients with LC and LM and in this study
we observed 98.1% positivity among the 165 tests performed (143 (86.7%) of them
were greater than 10 mm).
For patients with negative biopsies for Leishmania, many authors utilize
histopathological exams that are compatible with ML for their diagnoses
14,32,33
. This
study found that 47.8% of the cases were compatible with ML and 2.7% were
positive for Leishmania.
PCR has been considered by several authors to be the method of choice in the
diagnosis of LM. In this study the time of biopsy embedment of some patients may
have contributed to the low observed sensitivity 56/143 (39.2%), though different
authors, mainly using minicircle kDNA as their target, have reported sensitivities
ranging from 62 to 97.1%19,29,34, 35,.
91
Mucosal leishmaniasis lesions almost never heal spontaneously and secondary
bacterial infections are common36. In cases of strong clinical suspicion that lacked
parasite isolation treatment with antimonials was nonetheless highly effective
37
.
Antimonail failures were regularly observed in this study and required the use of
alternative treatments, of which we found pentamidine to be the most successful as
has been demonstrated in the literature11,1,38,13. It is crucial to note that, in spite of
these treatment successes, follow-up periods must to be substantial to avoid the
possibility of observing only the response to the initial treatment and missing the
losses that have been associated with social aspects (e.g. distance and lack of
patient financial resources)39.
The present study is of great importance for understanding the occurrence of the
mucosal disease in the Amazon region where there is a large gap in our knowledge
due to the lack of published data. We conclude that ML is an important public health
problem in Amazonia and that early diagnosis and access to treatment and long-term
monitoring are crucial given the complexity, severity, and potential complications of
the disease.
BIBLIOGRAFIA
1. Lessa H, Machado P, Lima F, Cruz AA, Bacellar O, Figuiredo J, Carvalho E et al.
Successful Treatment Of Refractory Mucosal Leishmaniasis With Pentoxifylline Plus
Antimony Am J Trop Med Hyg 2005;73(1) 69–73.
2. Marsden PD Mucosal leishmaniasis (‘espundia’ Escomel 1911) Trans R Soc Trop
Med Hyg 1986;80:859–76.
92
3. Silveira FT, Lainson R, Corbett CEP. Clinical and Immunopathological Spectrum of
American Cutaneous Leishmaniasis with Special Reference to the Disease in
Amazonian Brazil - A Review. Mem Inst Oswaldo Cruz 2004;99(3): 239-51.
4. Amato VS, Tuon FF, Bacha HA, Neto VA, Nicodemo AC. Mucosal leishmaniasis
.Current scenario and prospects for treatment. Acta Trop 2008;105(1):1-9.
5. Lawn SD, Whetham J, Chiodini PL, Kanagalingam J, Watson J, Behrens RH,
Lockwood DN. New world mucosal and cutaneous leishmaniasis: an emerging health
problem among British travellers. QJM. 2004;97(12):781-8.
6. Reithinger R, Dujardin JC, Louzir H, Pirmez C, Alexander B, Brooker S. Cutaneous
leishmaniasis. Lancet Infect Dis. 2007;7(9):581-96.
7. Lainson R. The american leishmaniasis: some observations on their ecology and
epidemiology Trans R Soc Trop Med Hyg 1983;77:569-96
8. Lainson R. Our present knowledge of the ecology and control of leishmaniasis in
the Amazon Region of Brazil Rev Soc Bras Med Trop 1985;18:47-56
9. Lainson R, Shaw JJ. New Word leishmaniasis – The neotropical Leishmania
species In: Cox FEG Krier JP Wakelin D (ed) Topley & Wilson´s Microbiology and
Microbial Infections Volume 5 Parasitology Arnold London Sydney Auckland
1998;241-266
10. Ministério da Saúde - Fundação Nacional de Saúde. Manual de controle da
leishmaniose tegumentar americana Brasília: Fundação Nacional de Saúde. 2000.
11. Barros MLB, Paes MG, Talhari S Leishmaniose cutâneo-mucosa na Amazônia –
Estudo dos casos diagnosticados em Manaus no período de 1976 a 1980 An Bras
Dermatol 1982; 57:153-154.
12. Paes MG, Barros MLB, Toledo LM. Considerações sobre a produção da
Leishmaniose Tegumentar Americana no Estado do Amazonas In: Espaço e
93
Doença: um olhar sobre o Amazonas, Rio de Janeiro RJ, Editora FIOCRUZ.
1997;105-13.
13.
Sousa R. Estudo das seqüelas em otorrinolaringologia de pacientes
clinicamente curados para leishmaniose cutâneo-mucosa da Amazônia. Dissertação
de mestrado, Universidade Federal de São Paulo, São Paulo, SP, 2001.
14. Guerra JAO, Talhari S, Paes MG, Garrido M, Talhari JM Aspectos diagnósticos
da Leishmaniose Tegumentar Americana em militares simultaneamente expostos á
infecção na Amazônia Rev Soc Bras Med Trop 2003; 36:(5) 587-90.
15. Guerra JAO, Barbosa MGV; Loureiro ACSP; Pinheiro CC; Rosa GG; Coelho
LIARC. Leishmaniose tegumentar americana em crianças: aspectos epidemiológicos
de casos atendidos em Manaus, Amazonas, Brasil. Cad. Saúde Pública
2007;23(9):2215-23.
16. Falqueto A, Sessa PA, Ferreira AL, Vieira VP, Santos CB, Varejão JB, Cupolillo
E, Porrozzi R, Carvalho-Paes LE, Grimaldi Júnior G. Epidemiological and clinical
features
of
Leishmania
(Viannia)
braziliensis
American
cutaneous
and
mucocutaneous leishmaniasis in the State of Espírito Santo, Brazil. Mem Inst
Oswaldo Cruz. 2003;98(8):1003-10.
17. Amato VS, Tuon FF, Imamura R, Camargo RA, Duarte MI Neto VA. Mucosal
leishmaniasis: description of case management approaches and analysis of risk
factors for treatment failure in a cohort of 140 patients in Brazil. J Eur Acad Dermatol
Venereol 2009;23(9):1026-34.
18. Marsden PD, Llanos-Cuentas A, Lago EL, Cuba CAC, Barreto AC, Costa JM,
Jones TC. Human mucocutaneous leishmaniasis in Três Braços, Bahia, Brazil An
area of Leishmania braziliensis braziliensis transmission III Mucosal disease:
presentation and initial evolution Rev Soc Bras Med Trop 1984;17:179—86.
94
19. Oliveira JG, Novail OF, Oliveira CI, Cruz JA, Campos FL, Rocjha A, Boaventura
V, Noroña A, Jackson, ML Jackson, Barral A. Polymerase chain reaction (PCR) is
highly sensible for diagnosis of mucosal leishmaniasis. Acta Trop 2005;94:55-59.
20. Saravia NG, Weigle K, Segura I, Giannini SH, Pacheco R, Labrada LA,
Gonçalves A Recurrent lesions in humam Leishmania braziliensis infection –
Reactivation or reinfection? The Lancet 1990;18:398-402.
21. Machado-Coelho GLL, Caiaffab WT, Genaro OM,Magalhães DM, Mayrinkc W.
Risk factors for mucosal manifestation of American cutaneous leishmaniasis. Trans R
Soc Trop Med Hyg 2005;99:55–61.
22. Schleucher RD, Zanger P, Gaessler M, Knobloch J. Successful diagnosis and
treatment 50 years after exposure: is mucocutaneous leishmaniasis still a neglected
differential diagnosis? J Travel Med. 2008;15(6):466-7.
23. Da-Cruz, AM, Bittar, R, Mattos, M, Oliveira-Neto, Nogueira,R, Pinho-Ribeiro, V,
Azeredo-Coutinho, RB,Coutinho, SG. T-Cell-mediated immune responses in patients
with cutaneous or mucosal leishmaniasis; longterm evaluation after therapy Clin
Diagn Lab Immuno 2002;l9:251-6.
24. Carvalho EM, Johnson WD, Barreto E, Marsden PD, Costa JL, Reed S, Rocha H.
Cell mediated immunity in American cutaneous and mucosal leishmaniasis. J
Immunol. 1985;135:4144–8.
25. Bacellar O, Lessa H, Schriefer A, Machado P, Jesus AR, Walderez O et al UpRegulation of Th1-Type Responses in Mucosal Leishmaniasis Patients Infection and
Immunity 2002;6734–40.
26. Reed SG, Badaró R, Masur H, Carvalho EM, Lorenço R, Lisboa A, Teixeira R,
Johnson WD, Jones TC. Selection of a skin test antigen for American visceral
leishmaniasis. Am J Trop Med Hyg 1986;35:79-85.
95
27. Dimier-David L, David C, Muñoz M, Vargas F, Bustillos R, Valda L, Dedet JP. et
al. Epidemiological, clinical and biological features of mucocutaneous Leishmaniasis
in Bolivia after a 221 patient sample. Bull Soc Pathol Exot 1993; 86:106–11.
28. Furtado T. Critérios para o diagnóstico da leishmaniose tegumentar americana.
An Bras Dermatol 1980;52:81-6.
29. Disch J, Junqueira M, Orsini M, Pirmez C, Oliveira AC, Castro M, Rabello 2005.
Leishmania (Viannia) subgenus kDNA amplification for the diagnosis of mucosal
leishmaniasis. Diag Microbiol infect Dis 51: 185-90.
30. Romero GAS, Guerra MVF, Paes MG, Macêdo VO Comparison of Cutaneous
Leishmaniasis due to Leishmania (Viannia) braziliensis and L (V) guyanensis in
Brazil: Clinical findings and diagnostic approach Clin Infect Dis 2001;32:1304-12.
31. Barroso-Freitas AP, Passos SR, Mouta-Confort E, Madeira MF, Schubach AO,
Santos GP, Nascimento LD, Marzochi MC, Marzochi KB. Accuracy of an ELISA and
indirect immunofluorescence for the laboratory diagnosis of American tegumentary
leishmaniasis. Trans R Soc Trop Med Hyg. 2009;103(4):383-9.
32. Andrade RV. Reação em cadeia de polimerase em biópsias de pele emblocadas
em
parafina
compatíveis
com
Leishmaniose
Tegumentar
Americana
a
histopatologia, 2007 Dissertação de Mestrado, Universidade do Estado do
Amazonas, Manaus, AM 56pp
33. Safaei A, Motazedian MH, Vasei M Polymerase chain reaction for diagnosis of
cutaneous leishmaniasis in histological positive, suspicious and negative skin
biopsies Dermatology 2002;205(1):18-24.
34. Pirmez C, da Silva Trajano V, Paes-Oliveira Neto M, da-Cruz AM, Goncalves-daCosta SC, Catanho M, et al Use of PCR in diagnosis of human American
96
tegumentary leishmaniasis in Rio de Janeiro, Brazil J Clin Microbiol 1999;37: 181923.
35. Lanús EC, Piñero JE, González AC, Valladares B, Grosso ML, Salomón
OD.Detection of Leishmania braziliensis in human paraffin-embedded tissues from
Tucumán, Argentina by polymerase chain reaction. Mem Inst Oswaldo Cruz
2005;100(2):187-92.
36. Reithinger R. Diagnosis and treatment of cutaneous leishmaniasis. Expert
Review of Dermatology 2008;3(3):315-27.
37. Bracho CO, Porras de Quintana L, Arenas MS, Rios PM. Polymerase chain
reaction with two molecular targets in mucosal leishmaniasis' diagnosis: a validation
study. Mem Inst Oswaldo Cruz. 2007;102(5):549-54.
38. Lai A Fat, EJSK, Vrede MA, Soetosenojo RFM, Lai A Fat Pentamidine, the drug
of choice for the treatment of cutaneous leishmaniasis in Surinam. Inter J
Dermatology 2002;41(11):796–800.
39. Guthmann JP, Arlt D, Garcia LM, Rosales M, de Jesus Sanchez J, Alvarez E,
Lonlas S, Conte M, Bertoletti G, Fournier C, Huari R, Torreele E, Llanos-Cuentas A.
Control of mucocutaneous leishmaniasis, a neglected disease: results of a control
programme in Satipo Province, Peru Trop Med Int Health. 2005 Sep;10(9):856-62.
97
5. DISCUSSÃO
Aspectos clínicos
A LTA é um sério problema de saúde publica na Amazônia, em particular no estado
do Amazonas e o acometimento mucoso é freqüente
121,128,141
.
Diversos estudos sugerem que um fator para o desenvolvimento da doença mucosa
pode ser o tratamento inadequado das lesões cutâneas primárias ou irregularidades
no seu tratamento
100,77,153
como observado em 89 (66,4%) dos 134 doentes deste
estudo que possuíam história de tratamento de suas lesões cutâneas, estes dados
corroboram com a hipótese de que a doença mucosa pode ser resultado de
reativação endógena dos parasitos
154
, tanto para aqueles que tiveram LC, quanto
para os que moram em áreas endêmicas como a maioria dos doentes desse estudo,
embora Schiefer et al.
155
recomendem cautela no uso de dados de residência para
inferência de etiologia nos casos de LM, devido ao longo período de latência entre a
infecção primária e a ocorrência da doença mucosa.
O tempo médio de oito anos entre LC e LM difere daquele encontrado por Marsden
et al.
153
que foi de 3 a 4 anos. Entretanto a maior ocorrência de casos no intervalo
entre 1 a 5 anos após a LC foi também encontrada neste estudo, assim como
naquele.
O background genético do hospedeiro, o seu estado imune; ainda a associação com
doenças sistêmicas, assim como traumas locais ou tratamentos imunossupressivos
ou co-infecção com o vírus do HIV, são mecanismos que teoricamente podem
disparar essas reativações e fatores que podem ter influencia em sua ocorrência,
como observado por diversos autores, neste estudo também foi observada uma
associação entre ocorrência de LC anterior e doença mucosa
118,153,51,79
. Uma outra
98
hipótese poderia ser o declínio da imunidade pela idade, pois a maioria dos doentes
apresentou LM acima dos 40 anos idade, 15 dos pacientes desta série, tiveram LM
entre 40 a 74 anos após a ocorrência da LC, como observado por Schleucher et al.
156
em um paciente com LM 50 anos após a exposição.
No que diz respeito a expressão clínica da leishmaniose, tem sido observada uma
marcada diferença entre os subgêneros Leishmania e Viannia, com tendência as
formas mucosas na L.(V.) braziliensis e as formas difusas na L.(L.) amazonensis 157.
Perfil epidemiológico
O predomínio de caso de LM faixas etárias acima dos 40 anos, com média de 49,57
anos nos casos aqui descritos, tem sido observado em diversas séries de estudos
envolvendo a LM. Isso é explicado pela ocorrência mais tardia da LM, na maioria
das vezes precedida da forma cutânea, que ocorre com mais freqüência na idade no
adulto até 40 anos 62,25.
A extrema carência de parasitos encontrada nas lesões da LM não se correlaciona
com a severidade da doença ou com a resistência aos antimoniais usualmente
observada nestes casos
80
. Fatores ligados a uma resposta imune exacerbada são
os mais aceitos como determinantes do desfecho clínico da doença
158,84,80
. Lesões
extensas e mutilantes podem aparecer anos após a cura das lesões cutâneas. As
lesões mucosas podem afetar o trato respiratório superior levando a destruição de
cartilagem naso faríngea com conseqüente mutilação e desfiguração
126,38
neste
estudo o acometimento do septo nasal foi o mais comum dos achados, como visto
por outros autores na LM 153,121,62.
99
Embora a mucosa bucal, a faringe e laringe possam ser atingidas, a localização
preferencial da doença é na mucosa do septo nasal cartilaginoso e porções mais
anteriores das fossas nasais, como o vestíbulo, as conchas inferiores e por
contigüidade o próprio assoalho nasal
14,78
. A doença primária da mucosa
encontrada em 15,3% dos doentes e na grande maioria dos casos localizadas
somente no nariz também foi demonstrado por outros autores
78
, 84,2% dos
pacientes desta série possuíam apenas acometimento nasal e apenas 1% dos
demais não eram associados a formas nasais
No estudo feito na Bahia Marsden et al.
153
encontraram 56,5% de perfuração nasal,
entre os pacientes, neste estudo observou-se 48,4%, incluindo as formas orais,
demonstrando predominância dessa forma que é tida como uma complicação da
LM, as perfurações parecem estar mais relacionadas como se pode observar nestes
casos com o tempo de evolução 10,7 anos nestas formas contra 4,9 nos casos sem
perfuração.
Ainda que muitas técnicas diagnósticas tenham sido desenvolvidas, como
imunodiagnóstico e métodos de biologia molecular, o padrão ouro continua sendo a
demonstração do parasita em, amostras de tecido corado, ou seu crescimento em
cultura
159
, porém, em áreas endêmicas, o diagnóstico de LC e LM é feito muitas
vezes baseado apenas em dados clínicos associados ao teste intradérmico de
Montenegro 148.
O diagnóstico ideal das formas mucosas requer demonstração do parasito nos
meios de cultura ou em biópsias de histopatológico, neste estudo encontrou-se 20%
de positividade no direto, somando-se os quatro diferentes métodos de
100
isolamento/encontro de parasita chegou-se a 35 casos (19,2% entre os realizados),
entretanto, devido à baixa freqüência de parasitos nestas lesões a sensibilidade
desses métodos varia entre 10 a 45 %, raramente excedendo os 50%
Furtado
162
160,51,23,161,10
.
refere que a chance de encontrar o parasito nas lesões ulceradas é
inversamente proporcional ao tempo de evolução da doença, porém, além da
dificuldade natural do encontro de parasitos em lesões mucosas existe o tempo de
evolução da doença que, nos casos dos doentes deste estudo, apresentam uma
média de 7,5 anos com extremos de 60 dias 45 anos, embora Dimier-David et al.
161
tenham encontrado 58,8% em lesões de LM com mais de cinco anos de evolução
contra 48,7% em pacientes com menos de cinco anos de evolução.
A sensibilidade dos métodos sorológicos também é variável, pois além da
possibilidade de reações cruzadas, apresentam baixa correlação com os aspectos
clínicos da doença
87,163
, entretanto, Barroso-Freitas et al. 164 encontraram uma boa
resposta para os testes ELISA e IIF, comparando dois diferentes antígenos (L.
braziliensis comparado com L. major-like), enfatizando que a densidade óptica do
ELISA foi alta nas formas mucosas e recomendam este teste utilizando antígeno de
L. braziliensis como parte do diagnóstico em áreas endêmicas de LTA no Brasil,
neste estudo a sorologia também mostrou baixa correlação com os casos sendo
positiva em 37% e negativa em 53,3%.
O IDRM foi o teste que mostrou melhor desempenho, embora seja sujeito a reações
cruzadas a sua positividade quando superior a 10 mm e principalmente com necrose
é bastante sugestiva de LM, Da-Cruz et al.
80
observaram diferenças estísticamente
significativas nos testes realizados entre portadores de LC e LM, neste estudo
observou-se 98,1% de positividade entre os 165 realizados com 143 (86,7%) maior
de 10 mm sendo a maioria com necrose.
101
O laudo histopatológico de compatível com Leishmaniose Tegumentar em material
de pacientes com suspeita clínico-epidemiológica de LM tem sido um critério
utilizado por vários autores
104,86,77
, neste estudo foram encontrados achados
compatíveis com LM em 47,8% e 2,7% de positividade neste exame.
A técnica de PCR tem sido desenvolvida para a detecção dos parasitas de
Leishmania nas amostras clínicas
165
e tem sido considerada de especial
importância para o diagnóstico de Leishmaniose quando outros métodos falham em
demonstrar o parasito nas lesões granulomatosas, como nas fases crônicas da
doença, apresentando boa sensibilidade, entretanto
diferentes autores tem
reportado sensibilidades que variam de de 62 a 97,1% pricipalmente minicírculo de
kDNA como alvo em LM 101,100,87,98,86,99.
Aspectos relacionados à aderência ao tratamento
A leishmaniose mucosa quase nunca sara espontaneamente, é muito difícil de curar
quando tratada as infecções bacterianas secundárias são comuns e potencialmente
fatais
22
. E nos casos de uma forte suspeita clínica sem isolamento parasitário o
tratamento com antimoniais é altamente efetivo
72
, mas em outros locais, incusive no
120,122
Amazonas a pentamidina tem sido utilizada com bastante sucesso
.
No Peru a eficácia dos tratamentos com antimoniais variam de acordo com a
severidade da doença e as recidivas são freqüentes
126
.
A duração do tratamento medicamentoso da LM está estabelecida em 30 dias,
porém, falhas no tratamento são regularmente encontradas
alternativas nos casos refratários
78
25
, necessitando-se
por esses motivos o tempo de acompanhamento
requerido é longo, nesta série de casos se pôde observar o desfecho inicial em
102
reação as drogas utilizadas, entretanto, como observado por outros autores, as
perdas de seguimento são freqüentes e associadas principalmente a aspectos
sociais (como distancia e carência de recursos financeiros dos pacientes) mesmo
com a implementação de programas de controle
126
. Embora a maioria dos autores
deste estudo tenha participado no atendimento dos casos anteriormente, e apesar
de se ter buscado um diagnóstico etiológico, as limitações concernentes ao
diagnóstico destes casos são amplamente descritas na literatura
25,73,33,122,96
entretanto, este estudo é de grande importância para o entendimento da ocorrência
da doença mucosa na região Amazônica, onde existe uma grande lacuna neste
conhecimento pela ausência de dados publicados reativos a esta população.
Através destes dados podemos dizer que a LM é um problema importante de saúde
pública na região e que os aspectos relativos ao diagnóstico, tratamento e
seguimento dos casos, com grande quantidade de complicações como perfuração e
destruição nasal, devem ser motivo de adoção de medidas que incluam diagnóstico
precoce e acesso a tratamento e seguimento de qualidade, devido à complexidade e
a severidade da doença, associadas aos aspectos já discutidos.
No que diz respeito a expressão clínica da leishmaniose, tem sido observada uma
marcada diferença entre os subgêneros Leishmania e Viannia, com tendência as
formas mucosas na L.(V.) braziliensis e as formas difusas na L.(L.) amazonensis, 157,
por outro lado, as diferenças encontradas na distribuição dos casos de LTA no Brasil
e nos diferentes países andinos embasam a hipótese de variabilidade entre as
distintas cepas de uma mesma espécie
155
, inclusive como demonstrado no Peru
onde a ocorrência de LM pela L.(V.) braziliensis é restrita às regiões Amazônicas
38
,
estes dados sugerem que a viabilidade de uma mesma espécie pode estar
associada às diferenças na distribuição dos casos de LM também aqui descritos.
103
Espécies de Leishmania envolvidas na doença
A L.(V.) braziliensis é a espécie quase exclusiva causadora de LM, inclusive na
Bolívia as taxas de 20% de ocorrência desta forma, encontradas entre as maiores da
América Latina, são relacionadas diretamente a ao predomínio dessa espécie
naquele país
166
, entretanto outras espécies podem estar associadas a estas formas
de doença 42,44,43. Chama atenção o expressvo número de casos associados a L.(V.)
guyanensis, demonstrando que essa espécie é importante naregião como agente
etiológico de doença mucosa o que vem semdo imputado quase que exclusivamente
a L.(V.) braziliensis.
104
6. CONCLUSÕES
A Leishmaniose Mucosa na região Amazônica apresenta um perfil semelhante ao
restante do País com:
Aspectos clínicos
Acometimento predominantemente nasal;
14,5% dos pacientes com formas orais associadas ou isoladas;
46,6% dos casos apresentaram perfuração;
média de doença foi de 13,1 anos;
predominância de casos no sexo masculino.
Perfil epidemiológico
82,5% com História de LC anterior;
61,2% trataram de maneira inadequada;
66,7% procediam de regiões de calha sul do rio Amazonas;
79,5% com exposição relacionada a atividades de extrativismo.
Aspectos relacionados à aderência ao tratamento
Expressivo percentual (73,1 %) de cura no desfecho final;
25,6% de perdas.
Espécies de Leishmania envolvidas na doença
Predominância da L. (V.) braziliensis entre as espécies caracterizadas;
A Leishmania (Viannia) guyanensis é a espécie causadora em 1/3 dos casos
caracterizados.
105
7. REFERÊNCIAS BIBLIOGRÁFICAS
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
WHO. The world health report 2004. Changing history. Geneva: WHO, 2004.
http://www.who.int/whr/2004/en/index.html (accessed June 12, 2007).
Desjeux P. Leishmaniasis: current situation and new perspectives. Comp
Immunol Microbiol Infect Dis. 2004;27(5):305-18.
Kupfer B, Vehreschild J, Cornely O, Kaiser R, Plum G, Viazov S, Franzen C,
Tillmann R, Simon A, Müller A, Schildgen O. Leishmaniasis in Ancient Egypt
and Upper Núbia. Emerging Infectious Diseases 2006;12(10):1616-7.
World
Health
Organization.
A
brief
history
of
the
disease
http://www.who.int/leishmaniasis/en/ acessado em 20 de março de 2008.
Basano AS, Camargo LMA. Leishmaniose tegumentar americana: histórico,
epidemiologia e perspectivas de controle. Rev Bras Epidemiol
Vale ECS, Furtado T. Leishmaniose tegumentar no Brasil: revisão histórica da
origem, expansão e etiologia. An Bras Dermatol 2005;80(4):421-8.
Altamirano-Enciso AJ, Marzochi MCA, Moreira JS, Schubach AO, Marzochi
KBF. On the origin and spread of cutaneous and mucosal leishmaniasis, based
on pre- and post-Colombian historical sources. Hist cienc saude-Manguinhos
2003;10(3):853-882.
Marzochi MCA, Marzochi KBF. Tegumentary and visceral leishmaniasis in
Brazil-emerging anthropozoonosis and possibilities for their control. Cad Saúde
Publ 1994;10:359-75.
Gomes RF, Macedo AM, Pena SD, Melo MN. Leishmania (Viannia) braziliensis:
Genetic Relationships between Strains Isolated from Different Areas of Brazil as
Revealed by DNA Fingerprinting and RAPD. Experimental Parasitology
1995;80;681-7.
Lopes UG, Momen H, Grimaldi Jr G, Marzochi MCA, Pacheco RS, Morel CM.
Schizodeme and zimodeme characterization of Leishmania in the investigation
of foci visceral and cutaneous leishmaniasis. J of Parasitology 70: 89-98, 1994.
Matta AA. Rev Médica de São Paulo. Leishmaniose trópica 1910;440-1.
Vianna GO, Sobre uma nova espécie de Leishmania (nota preliminar). Brasil
Médico. 1915;25:411.
WHO, 2006 Control of leishmaniasis. Executive Board EB118/4 118th Session
11
May
2006.
Report
by
the
Secretariat
http://apps.who.int/gb/ebwha/pdf_files/EB118/B118_4-en.pdf acessado em 27
de agosto de 2009.
Amato VS, Tuon FF, Bacha HA, Aamto-Neto V, Nicodemo AC. Mucosal
Leishmaniasis. Current scenario and prospects for treatment. Acta Trop
2008;105,1-9.
2004 Lawn SD, Whetham J, Chiodini PL, Kanagalingam J, Watson J, Behrens
RH, Lockwood DN. New world mucosal and cutaneous leishmaniasis: an
emerging health problem among British travellers. QJM. 2004;97(12):781-8.
106
16
17
18
19
Reithinger R. Leishmaniases' burden of disease: ways forward for getting from
speculation to reality. PLoS Negl Trop Dis. 2008;2(10):e285. Epub 2008 Oct 29.
Konecny P, Stark DJ. An Australian case of New World cutaneous
leishmaniasis. The Med J Australia 2007;186(6):315-7.
Rose K, Curtis J, Baldwin T, Mathis A, Kumar B, Sakthianandeswaren A,
Spurck T, Low Choy J, Handman E. Cutaneous leishmaniasis in red kangaroos:
isolation and characterisation of the causative organisms. Int J Parasitol 2004;
34: 655-664.
WHO/TDR
2004).
WHO/TDR
2004
Leishmaniasis
http://www.who.int/tdr/diseases/leish/default.htm acessado em 21 de março de
2008. World Heald Organisation. Control of leishmaniasis. Report by the
Secretariat. http://ftp.who.int/gb/ebwha/pdf_files/WHA60/A60_10-en. pdf 22
March 2007.
20
WHO, 2009 World Health Organization. 2009. WHO - Programmes and projects
Leishmaniasis - Burden of disease. http://www.who.int/leishmaniasis/burden/en/
acessado em 12 de julho de 2009.
21
Velez ID, Agudelo S, Hendrickx E, Puerta J, Grogl M, Berman J. Inefficacy of
Allopurinol as monotherapy for Colombian cutaneous Leishmaniasis. A
randomized, controlled trial. Annals of Internal Medicine, 1997;126:232-6.
Reithinger R, Dujardin JC, Louzir H, Pirmez C, Alexander B, Brooker S.
Cutaneous Leishmaniasis. Lancet 2007;7:581-96.
Davies CR, Reithinger R, Campbell-Lendrum D, Feliciangeli D, Borges R,
Rodriguez N. The epidemiology and control of leishmaniasis in Andean
countries. Cad. Saude Publica. 2000;16:925–50.
World Health Organization. Control of the leishmaniases. Geneva: World Health
Organization; 1990. (Technical Report Series, 793).
Ministério da Saúde. Manual de Controle da leishmaniose tegumentar
americana. Brasília: Fundação Nacional de Saúde, Ministério da Saúde; 2000.
Datasus http://tabnet.datasus.gov.br/).
Silveira FT, Ishikawa EA, De Souza AAA, Lainson R. An outbreak of cutaneous
leishmaniasis among soldiers in Belém, Pará State, Brazil caused by
Leishmania (Viannia) lindenbergi n. sp., a new leishmanial parasite of man in
the Amazon region. Parasite 2002;9:43-50.
Lainson R. The american leishmaniasis: some observations on their ecology
and epidemiology. Trans R Soc Trop Med Hyg 1983;77:569-96.
Grimaldi Jr G, David JR, Mcmahon-Prat D. Identification and distribution of New
World Leishmania species characterized by serodeme analysis using
monoclonal anti-bodies. Am J Trop Med Hyg 1987;36: 270-287.
Grimaldi Jr G, Tesh RB, Mcmahon-Prat D. A review of the geographic
distribution and epidemiology of leishmaniasis in the New World. Am J Trop
Med Hyg 1989;41:687-725.
22
23
24
25
26
27
28
29
30
107
31
32
33
34
35
36
37
38
39
40
41
42
43
44
Lainson R, Shaw JJ. New Word leishmaniasis – The neotropical Leishmania
species In: Cox FEG Krier JP Wakelin D (ed) Topley e Wilson´s Microbiology
and Microbial Infections Volume 5 Parasitology Arnold London Sydney
Auckland 1998;241-66.
Tojal da Silva AC, Cupolillo E, Volpini AC, Almeida R, Romero GA. Species
diversity causing human cutaneous leishmaniasis in Rio Branco, state of Acre,
Brazil. Trop Med Int Health 2006;11(9):1388-98.
Paes MG, Souza RT, Palheta VP, Souza FHC, Talhari S. Leishmaniose
Tegumentar Americana: Aspectos do tratamento e seguimento de 60 pacientes
com acometimento mucoso. In: An. XXXI Cong. Soc Bras Med Trop, São Paulo
(SP), p123,1995.
Barros MLB, Paes MG, Talhari S. Leishmaniose mucocutânea na Amazônia.
Estudo dos casos diagnosticados em Manaus no período de 1976 a 1980. An.
Brasil. Dermat. 1982;57:152-54.
Guerra JAO, Barros MLB, Guerra MVF, Talhari S, Paes MG. Leishmaniose
Tegumentar no município de Manaus – Aspectos epidemiológicos. Rev Soc
Bras Med Trop 1998;31(supl 1):172.
Paes MG, Barros MLB, Toledo LM. Considerações sobre a produção da
Leishmaniose Tegumentar Americana no Estado do Amazonas In: Espaço e
Doença: um olhar sobre o Amazonas, Rio de Janeiro RJ, Editora FIOCRUZ.
1997; 105-13.
(http://www.fmt.am.gov.br/informe/001-2005leish.pdf)
Lucas CM, Franke ED, Cachay MI, Tejada A, Cruz ME, Kreutzer RD, Barker
DC et al. geographic distribution and clinical description of leishmaniasis cases
in peru Am J Trop Med Hyg 1998;59(2):312–7.
Nolder D, Roncal N, Davies CR, Llanos-Cuentas A, Miles MA. Multiple hybrid
genotypes of Leishmania (Viannia) in a focus of mucocutaneous leishmaniasis.
Am J Trop Med Hyg 2007;76(3):573-8.
Cuna WR, Velásquez R, Riva J, Guachalla I, Rodríguez C. Enhancement of a
TH1 immune response in amphotericin B-treated mucocutaneous
leishmaniasis. Biomed Biotechnol 2007;(5):96410-3.
Gontijo B e Carvalho MLR. Leishmaniose tegumentar americana. Rev Soc Bras
Med Trop 2003;36(1):71-80.
Barral A, Pedral-Sampaio D, Grimaldi Júnior G, Momen H, McMahon-Pratt D,
Ribeiro de Jesus A, Almeida R, Badaro R, Barral-Netto M, Carvalho EM, et al.
Leishmaniasis in Bahia, Brazil: evidence that Leishmania amazonensis
produces a wide spectrum of clinical disease. Am J Trop Med Hyg.
1991;44(5):536-46.
Naiff RD, Talhari S, Barrett TV - Leishmania guyanensis na mucosa nasal. Mem
Inst Oswaldo Cruz 1988;83(4):529-30.
Osorio LE, Castillo CM, Ochoa MT. Mucosal leishmaniasis due to Leishmania
(Viannia) panamensis in Colombia: Am J Trop Med Hyg 1998; 59(1);49-52.
108
45
46
47
48
49
50
51
52
53
54
55
56
57
Lainson R, Shaw JJ, Ready PD, Miles MA, Póvoa M. Leishmaniasis in Brazil:
XVI Isolation and identification of Leishmania species from sandflies wild
mammals and man in north Pará State with particular reference to L.
braziliensis guyanensis agent of “pian-bois”. Trans R Soc Trop Med Hyg
1981;75:530-6.
Talhari S, Arias JÁ, Cunha MGS, Naiff RD, Freitas RA, Barrett T. Leishmaniose
no Estado do Amazonas- Aspectos Epidemiológicos Clínicos e Terapêuticos.
An Bras Dermatol 1988;63:433-8.
Romero GAS, Guerra MVF, Paes MG, Macêdo VO. Comparison of Cutaneous
Leishmaniasis due to Leishmania (Viannia) braziliensis and L (V.) guyanensis in
Brazil: Clinical findings and diagnostic approach. Clin Infect Dis 2001;32:130412.
Naiff MF, Cupolillo E, Naiff RD, Momen H, Barret TV, Grimaldi GJr.
Leishmnaiose tegumentar americana na Amazônia: distribuição geográfica dos
agentes etiológicos na região. Rev Soc Bras Med Trop 1999;32: 243.
van der Meide W, Guerra J, Schoone G, Farenhorst M, Coelho L, Faber W,
Peekel I, Schallig H. Comparison between QT-NASBA, real-time ReverseTranscriptase PCR and real-time PCR for Quantification of Leishmania
parasites. J Clin Microbiol 2008;46(1):73-8.
Lainson R, Shaw JJ. Evolution, classification and geographical distribution. In W
Peters, R Killick-Kendrick (eds), The Leishmaniases in Biology and Medicine,
1987;1, Academic Press, London, p. 1-120.
Marsden PD. Mucosal leishmaniasis ("espundia" Escomel, 1911). Trans R Soc
Trop Med Hyg 1986;80:859-76.
Ministério da Saúde. Atlas de leishmaniose tegumentar americana. Brasília:
Fundação Nacional de Saúde, Ministério da Saúde; 2006.
Chagas AC, Pessoa FAC, Medeiros JF, Py-Daniel V, Mesquita ED, Balestrassi
DA. Leishmaniose Tegumentar Americana (LTA) em uma vila de exploração de
minérios - Pitinga, município de Presidente Figueiredo, Amazonas, Brasil. Rev
Bras Epidemiol 2006;9(2):186-92.
Arias JR, Freitas RA. On the vectores of cutaneous leishmaniasis in the Central
Amazon of Brazil. Acta Amazônica 1977b;7:507-27.
Pinheiro FG, LuzII SLB, FrancoI AMR. Infecção natural por tripanosomatídeos
(Kinetoplastida: Trypanosomatidae) em Lutzomyia umbratilis (Diptera:
Psychodidae) em áreas de leishmaniose tegumentar americana no Amazonas,
Brasil. Acta Amaz. 2008;38(1):165-72.
Lainson R, Shaw JJ, Silveira FT, Souza AAA, Braga RR, Ishikawa EAI The
dermal Leishmaniasis of Brazil with special reference to the eco-epidemiology
of the disease in the Amazonian. Mem Inst Oswaldo Cruz 1994;89(3):435-43.
Paes, MG. Estudo de quatro espécies de Lutzomyia França, 1924 (Diptera,
Psychodidae) em área endêmica de Leishmaniose Tegumentar Americana na
periferia de Manaus. [Dissertação de Mestrado]. Manaus: Instituto Nacional de
Pesquisas da Amazônia / Fundação Universidade do Amazonas; 1991.
109
58
59
60
61
62
63
64
65
66
67
68
69
70
Desjeux P. The increase in risk factors for leishmaniasis worldwide. Trans R
Soc Trop Med Hyg 2001;95:239-43.
Silva NS, Muniz VD. Epidemiologia da leishmaniose tegumentar americana no
Estado do Acre, Amazônia brasileira. Cad. Saúde Pública 2009;25(6):1325-36.
Paes MG, Fé NF, Coelho LIARC, Oliveira RS, Sousa JU, Teixeira MR et al.
Sobre a ocorrência de leishmaniose tegumentar em rua de bairro de
implantação antiga na cidade de Manaus (AM). Rev Soc Bras Med Trop
1998;31(Supl 1): 75.
Andrade SL. Leishmaniose Tegumentar Americana em área de ocupação
recente na periferia da cidade de Manaus Estado do Amazonas Brasil
[Dissertação de Mestrado]. Rio de Janeiro: Departamento de Medicina Tropical,
Instituto Oswaldo Cruz; 1997.
Falqueto A, Sessa PA, Ferreira AL, Vieira VP, Santos CB, Varejão JB, Cupolillo
E, Porrozzi R, Carvalho-Paes LE, Grimaldi Júnior G. Epidemiological and
clinical features of Leishmania (Viannia) braziliensis American cutaneous and
mucocutaneous leishmaniasis in the State of Espírito Santo, Brazil. Mem Inst
Oswaldo Cruz. 2003;98(8):1003-10.
Brandão-Filho SP, Brito ME, Carvalho FG, Ishikawa EA, Cupolillo E, FloeterWinter L, Shaw JJ. Wild and synanthropic hosts of Leishmania (Viannia)
braziliensis in the endemic cutaneous leishmaniasis locality of Amaraji,
Pernambuco State, Brazil. Trans R Soc Trop Med Hyg 2003;97(3):291-6.
Castro EA, Luz E, Telles FQ, Pandey A, Biseto A, Dinaiski M, Sbalqueiro I,
Soccol VT. Eco-epidemiological survey of Leishmania (Viannia) braziliensis
American cutaneous and mucocutaneous leishmaniasis in Ribeira Valley River,
Paraná State, Brazil. Acta Trop 2005;93(2):141-9.
Madeira MF, Uchôa CMA, Leal CA, Silva RMM, Duarte R, Magalhães CM,
Serra CMB. Leishmania (Viannia) braziliensis em cães naturalmente infectados.
Rev Soc Bras Med Trop 2003;36(5):551-5.
Oliveira FS, Pirmez C, Pires MQ, Brazil RP, Pacheco RS. PCR-based diagnosis
for detection of Leishmania in skin and blood of rodents from an endemic area
of cutaneous and visceral leishmaniasis in Brazil. Vet Parasitol. 2005;15;129(34):219-27.
Nery LCR, Lorosa ES, Franco AMR. Feeding Preference of the Sand Flies
Lutzomyia umbratilis and L. spathotrichia (Diptera: Psychodidae,
Phlebotominae) in an Urban Forest Patch in the City of Manaus, Amazonas,
Brazil 2004;99(6):571-4.
Barret TV, Senra MS. Leishmaniasis in Manaus, Brazil. Parasitol Today
1989;5:255-7.
Lainson R. Our present knowledge of the ecology and control of leishmaniasis
in the Amazon Region of Brazil. Rev Soc Bras Med Trop 1985;18:47-56.
Arias JR, Naiff RD, Miles MA, Souza AA. The opossum Didelphis marsupialis
(Marsupialia: Didelphidae) as a reservoir host of Leishmania brasiliensis
guyanensis in the Amazon Basin of Brazil. Trans R Soc Trop Med Hyg
1981;75:537-41.
110
71
72
73
74
75
76
77
78
79
80
81
82
83
Marzochi MCA. Leishmaniose no Brasil: as leishmanioses tegumentares. J
Bras Medic 1992;63:81-105.
Bracho CO, Porras de Quintana L, Arenas MS, Rios PM. Polymerase chain
reaction with two molecular targets in mucosal leishmaniasis' diagnosis: a
validation study. Mem Inst Oswaldo Cruz. 2007;102(5):549-54.
Camera PA, Junguer J, Pires FESS, Mattos M, Oiliveira-Neto MP, Fernandes O
et al. Haematogeneous dissemination of Leishmania (Viannia) braziliesis in
human American tegumentary leishmaniasis. Trans. R. Soc. Trop. Med. Hyg.
2006.
Desjeux P. Leishmaniasis: public health aspects and control. Clin Dermatol
1996;14:417-23.
Grant A, Spraggs PD, Grant HR, Bryceson AD. Laryngeal leishmaniasis. J
Laryngol Otol 1994;108:1086–8.
Marsden PD. Pentavalent Antimonials: Old Drug for New Diseases. Rev Soc
Bras Med Trop 1985;18(3):187-98.
Amato VS, Tuon FF, Imamura R, Abegão de Camargo R, Duarte MI, Neto VA.
Mucosal leishmaniasis: description of case management approaches and
analysis of risk factors for treatment failure in a cohort of 140 patients in Brazil.
Journal of the European Academy of Dermatology and Venereology.
2009;23(9):1026–34.
Lessa MM, Lessa HA, Castro TWN, Oliveira A, Scherifer A, Machado P,
Carvalho EM. Mucosal leishmaniasis: epidemiological and clinical aspects. Rev.
Bras. Otorrinolaringol 2007;73(6):843-7.
Machado-Coelho GLL, Caiaffab WT, Genaro OM,Magalhães DM, Mayrinkc W.
Risk factors for mucosal manifestation of American cutaneous leishmaniasis.
Trans R Soc Trop Med Hyg 2005;99: 55–61.
da-Cruz AM, Bittar R, Mattos M, Oliveira-Neto MP, Nogueira R, Pinho-Ribeiro
V, Azeredo-Coutinho RB, Coutinho SG. T-Cell-Mediated immune responses in
patients with cutaneous or mucosal leishmaniasis: Long-term evaluation after
therapy. Clin Diagn Lab Immunol 9: 251-256, 2002.
Figueroa RA, Lozano LE, Romero IC, Cardona MT, Prager M, Pacheco R, Diaz
YR, Tellez JA, Saravia NG. Detection of Leishmania in unaffected mucosal
tissues of patients with cutaneous leishmaniasis caused by Leishmania
(Viannia) species. J Infect Dis. 2009;200(4):638-46.
Silveira FT, Lainson R, Corbett CE. Clinical and immunopathological spectrum
of American cutaneous leishmaniasis with special reference to the disease in
Amazonian Brazil: a review. Mem Inst Oswaldo Cruz 2004;99(3):239-51.
Matta NE, Nogueira RS, Franco AM, de Souza E Souza I, Mattos MS, OliveiraNeto MP, Coutinho SG, Leon LL, Da-Cruz AM. Leishmania (Viannia)
guyanensis induces low immunologic responsiveness in leishmaniasis patients
from an endemic area of the Brazilian Amazon Highland. Am J Trop Med Hyg.
2009 Mar;80(3):339-44.
111
84
85
86
87
88
89
90
91
92
93
94
95
96
97
98
Bacellar O, Lessa H,333 Schriefer A, Machado P, Jesus AR, Walderez O et al.
Up-Regulation of Th1-Type Responses in Mucosal Leishmaniasis Patients.
Infection and Immunity. 2002; 6734–40.
Da-Cruz AM, de Oliveira MP, De Luca PM, Mendonca SC, CoutinhoSG. 1996.
Tumor necrosis factor-alpha in human american tegumentary leishmaniasis.
Mem. Inst. Oswaldo Cruz 91, 225–229.
Safaei A, Motazedian MH, Vasei M. Polymerase chain reaction for diagnosis of
cutaneous leishmaniasis in histologically positive, suspicious and negative skin
biopsies. Dermatology 2002;205(1):18-24.
Disch J, Pedras MJ, Orsini M, Pirmez C, de Oliveira MC, Castro M, Rabello A.
Leishmania (Viannia) subgenus kDNA amplification for the diagnosis of
mucosal leishmaniasis. Diagn Microbiol Infect Dis. 2005;51(3):185-90.
Riddley DS, Marsden PD, Cuba CC, Barreto AC. A histological classification of
mucocutaneous leishmaniasis in Brazil and its clinical evaluation. Trans R Soc
Trop Med Hyg 74;4:1980.
Bittencourt AL, Barral A. Evaluation of the histopathological classification of
american cutaneous and mucocutaneous leishmaniasis. Mem Inst Oswaldo
Cruz 1991:26(1):51-6.
Azulay RD. Histopatologia da leishmaniose tegumentar. Dermatol. Iber. Amer.
1960;2:7-15.
Magalhães AV, Moraes MAP, Raick AN, Lhanos-Cuentas A, Costa JML, Cuba
CC, Marsden PD. Histopatologia da leishmaniose tegumentar por Leishmania
braziliensis braziliensis : Padrões histopatológicos e estudo evolutivo das
lesões. Rev do Inst Med Trop São Paulo 1986;28(4):253-62.
Andrade-Narvaez FJ, Medina-Peralta S, Vargas-Gonzalez AB, Canto-Lara SE,
Estrada-Parra S. The histopathology of cutaneous leishmaniasis due to
Leishmania (Leishmania) mexicana in the Yucatan Peninsula, Mexico. Rev Inst
Med Trop São Paulo 2005;47(4):191-4.
Mullis KB, Faloona FA. Specific Synthesis of DNA in vitro via a polymerase
catalyzed chain reaction. Methods in Enzymology 1987;155:335-50.
Rodgers MR, Popper SJ, Wirth DF. Amplification of kinetoplast DNA as a tool in
the detection and diagnosis of Leishmania. Experimental Parasitology 1990;71,
267-75.
Schallig HDFH, Schoone GJ, Kroon CCM, Hailu A, Chappuis F, Veeken H.
Development and application on simple diagnostic tools for visceral
Ieishmaniasis. Med Microbiol Immunol 2001;69-71.
Schallig IS, Oskam L. Molecular biological applications in the diagnosis and
control of leishmaniasis and parasite identification. Trop Med Int Health
2002;7:641-51.
Romero GAS, Lessa H, Orge MGO, Macedo VO, Marsden PD. Mucosal
leishmaniasis treatment with aminosidine sulfate: results of two year follow-up.
Rev Soc Bras Med Trop 1998;31(6):511-6.
Pinero JE, Gonzalez AC, Valladares B, de Grosso ML, Salomon OD Lanus EC.
Detection of Leishmania braziliensis in human paraffin-embedded tissues from
112
99
100
101
102
103
104
105
106
107
108
109
110
Tucuman, Argentina by polymerase chain reaction Mem Inst Oswaldo Cruz
2005;100(2):187-92.
Lanús EC, Piñero JE, González AC, Valladares B, Grosso ML, Salomón
OD.Detection of Leishmania braziliensis in human paraffin-embedded tissues
from Tucumán, Argentina by polymerase chain reaction. Mem Inst Oswaldo
Cruz 2005;100(2):187-92.
Oliveira JGS, Novais FO, Oliveira CI, da Cruz Júnior AC, Campos LF, da Rocha
AC, Boaventura VB, Noronha AB, Costa JML, Barral A. Polymerase chain
reaction (PCR) is highly sensitive for diagnosis of mucosal leishmaniasis. Acta
Tropica 2005;94;55-9.
Pirmez C, da Silva Trajano V, Paes-Oliveira Neto M, da-Cruz AM, Goncalvesda-Costa SC, Catanho M, et al. Use of PCR in diagnosis of human American
tegumentary leishmaniasis in Rio de Janeiro, Brazil. J Clin Microbiol
1999;37:1819-23.
Reithinger R, Dujardin JC, Louzir H, Pirmez C, Alexander B, Brooker S.
Cutaneous leishmaniasis. Lancet Infect Dis 2007;7(9):581-96.
Laskay T, Miko L, T, Solbach W, Röllinghoff M, Frommel D. Detection of
cutaneous Leishmania infection in paraffin-embedded skin biopsies using the
polymerase chain reaction. Trans R Soc Trop Med Hyg 1995;89:273-5.
Andrade RV. Reação em cadeia de polimerase em biópsias de pele
emblocadas em parafina compatíveis com Leishmaniose Tegumentar
Americana a histopatologia, 2007. Dissertação de Mestrado, Universidade do
Estado do Amazonas, Manaus, AM. 56pp.
Libório TN, Etges A, Neves AC, Mesquita RA, Nunes F, D. Evalution of the
genomic DNA extracted from formalin-fixed, paraffin-embedded oral samples
archived for the past 40 anos. J Bras Patol Med Lab. São Paulo
2005;41(6):405-10.
Mimori T , Sasaki J, Nakata M, Gomez E A, Uezato H Nonaka S, et al., Rapid
identification of Leishmania species from formalin-fixed biopsy samples by
polymorphism-specific polymerase chain reaction. Gene 1998;210:179-86.
Garcia AL, Kindt A, Quispe KW, Bermudez H, Llanos A, Arevalo J, Bañuls AL,
De Doncker S, Le Ray D, DuJardin JC. American tegumentary leishmaniasis:
antigen-gene polymorphism, taxonomy and clinical pleomorphism. Infect Genet
Evol 2005;5:109-116.
van der Meide W, Schoone GJ, Faber WR, Zeegelaar JE, de Vries HJC, Özbel
Y, Lai A Fat RFM, Coelho LIARC, Kassi M, Schallig HDFH. Quantitative Nucleic
Acid Sequence-Based Assay as a New Molecular Tool for Detection and
Quantification of Leishmania Parasites in Skin Biopsy Samples. J Clin Microbiol.
2005;43(11):5560–566.
Volpini AC, Passos VMA, Oliveira GC, Romanha AJ. PCR-RFLP to identify
Leishmania (Viannia) braziliensis and L. (Leishmania) amazonensis causing
American cutaneous leishmaniasis. Acta Tropica 90 (2004) 31–37
Fagundes A, Marzochi MCA, Fernandes O, Perez MA, Schubach AO,
Schubach TMP, Amendoeira MRR, Mouta-Confort E, Marzochi KBF. First
113
111
112
113
114
115
116
117
118
119
120
121
122
123
124
125
encounter of subclinical human Leishmania (Viannia) infection in the state of
Rio Grande do Sul, Brazil. Mem Inst Oswaldo Cruz 2007;102(8):1003-5.
Amato VS. Utilização do Isotionato de Pentamidina para o Tratamento da
Leishmaniose Mucosa. Rev Soc Bras Med Trop 1997;30(6):529-30.
Guerra JAO, Ribeiro JAS, Coelho LIARC, Barbosa MGV, Paes MG.
Epidemiologia da Leishmaniose Tegumentar na comunidade São João,
Manaus, Amazonas, Brasil. Cad Saúde Publica 2006;22(11):2319-27.
Vianna GO. Sobre o tratamento da leishmaniose tegumentar. Anais Paulistas
da Faculdade de Medicina e Cirurgia, 1914;2:167-9.
Soto J, Toledo JT. Oral miltefosine to treat new world cutaneous leishmaniasis.
Lancet Infect Dis. 2007 Jan;7(1):7.
Sundar S, Rosenkaimer F, Makharia MK, Goyal AK, Mandal AK, Voss A, et al.
Trial of oral miltefosine for visceral leishmaniasis. Lancet 1998;352:1821-3.
Gamier T, Croft SL. Topical treatment for cutaneous leishmaniasis. Curr Opin
Investig Drugs 2002;3:538-44.
Hepburn NC. Management of cutaneous leishmaniasis. Curr. Opin. Infect. Dis.
2001;14:151-4.
Amato VS, Tuon FF, Siqueira AM, Nicodemo AC, Amato Neto V. Treatment of
Mucosal Leishmaniasis in Latin America: Systematic Review. Am J Trop Med
Hyg 2007;77(2):266–74.
Guerra JAO, Paes MG, Souza FHC, Lopes NP, Talhari JM, Garrido M. et al.
Tratamento de 97 casos de Leishmaniose Tegumentar com Pentamidina. An.
XV Cong. Bras. Parasitologia., Salvador (BA), 167 p., 1997.
Lai AFEJSK, Vrede MA, Soetosenojo RM, Lai AFRFM. Pentamidine, the drug of
choice for the treatment of Amenican cutaneous leishmaniasis in Surinam. lnt.
J. Dematol 2002;41:796–800.
Paes MG, Guerra JAO, Menezes JV, Talhari JM e Talhari S. Paraefeitos ao
tratamento com Stibogluconato de Sódio em pacientes com Leishmaniose
Tegumentar Cutânea em Manaus (AM). In: An. XV Cong. Bras. Parasitologia.,
Salvador (BA), 164-164 p., 1997a.
Paes MG, Talhari S, Guerra JAO, Lopes NP, Souza FHC, Orsi AT et al.
Experiência com Pentamidina em Leishmaniose Tegumentar no IMT-AM Fatores predisponentes ao adoecimento e complicações na doença mucosa.
In: An. XXXIII Cong. Soc. Bras. Med. Trop., Belo Horizonte (MG), p180-181,
1997b.
Talhari S, Sardinha JC, Schettini APM. Tratamento da leishmaniose tegumentar
americana. Resultados preliminares com a pentamidina. Anais Brasileiros de
Dermatologia 6:361-364, 1985.
Amato VS, Duarte MIS, Nicodemo AC. Pagliari C, Matta VLR, Oliveira LS, et
al., An Evaluation of clinical, serologic, anatomopathologic and
immunohistochemical findings for fifteen patients with mucosal leishmaniasis
before and after treatment. Rev. Inst. Med. trop. S. Paulo 1998; 40(1):23-30.
De Paula, Ribeiro CD, Sampaio JH, Duarte C, Rizzo D. et al. Estudo
comparativo da eficácia de isotionato de pentamidina administrada em três
114
126
127
128
129
130
131
132
133
134
135
136
137
138
doses durante uma semana e de N-metil-glucamina 20mgSbV/kg/dia durante
20 dias para o tratamento da forma cutânea da leishmaniose tegumentar
americana. Rev Soc Bras Med Trop 2003;36:(3)365-71.
Guthmann JP, Arlt D, Garcia LM, Rosales M, de Jesus Sanchez J, Alvarez E,
Lonlas S, Conte M, Bertoletti G, Fournier C, Huari R, Torreele E, LlanosCuentas A. Control of mucocutaneous leishmaniasis, a neglected disease:
results of a control programme in Satipo Province, Peru Trop Med Int Health.
2005;10(9):856-62.
Campbell-Lendrum D, Dujardin JP, Martinez E, Feliciangeli MD, Perez JH,
Silans LNMP, Desjeux F. Domestic and peridomestic transmission of American
Cutaneuous Leishmaniasis: Changing epidemiological patterns present new
control oportunities. Mem. Inst. Oswaldo Cruz 2001;96(2):159-62.
Guerra JAO, Talhari S, Paes MG, Garrido M, Talhari JM. Aspectos diagnósticos
da Leishmaniose Tegumentar Americana em militares simultaneamente
expostos á infecção na Amazônia. Rev Soc Bras Med Trop 2003;36(5):587-90.
Handman E. Leishmaniasis: current status on vaccine development. Clin Microb
Reviews 2001;14:229-43.
The World Health Report, 2001, Geneva: Leishmaniasis. World Health
Organization; 2001.
Mayrink W, Costa CA, Magalhães PA, Melo MN, Dias N, Oliveira Lima AB,
Michalick MS, Williams P. A field trial of a vaccine against American dermal
leishmaniasis Am j Trop Med Hig. 1979;73(4):385-87.
Silveira FT, Duarte ERL, De-Farias ECF, Ikeda CS, Lopes AP, Chagas EJP,
Teixeira LM, Ishikawa EA. Leishmaniose mucosa na Amazônia brasileira:
Avaliação, retrospectiva, dos aspectos clínicos e epidemiológicos da doença,
com ênfase ao estado do Pará. Rev Soc Bras Med Trop 1999;32 (Supl.I):9.
Lainson R, Shaw JJ, Silveira FT, Braga RR, Ryan L, Póvoa MM, Ishikawa EA.
A Leishmania e as leishmanioses. In Instituto Evandro Chagas; 50 Anos de
Contribuição às Ciências Biológicas e à Medicina Tropical, Fundação Serviços
de Saúde Pública, Belém, 1986;p. 83-124.
Pajot FX, Le Pont F, Gentile B, Besnard R Epidemiology of leishmaniais in
French Guiana. Trans R Soc Trop Med Hyg 1982;76:112-3.
Arias, J. R. & Freitas, R. A. 1978. Sobre os vetores da leishmaniose cutanea na
Amazônia Central do Brasill. 2: incidência de flagelados em fllebótomos
selváticos. Acta Amazônica. 8(3):387-196.
Arias, J. R. & Freitas, R. A. 1977a. On the vectors of cutaneus Leishmaniasis in
Central Amazon of Brazil. Acta Amazônica. 7:293-294.
Guerra JAO, Onety AC, Santos FGC, Santos LS, Talhari S, Paes MG. Situação
da Leishmaniose em Manaus na última década. Rev Soc Bras Med Trop
2001;34(Supl 1):224.
Boeken GH. New World Tegumental Leishmaniasis in Brazil: with special
reference to the situation of the disease in Manaus, Central Amazon Basin.
Dissertação de Mestrado. University of London / Instituto de Medicina Tropical
de Manaus (IMTM-AM). Londres, 1996.
115
139 Guerra JAO, Coutinho JC, Aguila M, Monteiro WM, Albuquerque BC, Aguiar
GA, Lopes LD, Coelho LI, Machado YS, Barbosa MV. Epidemiologia da
leishmaniose tegumentar americana no Estado do Amazonas no periodd de
janeiro de 2001 a dezembro de 2006. Rev Soc Bras Med Trop 2009;42:(1)351.
140 Barbosa MGV, Fé NF, Marcião AHR, Silva APT, Monteiro WM, Guerra JAOG.
Fauna de flebotomíneos (Diptera: Psychodidae) em um foco de leishmaniose
tegumentar americana na área periurbana de Manaus, Estado do Amazonas.
Rev Soc Bras Med Trop 2008;41;485-91.
141 Guerra JAO, Paes MG, Coelho LIARC, Barros MLB, Fé NF, Barbosa MGV,
Guerra MVF. Estudo de dois anos com animais reservatórios em área de
ocorrência de leishmaniose tegumentar americana humana em bairro de
urbanização antiga na cidade de Manaus-AM, Brasil. Acta Amaz 2007;37(1):337.
142 Guerra JAO, Barbosa MGV, Loureiro ACSP, Pinheiro CC, Rosa GG, Coelho
LIARC. Leishmaniose Tegumentar Americana em crianças: aspectos
epidemiológicos de casos atendidos em Manaus, Amazonas, Brasil. Cad
Saúde Pública 2007;23(9):2215-23.
143 Fé NF, Guerra JAO, Barbosa MGV, Fé FA, Paes MG, Martins VJ, Nakaoca RT,
Tagliani LAA, Baldez MAG. Espécies de Flebotomíneos numa área de
transmissão da Leishmaniose Tegumentar Americana (LTA), Cacoal/Rondônia.
2002;35:308-8.
144 Natal da Silva, Araguacy B Viana, José A Cordeiro e Carlos E Cavasini.
Leishmaniose tegumentar americana no Estado do Acre, Brasil. Rev. Saúde
Pública 1999;33(6):554-9.
145 Shaw JJ, De Faria DL, Basano SA, Corbett CE, Rodrigues CJ, Ishikawa EA,
Camargo LM. The aetiological agents of American cutaneous leishmaniasis in
the municipality of Monte Negro, Rondônia state, western Amazonia, Brazil.
Ann Trop Med Parasitol. 2007 Dec;101(8):681-8.
146 Camuset G, Remy V, Hansmann Y, Christmann D, Gomes de Albuquerque C,
Sena Casseb GA. Mucocutaneous leishmaniasis in Brazilian Amazonia. Med
Mal Infect. 2007;37(6):343-6.
147 Fundação
IBGE.
Censo
demográfico
2004.
Disponível
em
http://www.ibge.gov.br/home/ acessado em 22/08/09.
148 Reed SG, Badaró R, Masur H, Carvalho EM, Lorenço R, Lisboa A, Teixeira R,
Johnson WD, Jones TC. Selection of a skin test antigen for American visceral
leishmaniasis. Am J Trop Med Hyg 1986;35:79-85.
149 Boaventura VS, Cafe V, Costa J, Oliveira F, Bafica A, Rosato A, de Freitas LA,
Brodskyn C, Barral-Netto M, Barral A. Concomitant early mucosal and
cutaneous leishmaniasis in Brazil. Am J Trop Med Hyg 2006;75(2):267-9.
150 Reale, S., Maxia, L., Vitale, F., Glorioso, N.S., Caracappa, S., Vesco, G.
Detection of Leishmania infantum in Dogs by PCR with Lymph Node Aspirates
and Blood. Journal of Clinical Microbiology v.37, n. 9, p. 2931–2935, 1999.
116
151 Marfurt J, Niederwieser I, Makia ND, Beck HP, Felger I. Diagnostic genotyping
of Old and New World Leishmania species by PCR-RFLP. Diagnostic
Microbiology and Infectious Disease. v46 (2003) 115–124.
152 Paes MG, Guerra JAO. Leishmanioses, in: Manual de Rotinas da Fundação de
Medicina Tropical do Amazonas/Lacerda MVG, Mourão MPG, Tavares AM.
Manaus: Fundação de Medicina Tropical do Amazonas (FMT/IMT-AM), 2003.
200 p. 135-40.
153 Marsden PD, Llanos-Cuentas A, Lago EL, Cuba CAC, Barreto AC, Costa JM,
Jones TC. Human mucocutaneous leishmaniasis in Três Braços, Bahia, Brazil
An area of Leishmania braziliensis braziliensis transmission III Mucosal
disease: presentation and initial evolution Rev Soc Bras Med Trop
1984;17:179—86. 42.
154 Saravia NG, Weigle K, Segura I, Giannini SH, Pacheco R, Labrada LA,
Goncalves A. Recurrent lesions in human Leishmania braziliensis infectionreactivation or reinfection? Lancet 18;336(8712):398-402, 1990.
155 Schriefer A, Guimarães LH, Machado PR, Lessa M, Lessa HA, Lago E, Ritt G,
Góes-Neto A, Schriefer AL, Riley LW, Carvalho EM. Geographic clustering of
leishmaniasis in northeastern Brazil. Emerg Infect Dis. 2009 Jun;15(6):871-6.
156 Schleucher RD, Zanger P, Gaessler M, Knobloch J (2008) Successful diagnosis
and treatment 50 years after exposure: is mucocutaneous leishmaniasis still a
neglected differential diagnosis? J Travel Med 15: 466-467.
157 Silveira FT, Lainson R, De Castro Gomes CM, Laurenti MD, Corbett CE.
Immunopathogenic competences of Leishmania (V.) braziliensis and L. (L.)
amazonensis in American cutaneous leishmaniasis. Parasite Immunol. 2009
Aug;31(8):423-31.
158 Carvalho EM, Johnson WD, Barreto E, Marsden PD, Costa JL, Reed S, Rocha
H. Cell mediated immunity in American cutaneous and mucosal leishmaniasis. J
Immunol. 1985;135:4144–8.
159 Weigle KA, Labrada LA, Lozano C, Santrich C, Barker DC. PCR-based
diagnosis of acute and chronic cutaneous leishmaniasis caused by Leishmania
(Viannia). J Clin Microbiol. 2002 Feb;40(2):601-6.
160 Oliveira-Neto MP, Mattos M, Pirmez C, Fernandes O, Gonçalves-Costa SC,
Souza CF, Grimaldi G Jr. Mucosal leishmaniasis ("espundia") responsive to low
dose of N-methyl glucamine (Glucantime) in Rio de Janeiro, Brazil. Rev Inst
Med Trop Sao Paulo. 2000 Nov-Dec;42(6):321-5.
161 Dimier-David L, David C, Ravisse P, Bustillos R, Revollo S, Lyèvre P, Muñoz M,
Vargas F, Dedet JP. Parasitological diagnosis of mucocutaneous leishmaniasis
due to Leishmania b. braziliensis in Bolivia. Rev Soc Bras Med Trop. 1991 OctDec;24(4):231-4.
162 Furtado T. Critérios para o diagnóstico da leishmaniose tegumentar americana.
An Bras Dermatol 1980;52:81-86.
163 Romero GAS, Guerra MVF, Paes MG, Macêdo VO 2001. Comparison of
cutaneous leishmaniasis due to Leishmania (Viannia) braziliensis and L. (V.)
117
guyanensis in Brazil: clinical findings and diagnostic appprach. Clin Infect Dis
32: 1304-1312.
164 Barroso-Freitas AP, Passos SR, Mouta-Confort E, Madeira MF, Schubach AO,
Santos GP, Nascimento LD, Marzochi MC, Marzochi KB. Accuracy of an ELISA
and indirect immunofluorescence for the laboratory diagnosis of American
tegumentary leishmaniasis. Trans R Soc Trop Med Hyg. 2009 Apr;103(4):3839.
165 Faber WR, Oskam L, van Gool T, Kroon NC, Knegt-Junk KJ, et al. Value of
diagnostic techniques for cutaneous leishmaniasis. J Am Acad Dermatol 49: 7074.
166 García AL, Parrado R, Rojas E, Delgado R, Dujardin JC, Reithinger R.
Leishmaniases in Bolivia: comprehensive review and current status. Am J Trop
Med Hyg. 2009 May;80(5):704-11.
118
8 ANEXOS
8.1 Ficha clínica (roteiro de coletas de dados e exame físico)
Leishmaniose Cutâneo Mucosa - Estudo Retrospectivo / Prospectivo de pacientes
atendidos na Fundação de Medicina Tropical do Amazonas
119
120
8.2 Termo de Consentimento Livre e Esclarecido (TCLE)
TÍTULO: “Leishmaniose Cutaneo Mucosa - Estudo Retrospectivo / Prospectivo De
Pacientes Atendidos Na Fundação De Medicina Tropical Do Amazonas”
Investigador: JORGE AUGUSTO DE OLIVEIRA GUERRA
Instituição: Fundação de Medicina Tropical do Amazonas
Patrocinador: FMTAM/UEA/SUFRAMA N.º de protocolo: ______
O abaixo assinado ou sob responsabilidade do seu parente próximo abaixo
identificado ou, nos casos necessários, sob a responsabilidade do investigador ou
médico que assina este documento, declara estar ciente após ter lido ou ouvido o
presente Termo de Consentimento que lhe informa o seguinte:
I.
Que está participando de um estudo que tem por finalidade avaliar a
ocorrência da Leishmaniose Mucosa, doença da qual eu, ou a pessoa pela qual sou
responsável, é portadora;
II.
Que a participação neste estudo é voluntária, assim como a sua recusa não
haverá qualquer tipo de retaliação ou perda de benefícios a que o responsável ou
seu dependente tenham direito;
III.
Que, havendo concordância para a participação no estudo, se procederá às
seguintes condutas:
1Preenchimento da ficha individual e um questionário (constando de dados
relativos à doença);
2em caso de lesões sugestivas de LTA/ Leishmaniose Mucosa, poderão ser
coletados 10 ml de sangue da veia, com seringas descartáveis, para realização de
testes sorológicos, e exames de rotina para avaliar o estado do paciente em relação
ao tratamento e o tipo de medicação a ser utilizada e o acompanhamento da
doença. A retirada de sangue implica em dor pela picada da agulha no momento da
coleta;
3para confirmação do diagnóstico se procederá a coleta de exames com os
procedimentos recomendados pelo Ministério da Saúde (MS Brasil, 1996) através de
biópsia de lesão mucosa para: Pesquisa direta de Leishmania; Histopatologia das
lesões; Isolamento do parasito em meios de cultura e inoculação em “hamster” e
PCR;
IV.
que, participando do estudo, o paciente ou a família não obterão quaisquer
benefícios adicionais além dos já citados (diagnóstico da infecção e/ou doença), que
entretanto estarão contribuindo para o conhecimento da Leishmaniose em Manaus;
V.
que a biópsia é um procedimento utilizado de rotina no diagnóstico da
Leishmaniose Mucosa e implica em dor local, apenas para aplicação de anestesia e
posterior retirada de fragmento de pele com material esterilizado, obedecendo todas
121
as normas de segurança e assepsia e que poderá ocorrer sangramento em pequena
quantidade. A realização da biópsia de pele será feita apenas por médicos ou
acadêmicos de medicina sob supervisão dos médicos participantes do referido
projeto;
VI.
que após o diagnóstico será feito tratamento com os medicamentos indicados
pelo Ministério da Saúde – Brasil (antimoniais , pentamidina ou anfotericina B) de
acordo com a necessidade de cada caso, a critério do médico que me assiste;
VII. que o material retirado do paciente (sangue ou fragmento de mucosa ou pele)
por biópsia se destina apenas a pesquisa constante do protocolo, mas que o
material retirado soro e biópsia ficará estocado nas gerencias de Leishmaniose e
patologia da FMTAM e concordo que seja utilizado para outras pesquisas
envolvendo esta doença, como aspetos diagnósticos, estudos imunológicos, e ou
isolamento de espécies;
VIII. que o projeto poderá ser encerrado caso ocorram efeitos adversos além dos
esperados e que posam prejudicar o sujeito da pesquisa;
IX.
que a participação neste estudo será confidencial e os registros ou resultados
dos testes relacionados ao estudo serão mostrados apenas aos participantes e aos
representantes da FMTAM, bem como a autoridades normativas estaduais ou
nacionais, com o objetivo de garantir informações de pesquisas clínicas ou para fins
normativos. A identidade dos participantes permanecerá sempre em confiabilidade.
O patrocinador assegura que isso acontecerá de acordo com as normas legais
reguladoras de proteção nacionais ou internacionais;
X.
que o participante e seus familiares têm direitos a ressarcimento de gastos ou
indenizações por prejuízos que porventura possam acontecer em decorrência de
sua participação neste estudo, assim como de toda assistência médica garantida
pela FMTAM;
XI.
que o participante e seus familiares têm direitos aos esclarecimentos que
julgarem necessários a qualquer período do desenvolvimento deste estudo e será
notificado sobre qualquer nova informação relacionada. A Dr. JORGE AUGUSTO DE
OLIVEIRA GUERRA, cujo número de telefone é 9988 32 15 ou 238 17 11 R 212,
terá disponibilidade para atender e esclarecer possíveis dúvidas dos participantes;
XII. que o participante tem o direito de se retirar deste estudo a qualquer
momento, sem qualquer retaliação, e também o direito de manter em seu poder
cópia assinada deste documento;
XIII. que, por estar devidamente esclarecido sobre o conteúdo deste termo,
livremente expressa seu consentimento e/ou do seu responsável para inclusão como
participante nesta pesquisa.
Data: ....../....../......
..................................................................
Nome do paciente
.........
Idade
........
sexo
Assinatura do paciente ou responsável: ....................................................................
122
Nome do médico: JORGE AUGUSTO DE OLIVEIRA GUERRA
Assinatura do médico: ...............................................................................................
Impressão dactiloscópica
(p/ analfabeto)
123
8.3 Distribuição dos casos de LM por município de ocorrência
8.4 Distribuição dos casos de LM por faixa etária
60
No. pacientes
50
40
Prospectivo
Retrospectivo
Total
30
20
10
0
Faixa etária
Download