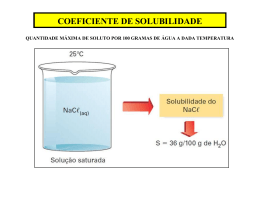
Aula Química 28 Produto de Solubilidade Pré - Vestibular Aluno: Data: Professor: OTON DE OLIVEIRA e-mail: [email protected] Produto de solubilidade Os rins excretam natural e continuamente substâncias de baixa solubilidade. Quando a urina se satura, essas substâncias cristalizam-se, originando cálculos ou, popularmente, pedras nos rins. Para não haver saturação da urina com essas substâncias, urologistas recomendam ingestão de muito líquido. Considere-se a solução saturada, com corpo fundo, de PbCl2, sistema heterogêneo, portanto. Para um sal genérico, tem-se: Bx A y xB + + yA – e ps = [B +] x . [A –] y Cl –(aq) Pb +2 (aq) Produto de solubilidade do eletrólito é o produto da concentração de seus íons, expresso em mols por litro na solução saturada, quando cada mol é elevado a potências iguais aos seus coeficientes na fórmula do eletrólito, a determinada temperatura. Íons em solução Cl –(aq) PbCl 2(s) (corpo de chão) Pela ilustração é possível perceber: o cloreto de chumbo II adicionado à água dissolve-se até atingir seu coeficiente de solubilidade. O corpo de fundo (sólido não-dissolvido) permanece, então, inalterado no fundo do recipiente. Estabelece-se o equilíbrio da seguinte maneira: PbCl 2 V1 V2 Corpo de fundo Pb +2(aq) + 2 Cl–(aq) Valores do PS de algumas substâncias Íons em solução Nome Quando V 1 = V 2, atinge o equilíbrio, ou seja, o número de partículas que se dissociam é o mesmo das que se precipitam, permanecendo solução saturada. Pode-se escrever, então, a constante de equilíbrio. No exemplo analisado: PbCl2 Pb +2(aq) + 2 Cl–(aq) [Pb +2 ] . [Cl − ]2 K= [PbCl 2 ] Como a concentração do corpo de fundo é constante, tem-se: K . [PbCl2] = [Pb +2] . [Cl–] 2 ou ps = [Pb +2] . [Cl–] 2 Constante de solubilidade = ps = K s = K ps Centro de Ensino Podium - 3225 1430 - 3217 9607 Quanto menor o ps, menos solúvel o eletrólito. Os valores de ps permanecem constantes, sendo definidos para soluções saturadas e de eletrólitos pouco solúveis. Mudando-se a temperatura, o valor de ps também muda, considerando que o coeficiente de solubilidade varia com a temperatura. 1 Fórmula PS Cloreto de chumbo II PbCl 2 2 . 10 –5 Sulfato de cálcio CaSO 4 9 . 10 –6 Hidróxido de cálcio Ca(OH) 2 4 . 10 –6 Carbonato de cálcio CaCO 3 3 . 10 –9 Sulfato de bário BaSO 4 1 . 10 –10 Sulfeto de cádmio CdS 8 . 10 –27 Hidróxido de alumínio Al(OH) 3 1 . 10 –33 Sulfato de cobre CuS 4 . 10 –36 Hidróxido de ferro III Fe(OH) 3 4 . 10 –40 Sulfeto de bismuto Bi 2S 3 1 . 10 –97 Cursinho Pró Concursos 1. (Fuvest—SP) O equilíbrio de dissolução do fosfato de cálcio é representado por 6. Calcule a variança do sistema e assinale a alternativa correta. Fe 3 O 4 + 4 H 2 (700°C) 3 Fe + 4 H 2O 3 Ca 2+ (aq) + 2 PO 43– (aq) Ca 3 (PO 4 ) 2(s) a) b) c) A expressão do produto de solubilidade correspondente é: a) b) c) Ca2+] 3–] d) e) [2 PO4 Kps = [3 Kps = [Ca2+]2 [PO43–]3 Kps = [Ca2+] [PO43–] Ca2+] 3–]2 Kps = [3 [PO4 Kps = [Ca2+]3 [PO43–]2 2. (UFS—SE) O produto de solubilidade do fosfato de prata, Ag 3PO 4, é expresso pela relação: a) b) c) [Ag +] 3 [PO 43– ] 3 [Ag +] [PO 43– ] 3 [Ag +] + [PO 43– ] d) e) a) b) 10 +10 10 +5 10 –5 10 –10 c) d) e) 10 –20 d) e) 4 5 7. Um sistema, cujo componente é apenas água, constitui-se de H 2 O no estado líquido e três cubos de gelo. Assinale a alternativa correta. a) b) c) d) e) 3 [Ag +] – [PO 43– ] 3 [Ag +] / [PO 43– ] 3. (Fuvest—SP) O produto de solubilidade do BaSO 4 vale 1,0 . 10 –10 a 25°C. Nessa temperatura, a quantidade, em mol, de BaSO4 que se dissolve em 1 dm3 de água pura é, aproximadamente: 1 2 3 O sistema é do tipo heterogêneo com quatro fases. O sistema é do tipo heterogêneo com uma fase. A variança do sistema é 05. O sistema é X_]_W^U_RYVvcYS_. O grau de liberdade no sistema é zero. 8. (Fuvest—SP) A determinada temperatura, a solubilidade do sulfato de prata em água é 2,0 . 10 –2 mol/l. O produto de solubilidade (K ps) desse sal à mesma temperatura é: a) b) c) 4,0 . 10 –4 8,0 . 10 –4 6,4 . 10 –5 d) e) 3,2 . 10 –5 8,0 . 10 –6 4. (UEL—PR) A adição de cianeto de sódio sólido em água estabelece o equilíbrio químico: CN 1– (aq) + H 2O (l) HCN (aq) + OH 1– (aq) 9. (EEM—SP) Adicionando 10 g de um sal, de fórmula geral X2Y, em 1 000 ml de água, obtêm-se como corpo de fundo 9,9667 g do sal. Calcule o produto de solubilidade do X 2Y. A constante de equilíbrio é conhecida como: a) b) c) d) e) 5. produto iônico da água, K W . produtos de solubilidade, K PS . produto de ionização de ácido, K a. constante de dissociação de base, K b. constante de hidrólise do sal, K h. Dados: peso íon X + = 108; Y –2 = 118 a) b) c) Considerando os equilíbrios representados: FeS (s) HgS (s) 1 Fe +2 (aq) + S –2(aq) 2 Hg+2 (aq) + S –2 (aq) K S = 6,0 . 10 –18 (25°C) 10 –52 (25°C) K S = 1,0 . e a alta solubilidade do sulfeto de sódio (Na 2 S), assinale a alternativa correta. a) b) c) d) e) A adição de Na 2 S provoca um deslocamento para a esquerda nos equilíbrios 1 e 2. FeS é menos solúvel que HgS. HgS é mais solúvel que FeS. A adição de Na 2 S provoca um deslocamento para a direita nos equilíbrios 1 e 2. HgS é mais solúvel que FeS, e a adição de Na 2S não altera o equilíbrio 2. 10 –8 10 –12 4 . 10 –8 d) e) 4 . 10 –12 2 . 10 –12 10. (Unicamp—SP) Para fazer exames de estômago usando a técnica de raios-X, os pacientes devem ingerir, em jejum, uma suspensão aquosa de sulfato de bário, BaSO 4, que é pouco solúvel em água. Essa suspensão é preparada em uma solução de sulfato de potássio, K 2SO 4, que está totalmente dissolvido e dissociado na água. Os íons bário, Ba2+, são prejudiciais à saúde humana. A constante do produto de solubilidade do sulfato de bário em água a 25°C é igual a 1,6 . 10 –9 . a) Calcule a concentração de íons bário dissolvidos numa suspensão de BaSO 4 em água. b) Por que, para a saúde humana, é melhor fazer a suspensão de sulfato de bário em uma solução de sulfato de potássio do que em água apenas? Considere que o K 2SO 4 não é prejudicial à saúde. Produto de solubilidade 1. 2. e a 3. 4. c e Centro de Ensino Podium - 3225 1430 - 3217 9607 5. 6. 7. 8. a b 2 d d 9. d Cursinho Pró Concursos
Baixar