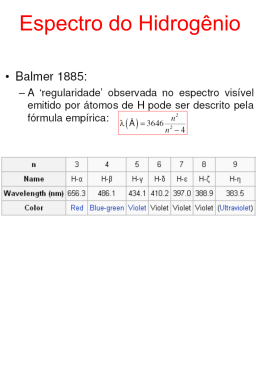
Modelos Atômicos Leucipo e Demócrito (400 a.c.) Defenderam a idéia (não cientifíca) de que a matéria era composta por pequeníssimas partículas indivisíveis e vácuo. (Matéria Descontínua). Átomo Demócrito (460 – 370 A.C.) Modelo baseado apenas na intuição e na lógica. Modelo proposto por Demócrito: Toda a matéria é constituída por átomos e vazio; O átomo é uma partícula pequeníssima, invisível,e que não pode ser dividida; Os átomos encontram-se em constante movimento; Universo constituído por um número infinito de átomos, indivisíveis e eternos; Aristóteles (Sec. V a.c.) Modelo de Demócrito foi rejeitado por um dos maiores filósofos de todos os tempos – Aristóteles. Aristóteles acreditava que a matéria era contínua e composta por quatro elementos: Ar Água Terra Fogo Aristóteles (384 a.C. - 322 a.C.) O Modelo de Demócrito permaneceu na sombra durante mais de 20 séculos... Dalton (1808) Séc. XIX – Dalton “ressuscita” A Teoria Atômica. Na segunda metade do séc. XVIII, a Química sofreu uma grande evolução. Certos fatos não podiam ser explicados pela teoria de Aristóteles, como a Lei de Lavoisier: “A massa dos reagentes é igual à massa dos produtos”. John Dalton (1776 – 1844) Para explicar estes fatos Jonh Dalton propôs, em 1803, o primeiro modelo atômico científico. Modelo proposto por Dalton (“bolinha de bilhar”): A matéria é composta por pequenas partículas, maciças e indivisíveis – os Átomos; Os átomos de um mesmo elemento são idênticos em massa e em todas as outras propriedades; Átomo (bolinha maciça e indivisível) A matéria é formada pela união de diferentes átomos em proporções definidas. Modelo proposto por Dalton (“bolinha de bilhar”): Elementos diferentes possuem átomos diferentes, massas diferentes Os átomos são indestrutíveis Uma reação química na verdade é uma reorganização dos átomos já existentes. Átomo (bolinha maciça e indivisível) Consegue Ponderais explicar as Leis 1875 Crookes: Ampola de Vidro •Tela de sulfeto de zinco torna os raios catódicos Luminescentes. Thomson (1897) Thomson realizou uma série de experiências utilizando um tubo de raios catódicos (tubo semelhante aos tubos existentes no interior dos televisores). J. J. Thomson Neste tubo, eram efetuadas descargas elétricas através de um gás rarefeito. (1856 - 1940) Tubo de raios catódicos Descoberta dos Elétrons: Ao estudar as descargas no interior deste aparelho, Thomson, descobriu o elétron. fluorescência esverdeada (feixe de partículas de carga negativa) sai dos átomos do cátodo (-) em direção ao ânodo (+). Raio fluorescente tinha carga elétrica negativa e era de natureza corpuscular. A sua massa era muito menor que a massa de qualquer átomo conhecido – eram os elétron. Thomson provou que os elétron eram corpúsculos, dotados de carga elétrica e de massa, que fazem parte de toda a matéria. Modelo proposto por Thomson: Esfera com carga elétrica positiva O átomo era uma esfera maciça de carga elétrica positiva, estando os elétron dispersos na esfera. Elétrons (partículas com carga elétrica negativa) O número de elétron seria tal que a carga total do átomo seria zero. Modelo do Pudim de Passas Importância do modelo de Thomson: Explica a condutividade elétrica da matéria; Constatação da existência de partículas subatômicas. Rutherford (1911) Cientista neozelandês, estudou com Thomson. Nobel de Química em 1908. Em 1910 realizou uma experiência que lhe permitiu propor um novo modelo atômico. Ernest Rutherford (1871 - 1937) Experiência de Rutherford Feixe de partículas Anteparo fluorescente Fonte de partículas (Polônio) Folha de ouro Experiência de Rutherford Experiência de Rutherford Resultados previstos segundo o modelo de Thomson: As partículas α não deveriam atravessar as folhas de ouro. Resultados obtidos: ● ● ● ● ● ● ● ● A maior parte das partículas α atravessavam a lâmina, mas um significativo número delas sofria desvios acentuados. Resultados da experiência de Rutherford Partículas α Existe, no interior do átomo, uma região central positiva – o núcleo, que exerce fortes forças repulsivas sobre as partículas alfa. Conclusões de Rutherford: O átomo é uma estrutura praticamente vazia, e não uma esfera maciça; É constituído por: • Núcleo muito pequeno com a carga positiva, onde se concentra quase toda a massa do átomo (maciço). • Elétron com carga negativa movendose em volta do núcleo. O átomo seria um sistema semelhante ao sistema solar. Modelo Planetário Falhas do modelo de Rutherford: 1. De acordo com o que se conhecia, o elétron ao realizar a sua órbita perderia energia acabando por cair sobre o núcleo, ocasionando um colapso. 2. Cargas em movimento perdem energia emitindo radiação, mas os átomos no seu estado normal não emitem radiação. Max Planck (1900) Princípio da Dualidade da Luz * A luz é onda-partícula E = h . ƒ E : energia (J) h : constante de Planck Max Planck (1858-1947 ) Pai da Física Quântica (h = 6,63.10-34 J) ƒ : frequência (s-1) Max Planck (1900) Princípio da Dualidade da Luz * A luz é onda-partícula c = λ . ƒ c : velocidade da Luz (c = 3.108 m/s ) λ : comprimento de onda (m) f : frequência (s-1) Espectro Conjunto de Ondas Exemplos: Ondas do mar, Som, Onda sísmica, Luz, Ondas de rádio, Raio X. Espectro da Luz Se a luz de uma lâmpada comum atravessa um prisma, ela será decomposta em varias cores, obtemos assim o espectro da luz visível: Bohr (1913) Niels Bohr trabalhou com Thomson, e posteriormente com Rutherford. Niels Bohr (1885 - 1962) Tendo continuado o trabalho destes dois físicos, aperfeiçoou, em 1913, o modelo atômico de Rutherford. Modelo Atômico de Bohr 1º Postulado: A eletrosfera do átomo está dividida em regiões denominadas níveis ou camadas, onde os elétrons descrevem órbitas circulares estacionárias, de modo a ter uma energia constante (“quantum”), ou seja, não emitem nem absorvem energia. Modelo Atômico de Bohr 2º Postulado: Fornecendo energia (térmica, elétrica,...) a um átomo, um ou mais elétrons a absorvem e saltam para níveis mais afastados do núcleo (mais energéticos). Ao voltarem ás suas órbitas originais, devolvem a energia absorvida em forma de luz (fóton). SALTO QUÂNTICO Modelo Atômico de Bohr Explicação para a luz emitida pelos fogos artifício Conceitos Importantes • Estado Fundamental Os e- estão nas suas devidas posições; Situação de maior estabilidade (menor energia). • Estado Excitado Os e- não estão nas suas devidas posições; Situação de menor estabilidade (maior energia). Modelo Atômico de Bohr EXPLICA O ESPECTRO DISCRETO DE ENERGIA DOS ELEMENTOS * Devido aos diferentes níveis de energia, há diferentes possibilidades de transições. n=3 n=2 n=1 * Cada transição implica numa emissão com freqüência diferente. Isso explica o surgimento das linhas no espectro dos elementos. Cada transição corresponde a uma cor no espectro abaixo. Modelo Atômico Atual 1916 – Sommerfeld • Os e- giram ao redor do núcleo em órbitas elípticas; • A eletrosfera está dividida em subníveis. Modelo Atômico Atual 1924 – Broglie • Princípio da Dualidade do elétron; • O e- é onda-partícula. Modelo Atômico Atual 1926 – Heisenberg • Princípio da Incerteza; • É impossível calcular com exatidão a posição e a velocidade do e- num dado instante. Modelo Atômico Atual 1927 - Schrödinger Erwin Schrödinger (1887 – 1961) • Os e- não possuem uma trajetória bem definida em torno do núcleo (Nuvem eletrônica) • Orbital Atômico é a região de maior probabilidade de se encontrar o elétron. Nuvem eletrônica... Modelo da Nuvem Eletrônica • Os e- movem-se de forma desconhecida com velocidade elevadíssima; • O movimento do elétron passou a ser descrito por uma nuvem eletrônica; • Quanto mais densa é a nuvem, maior é a probabilidade de se encontrar aí o e-; • A nuvem é mais densa próximo do núcleo, e menos densa longe do núcleo. Orbitais ESFÉRICOS HALTERES Modelo Atômico Atual 1932 - Chadwick • Até 1920 o núcleo era considerado uma esfera maciça de carga positiva • Átomos do mesmo elemento químico apresentam massas diferentes. + + • Descoberta do Nêutron. + Os Quarks... próton nêutron O Nêutron e o próton não são partículas indivisíveis. No seu interior existem ainda outras partículas que são os quarks. Evolução do Modelo atómico… Modelo de Demócrito Modelo de Dalton Modelo de Thomson Modelo de Rutherford Modelo da Nuvem Eletrônica Modelo de Bohr Dimensão dos átomos 100 pm 1 pm = 10-12 m Dimensão dos átomos Um ponto final pode conter mais de 3 milhões de átomos. Se 100 milhões de pessoas se reduzissem ao tamanho de átomos, formavam uma fila de apenas 1cm.
Download