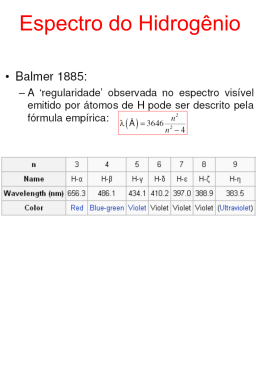
“NA MARCA DA QUALIDADE” QUÍMICA 2 Prof.MHsp ... Estrutura Atômica ÁTOMO: o desenvolvimento de uma idéia. O átomo é a partícula que representa um determinado elemento químico. O desenvolvimento da Química como ciência deu-se ao acatar e desenvolver esse conceito e no trabalho de definir as propriedades físicas e químicas dos mesmos. Nas culturas grega e hindu (há mais de 2500 anos) pregava-se que o universos era formado de quatro elementos fundamentais: Fogo, ar, terra e água. A=não TOMO=divisão ÁTOMO: cultura grega. 450 a.C. – Leucipo de Mileto: A matéria pode se dividir em partículas cada vez menores até atingir uma partícula fundamental, minúscula e indivisível. 400 a.C. – Demócrito de Abdera: Denominação átomo para a menor partícula de matéria. Considerado o pai do atomismo grego. EVOLUÇÃO DOS MODELOS 350 a.C. – Aristóteles: A descontinuidade da matéria: os quatro elementos fundamentais (a água, o fogo, o ar e a terra). Apesar de errado, o conceito aristotélico de matéria, juntamente com toda a sua filosofia, foi aceito oficialmente durante mais de 2000 anos. Nesse período, apenas ao alquimistas aceitavam a existência de elementos básicos. DALTON 1803: modelo da bola de bilhar Primeiro modelo atômico com base experimental. O átomo é uma partícula neutra maciça e indivisível. O modelo vingou até 1897. DALTON 1803: modelo da bola de bilhar A ampola de Crookes Na metade do século XIX, Sir William Crookes desenvolveu um dispositivo para estudar descargas elétricas em gases a baixa pressão (Tubo de Crookes). Este dispositivo era constituído de um tubo com uma saída ligada a um sistema de vácuo e dois eletrodos, sendo um negativo (cátodo) e outro positivo (ânodo), ligados a uma fonte de alta tensão acima de 20.000 V. Tubo A: vácuo mediano com certa incandescência no interior do tubo. Tubos B e C: Quanto menor a pressão interna mais a incandescência aparece em torno do ânodo. Tubo D: a introdução de um pedaço de ZnS possibilita a projeção de uma sombra na parede do ânodo. THOMPSON 1897: pudim de passas Descargas elétricas em alto vácuo (tubos de Crookes) levaram à descoberta do elétron (raios catódicos). O átomo seria uma partícula maciça, mas não indivisível. Seria formado por uma geléia com carga positiva, na qual estariam incrustados os elétrons (modelo do pudim de passas). O número de elétrons seria tal que a carga total do átomo seria zero. THOMPSON 1897: pudim de passas Determinação da relação carga/massa do elétron. Thompson verificou que os raios catódicos sofriam desvio em sua trajetória, caracterizando assim sua natureza negativa. Aplicando os campos elétrico e magnético simultaneamente, Thompson pôde determinar a relação q/m do recém descoberto elétron. Na época: -1,8x1011C/kg Hoje corrigida: -1,76x108C/g PHILIP LENARD 1903 Philip Lenard aperfeiçoou o modelo que descrevia a estrutura dos átomos. Como a matéria é ordinariamente eletricamente neutra (ninguém leva um choque elétrico ao segurar um objeto), Lenard ponderou que as cargas negativas e positivas que compõem os átomos devem anular-se mutuamente. Desta forma, propõe que o átomo seja formado por pares de cargas negativas e positivas distribuídos pelo seu interior. HANTARO NAGAOKA 1904 Foi um grande físico. Nasceu no ano de 1865 no Japão. Nagaoka criou o Modelo Atômico Saturniano, em 1904. O modelo estabelecia que o átomo era formado de um caroço central carregado positivamente e, portanto, rodeado de anéis de elétrons, girando semelhante ao planeta Saturno, por isso, o nome do modelo. Hantaro Nagaoka faleceu no ano de 1950. EINSTEIN 1905 Teoria da relatividade. Relação entre massa e energia (E = mc2). Esclarecimento do efeito fotoelétrico. Denominação fóton para o quantum de energia radiante. A experiência de Millikan 1908 Robert Millikan realizou um experimento pulverizando gotas de óleo entre duas placas metálicas paralelas. Após a irradiação com raios-X, as gotas de óleo receberam elétrons do ar. Millikan impediu que as gotas caíssem com uma variação no campo elétrico entre as placas. Conhecendo a massa da gota de óleo e carga necessária para que esta permanecesse suspensa, Millikan determinou a carga de elétron (-1,602x10-19C). Utilizando a relação c/m do elétron determinada por Thompson, Millikan calculou a massa do elétron (9,1x10-28g). RUTHERFORD 1911 O átomo seria formado por um núcleo muito pequeno, com carga positiva, onde estaria concentrada praticamente toda a sua massa. Ao redor do núcleo ficariam os elétrons, neutralizando sua carga. Este é o modelo do átomo nucleado, um modelo que foi comparado ao sistema planetário, onde o sol seria o núcleo e os planetas seriam os elétrons. Nesta perspectiva, a eletrosfera teria um raio de 104 a 105 vezes maior que o núcleo. RUTHERFORD 1911 CRONOLOGIA DOS MODELOS ATÔMICOS LUZ É uma onda eletromagnética que se propaga no vácuo e possui é um perturbações oscilantes dentro do campo visível do olho humano. c = . c: velocidade da luz = 2,9979246x108m/s : comprimento de onda : freqüência A amplitude esta relacionada com a intensidade do brilho (energia por unidade de volume) da onda. A intensidade é proporcional ao quadrado da amplitude (A2). TESTE DE CHAMA Todo composto químico, quando levado à chama ou exposto a raios catódicos (no caso de gases), emite luz com cor característica. Por exemplo, na figura abaixo podem ser vistas as cores para diversos compostos metálicos quando levados à chama. LINHAS ESPECTRAIS SÉRIES ESPECTRAIS Série de Balmer (luz visível) 1 1 R. 2 2 2 n n 3,4,5,... Série de Paschen (Infravermelho) 1 1 R. 2 2 3 n n 4,5,6,... Série de Lyman (ultravioleta) 1 1 R. 2 2 1 n n 2,3,4,... Série de Brecktt (ultravioleta) 1 1 R. 2 2 4 n n 5,6,7,... R = 3,29 x 1015 Hz (constante de Rydberg) SÉRIES ESPECTRAIS SÉRIES ESPECTRAIS BOHR - 1913 Niels Bohr (1885-1962), físico dinamarquês, resgatou a teoria de Rutherford e sugeriu que as leis que davam conta do movimento dos grandes corpos não eram adequadas para explicar o comportamento do mundo atômico. Assim, utilizando a teoria do alemão Max Planck (pai da Física Quântica), Bohr concebeu a idéia de que um elétron poderia ocupar certas órbitas, ou níveis de energia. Suas previsões foram mais tarde confirmadas experimentalmente por outros cientistas, embora ninguém imaginasse como funcionavam. BOHR - 1913 Postulados: •Os elétrons movem-se ao redor do núcleo em órbitas bem definidas (orbitas estacionárias); •Movendo-se em uma órbita estacionária, o elétron não emite nem absorve energia; •Ao saltar de uma camada para outra, o elétron emite ou absorve uma quantidade definida de energia (quantum) •Niels Bohr mostrou que a energia do elétron na n-ésima órbita do átomo de hidrogênio é dada pela equação: En = – R.h.c/n2, onde R é a constante de Rydberg, h é a constante de Planck e c é a velocidade da luz. Condição de frequência de Bohr BOHR - 1913 Limitações do modelo de Bohr •Pode explicar adequadamente apenas o espectro de linhas do átomo de hidrogênio. •Os elétrons não são completamente descritos como partículas pequenas. A contribuição de Sommerfeld 1916 – Arnold Sommerfeld. Modelo das órbitas elípticas para o elétron - introdução dos subníveis de energia. Para cada camada eletrônica (n), há uma órbita circular e (n-1) orbitas elípticas. Princípio de Dualidade (Louis De Broglie) A todo elétron em movimento está associada uma onda característica, ou seja, ora o elétron se comporta como uma partícula material e ora como uma onda eletromagnética. As sementes para um novo modelo viriam do conceito de que todas as formas de irradiação eletromagnéticas apresentam as propriedades das ondas e das partículas. Esse conceito levou o oficial da marinha Louis de Broglie (1892-1987) a pensar que as partículas da matéria poderiam apresentar características ondulatórias. Utilizando as equações de Einstein e de Planck, De Broglie mostrou: O momento linear (p), mv, é uma propriedade de partícula, enquanto é uma propriedade ondulatória. Princípio da Incerteza (Werner Heisenberg) Não é possível determinar com precisão a posição e a velocidade de um elétron num mesmo instante, pois os próprios instrumentos de medição interferem na trajetória do elétron. x.p 1 2 x incerteza na localização p incerteza no momento linear ħ h/2 = 1,054x10 -34 J.s A mecânica quântica Resultados experimentais com partículas podem ser explicados por padrões como as ondas. Assim, o conceito mecânico ondulatório de Erwin Schöedinger (1887-1961) produziu outra visão do átomo, que substituiu o modelo de Bohr. Quase simultaneamente, A. Rosemberg chegou à mesma conclusão, apesar de ter trilhado caminhos diferentes. Densidade de probabilidade de encontrar o elétron em torno do núcleo. Onde é mais denso, a probabilidade é maior. Sua posição só pode ser estabelecida no momento do experimento. O ÁTOMO O ÁTOMO PARTÍCULAS SUBATÔMICAS Nome Símbolo Localização Núcleo Carga relativa u +1 Carga efetiva C + 1,6.10-19 Massa relativa u 1 Massa efetiva g ~1,67.10- Próton P Nêutron N Núcleo 0 0 1 ~1,67.10- Elétron e- Eletrosfe ra -1 -1,6.10-19 1/1836 ~9,11.10- 24 24 28 Quark Murray Gell-Manm e George Zweig propuseram uma substrutura mais elementar das partículas – o Quark Podemos identificar principalmente duas variedades (sabores) de Quarks: up e down. Quark: Sabor Quark Carga up down charm strange top bottom u d c s t b + 2/3 - 1/3 + 2/3 - 1/3 +2/3 - 1/3 Antiquark u* d* c* s* t* b* Carga Massa -2/3 +1/3 -2/3 +1/3 -2/3 +2/3 0,3 GeV 0,3 GeV 1,5 GeV 0,45 GeV >0,45 GeV 4,9 GeV NÚMERO ATÔMICO É a identificação de um átomo. Corresponde ao número de prótons presentes no núcleo. Z=P OBS.: em um átomo (neutro) o n.º de prótons é igual ao n.º de elétrons. NÚMERO DE MASSA É a somatória de prótons e nêutrons. A=P+N Ex: P=13 Alumínio (Al) N=14 e-=13 Sódio (Na) P=11 N=12 e-=11 Z= Z= 13 A= 11 A= 27 23 MASSA ATÔMICA É a média ponderada das massas atômicas dos átomos isótopos mais abundantes na natureza. Em termos práticos, “é o mesmo” que número de massa (correspondente a massa de carbono12, a ser estudado oportunamente), porém medido em UNIDADES DE MASSA ATÔMICA (u). H=1u C = 12 u N = 14 u O = 16 u MASSA ATÔMICA MASSA MOLECULAR É a massa total de uma molécula (u), obtida pela somatória da massa dos átomos constituintes. Ex: H2O= H2SO4= 18 u 98 u ELEMENTO QUÍMICO É o conjunto de átomos de mesmo número atômico (Z). H2O 3 átomos e 2 elementos CaCO3 5 átomos e 3 elementos ÍONS São átomos ou grupo de átomos com excesso de carga. P ≠ eCÁTIONS (+): perdem elétrons P > eÂNIONS (-): ganham elétrons P < e- ÍONS ÍONS ÁTOMOS ISÓTOPOS São átomos de um mesmo elemento químico que apresentam o mesmo número de prótons e semelhantes propriedades químicas. ISO = mesmo TOPOS = lugar ÁTOMOS ISÓTOPOS Ex:Isótopos do Hidrogênio 1 1H Hidrogênio ou Hidrogênio leve ou prótio 2 Hidrogênio pesado ou deutério H 1 3 Trítio H 1 ÁTOMOS ISÓBAROS São átomos de diferentes elementos químicos que possuem o mesmo número de massa. Ex: 40 K 19 40 Ca 20 ÁTOMOS ISÓTONOS São átomos de diferentes elementos químicos que possuem o mesmo número de nêutrons. Ex: 79 Se 34 80 Br 35 SÉRIE ISOELÊTRONICA São espécies químicas (átomos ou íons) que apresentam a mesma quantidade de elétrons. Ex: -3 N 7 10Ne -2 O 8 +1 Na 11 -1 F 9 +2 Mg 12 ELETROSFERA CAMADAS OU NÍVEIS SUBNÍVEIS Subníveis s p d f Nº máximo de Elétrons 2 6 10 14 ORBITAIS s ORBITAIS p ORBITAIS d NÚMEROS QUÂNTICOS São parâmetros matemáticos, calculados por Paul Dirac, utilizados para determinar a posição de um elétron no átomo. a) N º Quântico Principal (n): Indica a camada (energia). b) N º Quântico Azimutal (l): Indica o subnível. c) N º Quântico Magnético (m): Indica a orbital. d) N º Quântico Spin (s): Indica a rotação de elétrons. NÚMEROS QUÂNTICOS Nome Associado a Número máximo de e– Número quântico principal (n) Energia, raio médio (tamanho) 2.n2 1, 2, 3, ... Número quântico azimutal ou orbital (ℓ) Módulo do momento angular do orbital (forma) 2(2ℓ + 1) 0, 1, 2, ..., n-1 Número quântico magnético (m ou mℓ) Direção do momento angular do orbital 2 0, 1, 2, …, ℓ (2ℓ+1 diferentes valores) Número quântico de spin magnético (S ou ms) Sentido de rotação do e– (estado do spin) -- ½ Valores permitidos NÚMEROS QUÂNTICOS NÚMEROS QUÂNTICOS Elétron mais energético, é aquele que apresenta a maior soma: n+ 6s 6+0 = 6 4f 4+3 = 7 NÚMEROS QUÂNTICOS 5s 5+0 = 5 4s 4+0 = 4 Se dois elétrons apresentarem a mesma soma, terá mais energia aquele que apresentar o maior n. 5s 5+0 = 5 4p 4+1 = 5 PRÍNCIPIO DA EXCLUSÃO DE PAULI Em um mesmo átomo, não existem dois elétrons com quatro números quânticos iguais. Como conseqüência desse princípio, dois elétrons de um mesmo orbital têm spins opostos. Um orbital semicheio contém um elétron desemparelhado. Um orbital cheio contém dois elétrons emparelhados (de spins opostos). Wolfgang Pauli (1900-1958) REGRA DE HUND Ao ser preenchido um subnível, cada orbital desse subnível recebe inicialmente apenas um elétron; somente depois de o último orbital desse subnível ter recebido seu primeiro elétron começa o preenchimento de cada orbital semicheio com o segundo elétron. Friedrich Hermann Hund (1896-1977) ELÉTRON DE DIFERENCIAÇÃO Elétron de maior energia ou elétron de diferenciação é o último elétron distribuído no preenchimento da eletrosfera, de acordo com as regras estudadas. DISTRIBUIÇÃO ELETRÔNICA Diagrama de Linus Pauling DISTRIBUIÇÃO ELETRÔNICA DISTRIBUIÇÃO ELETRÔNICA 2e K (1) 1 s2 8e L (2) 2 s2 2 p6 18e M (3) 3 s2 3 p6 3 d10 32e N (4) 4 s2 4 p6 4 d10 4 f14 32e O (5) 5 s2 5 p6 5 d10 5 f14 18e P (6) 6 s2 6 p6 6 d10 2/8e Q (7) 7 s2 6 p 7 DISTRIBUIÇÃO ELETRÔNICA Hf (Z=72) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d2 Ordem Energética. 1s2 2s2 2p6 3s2 3p63d10 4s2 4p6 4d10 4f14 5s2 5p6 5d2 6s2 Ordem Geométrica. 2e 8e 18e 32e 10e 2e DISTRIBUIÇÃO ELETRÔNICA Hf (Z=72) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d2 Ordem Energética. Xe (Z=54) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 Hf (Z=72) [Xe] 6s2 4f14 5d2 Cerne do Gás Nobre. DISTRIBUIÇÃO ELETRÔNICA 2 s 1 26Fe(26e ) K 2 s2 2 p6 3 s2 3 p6 4 s2 3 d6 L M N M 2+(24e-) 1 s2 2 s2 2 p6 Fe 3 s2 3 p6 3 d6 26 3+(23e-) 1 s2 2 s2 2 p6 Fe 3 s2 3 p6 3 d5 26 REFÊRENCIAS BIBLIOGRÁFICAS •Atkins, Peter & Jones, Loretta. Princípios de Química: questionando a vida moderna e o meio ambiente. trad. Ignez Caracelli ...[et al.] . Porto Alegre, Bookman, 2001. •Brown, T.L., Le May, H.E.Jr e Bursten, B.E. Química, ciência central. Rio de Janeiro, LTC, 1999. •Feltre, Ricardo e Yoshinaga, Setsuo. Físico – Química, vol. 2. São Paulo, Moderna, 1974. •Fonseca, Martha R. M. da. Completamente Química, vol. 1. São Paulo, FTD, 2001. •Kotz, John C. e Treichel Jr, Paul. Química e Reações Químicas. Rio de Janeiro, LTC, 1998. •Mahan, Bruce M.e Myers, Rollie J. Química, um curso universitário. São Paulo, Edgard Blücher, 1995. •Masterton, William L., Slowinski, Emil J. e Stanitski, Conrad L. Princípios de Química. Rio de Janeiro, LTC, 1990. •O’Connor, Rod. Introdução à Química. Trad. Elia Tfouni ... [et al]. São Paulo, Harper & Row do Brasil, 1977. •Russel, John Blair. Química Geral, tradução Márcia Guekezian... São Paulo, Makron Books, 1994. •Ziani Suarez, Paulo Anselmo e Mindim, Kleber Carlos. Química Geral. Brasília, Editora UnB, 2003
Baixar